石家庄市夏季汉族4月龄至14岁健康儿童血清25-羟维生素D和甲状旁腺素的关系
2015-04-20张亚男徐佳琛皮亚雷张会丰
韩 笑 阎 雪 张亚男 徐佳琛 皮亚雷 张会丰
·论著·
石家庄市夏季汉族4月龄至14岁健康儿童血清25-羟维生素D和甲状旁腺素的关系
韩 笑1,3阎 雪1,3张亚男1徐佳琛2皮亚雷1张会丰1
目的 探讨汉族儿童青少年夏季血清25-羟维生素D(25OHD)和甲状旁腺素(PTH)水平的关系,以及儿童青少年是否存在PTH进入平台期的血清25OHD拐点值。方法河北医科大学第二医院儿科生长发育门诊于2011年6~8月及2012年6~8月向社会招募4月龄至14岁健康儿童青少年。分为<1岁、~3岁、~6岁、~10岁和~14岁组。分别采用酶联免疫法和化学发光免疫分析法测定血清25OHD和全段PTH水平。对血清25OHD与PTH水平的关系分别行直线、二次多项式、指数和对数拟合等,计算血清PTH水平进入平台期的血清25OHD阈值。结果共招募632名健康儿童青少年,男童372名,女童260名。①血清25OHD和PTH水平的中位数(P25,P75)分别为56.7(42.2,76.4)nmol·L-1和2.5(2.0,3.3)pmol·L-1。②血清25OHD与PTH在除~10岁组外的其余年龄组中均呈负相关。③二次多项式回归方程能较好反映血清25OHD和PTH之间的曲线关系。回归方程为PTH(pmol·L-1)=4.2698-0.0352·25OHD+0.0002·25OHD2,R2=0.0684。PTH进入平台期时血清25OHD的拐点值为88 nmol·L-1,对应的PTH值为2.72 pmol·L-1。结论4月龄至14岁汉族儿童青少年的血清25OHD和PTH水平呈负相关,且理想的血清25OHD水平可能为88 nmol·L-1。
25-羟维生素D; 维生素D; 甲状腺旁素; 儿童青少年
理想的维生素D营养状况对机体健康至关重要。血清25-羟维生素D(25OHD)是评价机体维生素D营养状况的最佳指标[1]。从机体维生素D适宜水平至不同程度的维生素D缺乏,再至发生维生素D缺乏性佝偻病,血清25OHD有不同的界值水平。血清25OHD<25 nmol·L-1易发生维生素D缺乏性佝偻病。但代表维生素D适宜营养状况时的血清25OHD界值尚未达成一致。
通过血清25OHD与甲状旁腺素(PTH)水平的关系可评估人体适宜的维生素D营养状况[2]。发生维生素D缺乏性佝偻病的病理基础为严重维生素D缺乏导致PTH过度增高,从而损害骨健康。当机体维生素D充足,血清25OHD逐渐升高,肠道钙吸收增加,血钙呈上升趋势,PTH分泌受到抑制。已有研究显示,当血清25OHD水平升高至一定程度时,甲状旁腺分泌PTH逐渐降低,并进入平台期,不再随血清25OHD浓度的升高而降低[3]。可将此时的血清25OHD水平作为机体维生素D营养状况适宜的最低水平。
目前关于血清25OHD与PTH关系的研究多集中于成人,而基于儿童青少年群体的研究相对较少,尤其是中国缺乏类似研究。本研究旨在探讨中国汉族儿童青少年夏季血清25OHD和PTH水平的关系,以及儿童青少年是否存在PTH进入平台期的血清25OHD拐点。
1 方法
1.1 研究对象来源 河北医科大学第二医院(我院)儿科生长发育门诊于2011年6~8月及2012年6~8月向社会招募正常健康儿童青少年。本研究经我院伦理委员会批准,取得儿童监护人的书面知情同意。

1.3 分组 考虑到血清25OHD和PTH水平与儿童年龄密切相关,本研究按年龄分为<1岁、~3岁、~6岁、~10岁和~14岁组。
1.4 标本采集 在我院于清晨空腹采集颈静脉、股静脉或肘静脉血4 mL,不抗凝,室温放置20~40 min使其充分凝血,然后以2 000 r·min-1离心15 min,将血清保存于-20℃冰箱待测。
1.5 实验室检测 采用全自动酶标仪(Wellscan MK3,Labsystems,芬兰)以酶联免疫法(IDS公司试剂盒,英国)测定血清25OHD水平;化学发光免疫分析法(Beckman Access2,美国)测定全段PTH水平;全自动生化分析仪(Beckman,美国)检测血清总碱性磷酸酶(ALP)、钙(Ca)和磷(P)水平。所有检测方法及检测仪器均符合我院实验室的质控标准。

2 结果
2.1 一般情况 研究期间共招募符合本文纳入和排除标准的儿童青少年632名,其中男童372名,女童260名。<1岁组42例,~3岁组161例,~6岁组170例,~10岁组138例,~14岁组121例。血清Ca、P和ALP水平均在正常范围(Ca:2.25~2.75 mmol·L-1,P:0.96~1.62 mmol·L-1,ALP: 86~315 U·L-1)。632名研究对象的基本情况见表1。
2.2 血清25OHD和PTH水平总体情况 632名研究对象血清25OHD中位值(P25,P75)为56.7(42.2,76.4)nmol·L-1,范围10~156.5 nmol·L-1;血清PTH中位值(P25,P75)为2.5(2.0,3.3)pmol·L-1,范围0.32~10.4 pmol·L-1。不同年龄组血清25OHD和PTH水平见表1,随年龄增长,25OHD水平总体呈下降趋势。
2.3 不同年龄组血清25OHD、PTH水平和年龄的相关性 表2所示,除~10岁组外,血清25OHD与PTH在其他年龄组中均呈负相关;血清25OHD与年龄的关系,<1岁组呈正相关,~6岁、~14岁组均呈负相关,余年龄组无显著相关性;血清PTH与年龄的关系,~10岁组呈正相关,余年龄组无显著相关性。
2.4 血清25OHD与PTH之间的曲线回归分析 对血清25OHD与PTH浓度值进行了直线(R2=0.058)、二次多项式拟合(R2=0.068 4)、指数拟合(R2=0.056)、对数拟合(R2=0.057)等,其中二次多项式回归方程能较好地反映两者间的曲线关系(图1)。二次多项式曲线回归方程为PTH(pmol·L-1)=4.2698-0.0352·25OHD+0.0002·25OHD2。血清25OHD水平单位为nmol·L-1。令二次多项式的一阶导数为0,即-0.0352+2×0.0002·OHD=0,求得血清25OHD水平为88 nmol·L-1,即为PTH进入平台期时血清25OHD的拐点值,相应的血清PTH值为2.72 pmol·L-1。

表1 632名研究对象的基本情况Tab 1 Clinical features of the 632 subjects
Notes 25OHD: 25-hydroxyvitamin D; PTH: parathyroid hormone; Ca: calcium; P: phosphorus; ALP: alkaline phosphates
表2 不同年龄组血清25OHD、PTH和年龄的相关性
Tab 2 Correlation among 25OHD, PTH and age in different age groups

Groups25OHD-PTHrP25OHD-agerPPTH-agerP<1y-0.3630.0200.412<0.001-0.1910.231-3y-0.2350.003-0.0720.362-0.0350.661-6y-0.1740.023-0.1730.0240.0380.619-10y-0.1450.090-0.1110.1940.1990.019-14y-0.2310.011-0.2900.0010.0740.422Total-0.246<0.001-0.643<0.0010.150<0.001
Notes y: year(s); 25OHD: 25-hydroxyvitamin D; PTH: parathyroid hormone
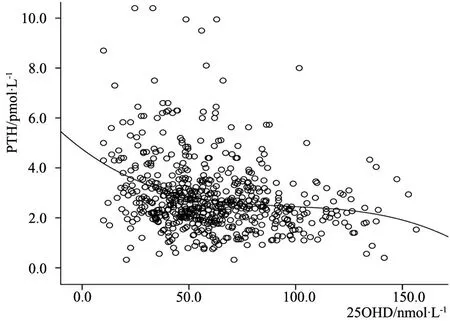
图1 血清25OHD及PTH的关系散点图
Fig 1 The scatter plot of serum 25OHD and PTH
Notes 25OHD: 25-hydroxyvitamin D; PTH: parathyroid hormone
3 讨论
3.1 血清25OHD与PTH的关系 为保证研究对象的均质性,本研究选择单一季节(夏季),单一地区(中国北部城市石家庄114∶26E38∶03N)、单一种族(汉族)的儿童和青少年作为研究对象。本研究未进行样本量计算,从建立的曲线关系看,本研究纳入分析的632名儿童对说明指标间的相关关系已足够,本研究实际样本量远大于国外已发表相关研究,中国目前无类似研究结果报告。
本文25OHD水平呈现随年龄增长而降低的趋势,考虑可能与中国目前推荐维生素D补充至2岁有关,随着年龄增长,维生素D补充意识减弱,此外也可能与户外活动时间因上学减少有关。
本研究结果显示,血清25OHD与PTH水平呈显著负相关(r=-0.246),此结果与如下国外多项研究一致:Abrams等[5]观察了(12.7±1.0)岁儿童血清25OHD与PTH水平的关系,两者呈负相关(r=-0.41),血清25OHD和PTH水平分别为(69.8±19.8)nmol·L-1和(3.9±2.0)pmol·L-1;Houghton等[6]观察了144名4个季节的12~22月龄儿童,血清25OHD与PTH水平存在显著相关,当25OHD低于60~65 nmol·L-1时,血清PTH水平显著升高;调整季节后25OHD平均浓度为52.3 nmol·L-1,血清PTH的中位数(P25,P75)为0.9(0.3,1.6) pmol·L-1;Arabi等[7]研究显示,无论是10~17岁的青少年还是65~85岁的老年人,血清25OHD与PTH水平均呈负相关,相关系数分别为-0.16和-0.20,青少年和老年人血清25OHD水平分别为(38.3±18.8)和(28.5±13.2)nmol·L-1,PTH水平分别为(2.0±2.2)和(4.7±5.0)pmol·L-1;美国波士顿一项研究[5]显示,青春期儿童血清25OHD与PTH水平呈负相关(r=-0.41),42%的研究对象血清25OHD<50 nmol·L-1;Sai等[8]对488名65~78岁老年妇女检测血清25OHD和PTH水平分别为(78.5±26.2)nmol·L-1和(4.0±1.6)pmol·L-1;两者呈负相关,r=-0.338。
3.2 血清25OHD水平的拐点值问题 Sai等[8]综述了全世界范围1998至2010年涉及血清25OHD与PTH关系的70篇文献,报道的PTH抑制或达到平台期的血清25OHD浓度(拐点)变异性很大,1篇文献≤25 nmol·L-1,7篇文献在~37.5 nmol·L-1,18篇文献在~50 nmol·L-1,6篇文献在~62.5 nmol·L-1,10篇文献在~75 nmol·L-1,10篇文献在~87.5 nmol·L-1,4篇文献在~100 nmol·L-1,3篇文献在~125 nmol·L-1;8篇文献未发现PTH平台期,3篇文献结果显示血清25OHD与PTH无相关性。Heaney等[9]研究显示,当血清25OHD>80 nmol·L-1时,PTH才能维持恒定并处于最佳的生理浓度。Houghton等[6]对12~22月龄婴儿进行了观察,结果显示当血清25OHD>60~65 nmol·L-1时,PTH进入平台期,血清25OHD拐点为61.4 nmol·L-1,此时PTH达到最大抑制状况,血清25OHD的平均浓度为52 nmol·L-1。Sai等[7]研究显示488名平均年龄71岁的高加索老年妇女血清25OHD水平处于15~150 nmol·L-1,未发现PTH出现抑制状态的血清25OHD阈值。Hill等[10]对7~18岁儿童青少年的研究显示,血清25OHD与PTH为线性关系,不能证实当PTH达最大抑制状态时存在血清25OHD拐点值。
上述文献提示,导致PTH升高的血清25OHD浓度为25~122 nmol·L-1,大部分文献得出的血清25OHD阈值在40~50 nmol·L-1或75~80 nmol·L-1[8~11]。相对于大部分文献所报道的血清25OHD拐点值,本研究血清25OHD的拐点水平88 nmol·L-1属于较高的水平。血钙是影响PTH分泌的最直接因素,钙摄入量与维生素D和PTH的关系密不可分,同时钙摄入量和维生素D营养状况亦可影响血钙变化[12]。在上述多项研究中未考虑钙摄入量,钙的实际摄入量不同可能是导致血清25OHD浓度范围如此宽泛的原因。本研究得出的较高水平血清25OHD拐点值(88 nmol·L-1),可能与中国儿童青少年钙摄入量偏低有关,而高钙摄入量(1 200~1 500 mg·d-1)的非洲裔美国绝经妇女(50~75岁)血清25OHD的拐点约为44 nmol·L-1[10]。
3.3 年龄及性别对血清25OHD与PTH的关系的影响 年龄是影响血清25OHD及PTH关系的主要因素[13]。本研究除<1岁组外,~6岁和~14岁组年龄与血清25OHD呈负相关。Arabi等[5]认为PTH伴随年龄增加逐渐上升的趋势是独立于维生素D营养状况之外的。老年人PTH高于青年人,调整25OHD水平影响后,PTH与年龄仍然呈现相关关系,这表明PTH伴随衰老进程水平逐渐升高,独立于维生素D营养状态之外。本研究中年龄与PTH不显著的相关关系,可能是研究对象的年龄不同导致,对于老年人群,骨吸收作用增强,PTH呈现年龄相关的增加。而婴幼儿和青少年处于骨塑造和骨生长阶段,骨合成远大于骨吸收。
依据年龄相关的病理生理学机制,老年人可能存在某种程度的25OHD抵抗。在一项大规模队列研究中[14],血清25OHD水平>100 nmol·L-1的老年人PTH与青年人血清25OHD水平70 nmol·L-1时PTH水平匹配。当调整年龄后,血清25OHD与PTH相关性减弱。老年人血清25OHD普遍偏低,而PTH水平普遍偏高。在同样的血清25OHD范围内,老年人PTH水平比青少年高1.5~2倍。儿童与成人、老年人PTH水平的差别可能涉及钙吸收效能,包括非维生素D依赖钙吸收、25OHD转换为1,25-羟维生素D的能力。
综上所述,4月龄至14岁中国儿童青少年的血清25OHD与PTH呈负相关,其理想的血清25OHD水平可能为88 nmol·L-1。
本文的不足之处和局限性:按年龄分组后,<1岁组的样本量较小,仍有待扩大样本进一步研究。
[1]Holick MF. Resurrection of vitamin D deficiency and rickets. J Clin Invest, 2006, 116(8):2062-2072
[2]Holick MF, Garabedian M. Vitamin D: photobiology, metabolism, mechanism of action, and clinical applications. In: Favus MJ, ed. Primer on the metabolic bone diseases and disorders of mineral metabolism. 6th ed. Washington, DC: American Society for Bone and Mineral Research, 2006: 129-137
[3]Han SW, Kim SJ, Lee DJ, et al. The Relationship between Serum 25-Hydroxyvitamin D, Parathyroid Hormone and the Glomerular Filtration Rate in Korean Adults: The Korea National Health and Nutrition Examination Survey between 2009 and 2011. Korean J Fam Med, 2014, 35(2): 98-106
[4]Li H(李辉), Ji CY, Zong XN, et al.Height and weight standardized growth charts for Chinese children and adolescents aged 0 to 18 years. Chin J Pediatr(中华儿科杂志),2009,47(7):487-492
[5]Abrams SA, Griffin IJ, Hawthorne KM, et al. Relationships among vitamin D levels, parathyroid hormone, and calcium absorption in young adolescents. J Clin Endocrinol Metab, 2005, 90(10): 5576-5581
[6]Houghton LA, Szymlek-Gay EA, Gray AR, et al. Predictors of vitamin D status and its association with parathyroid hormone in young New Zealand children. Am J Clin Nutr, 2010, 92(1): 69-76
[7]Arabi A, Baddoura R, Awada H, et al. Hypovitaminosis D osteopathy: Is it mediated through PTH, lean mass, or is it a direct effect? Bone, 2006, 39 (2):268-275
[8]Sai AJ, Walters RW, Fang X, et al. Relationship between vitamin D, parathyroid hormone, and bone health. J Clin Endocrinol Metab, 2011, 96(3): E436-446
[9]Heaney RP, Dowell MS, Hale CA, et al. Calcium absorption varies within the reference range for serum 25-hydroxyvitamin D. J Am Coll Nutr, 2003, 22(2):142-146
[10]Aloia JF, Talwar SA, Pollack S, et al. Optimal vitamin D status and serum parathyroid hormone concentrations in African American women. Am J Clin Nutr, 2006, 84(3): 602-609
[11]Hill KM, McCabe GP, McCabe LD, et al. An inflection point of serum 25-hydroxyvitamin D for maximal suppression of parathyroid hormone is not evident from multi-site pooled data in children and adolescents. J Nutr, 2010, 140(11): 1983-1988
[12]Steingrimsdottir L, Gunnarsson O, Indridason OS, et al. Relationship between serum parathyroid hormone levels, vitamin D sufficiency, and calcium intake. JAMA, 2005, 294(18):2336-2341
[13]Speoker BL, Lichtenstein P, Mimouni F, et al. Calcium-regulating hormones and minerals from birth to 18 months of age: a cross-sectional study. II. Effects of sex, race, age, season, and diet on serum minerals, parathyroid hormone, and calcitonin. Pediatrics, 1986, 77(6):891
[14]Adami S, Viapiana O, Gatti D, et al. Relationship between serum parathyroid hormone, vitamin D sufficiency, age, and calcium intake. Bone, 2008, 42(2): 267-270
(本文编辑:张萍)
Relationship between serum 25-hydroxyvitamin D and parathyroid hormone of Chinese Han children aged from 4 months to 14 years during summer in Shijiazhuang city
HANXiao1,3,YANXue1,3,ZHANGYa-nan1,XUJia-chen2,PIYa-lei1,ZHANGHui-feng1
(1DepartmentofPediatrics,TheSecondHospitalofHebeiUniversity,Shijiazhuang050000,China; 2DepartmentofPediatrics,TheFirstHospitalofQinhuangdao,Qinhuangdao066000,China; 3Co-firstauthor)
ZHANG Hui-feng,E-mail:hfzhang@vip.sohu.com
ObjectiveTo explore the relationship between serum 25-hydroxyvitamin D (25OHD) and intact parathyroid hormone (PTH) of Chinese children aged from 4 months to 14 years and to examine a threshold value of serum 25OHD at which serum iPTH levels decreased and reached a plateau.MethodsThe subjects aged from 4 months to 14 years who came to division of nutrition, growth and development & endocrinology of department of pediatrics, Second Hospital of Hebei Medical University during June to August in 2011 and 2012 for health examination were recruited on the basis of informed consent. Fasting venous blood was collected and serum 25OHD, PTH, alkaline phosphates (ALP), calcium (Ca) and phosphorus (P) were assayed. Data were analyzed by using SPSS 13.0 software. Multiple linear regressions were used between variables besides bivariate correlations. Linear and quadratic polynomial fitting, cubic polynomial fitting and Loess fitting were used to assess the relationship between 25OHD and iPTH respectively.ResultsA total of 632 subjects including 372 boys and 260 girls were recruited. ①Serum 25OHD was inversely correlated with serum PTH (R=-0.246,P<0.001). Serum 25OHD was inversely correlated with age (R=-0.643,P<0.001). Serum PTH was positively correlated with age (R=0.15,P<0.001). ②According to the scatter plot of 25OHD and PTH, the quadratic polynomial fitting was the best one to describe the relation. The equation was PTH(pmol·L-1)=4.2698-0.0352D+0.0002D2(R2=0.068 4). D referred to serum 25OHD levels (nmol·L-1). When differential coefficient equaled to 0, the 25OHD level was 88 nmol·L-1. So 88 nmol·L-1was considered as the cutoff value at which serum PTH levels decreased and reached a plateau. When serum 25OHD was 88 nmol·L-1, the serum PTH level was 2.72 pmol·L-1.ConclusionIn 4 months to 14 years old Chinese children, serum 25OHD inversely correlates with serum iPTH. The ideal serum 25-hydroxyvitamin D levels may be 88 nmol·L-1for Chinese infants, children and adolescents.
25-hydroxyvitamin D; Vitamin D; Parathyroid hormone; Children
1 河北医科大学第二医院儿科营养生长发育及内分泌专业 石家庄,050000;2 秦皇岛市第一医院儿科 秦皇岛,066000;3 并列第一作者
张会丰,E-mail:hfzhang@vip.sohu.com
10.3969/j.issn.1673-5501.2015.03.009
2014-11-05
2015-03-23)
