3,5-二羟基苯甲酸甲酯催化加氢制备3,5-二羟基甲苯及反应历程研究
2015-04-19陆樊委张伟鲁墨弘李明时单玉华朱建军
陆樊委,张伟,鲁墨弘,李明时,单玉华,朱建军
(常州大学石油化工学院,江苏 常州 213164)
3,5-二羟基苯甲酸甲酯催化加氢制备3,5-二羟基甲苯及反应历程研究
陆樊委,张伟,鲁墨弘,李明时*,单玉华,朱建军
(常州大学石油化工学院,江苏 常州 213164)
制备了Cu-Zn-Al催化剂,用于3,5-二羟基苯甲酸甲酯加氢反应。考察了加氢工艺条件及羟基对苯环加氢的影响。结果表明:在反应温度200 ℃和压力8 MPa下,反应时间3 h,3,5-二羟基苯甲酸甲酯的转化率为80.5%,3,5-二羟基甲苯的选择性为97.7%。反应生成的3,5-二羟基甲苯易被进一步加氢生成3-甲基环己醇;苯环上羟基的存在,使苯环的电子云密度增加,从而使苯环活化,易被进一步加氢;苯环上的醛基和羟甲基容易被进一步加氢,验证了3,5-二羟基苯甲酸甲酯加氢经3,5-二羟基苯甲醛和3,5-二羟基苯甲醇,进一步加氢生成3,5-二羟基甲苯的反应历程。
铜锌铝催化剂 3,5-二羟基苯甲酸甲酯 3,5-二羟基甲苯 反应历程
3,5-二羟基甲苯(DHT),又称地衣酚或苔黑酚,是合成联香豆素化合物和白藜芦醇[1]的重要原料,也被应用于显色剂,用于各种化学检测。DHT具有其他药物所无法比拟的抗真菌和抗细菌活性,因而在医药和生物领域有巨大的发展潜力[2-3]。合成DHT的方法有以下几种:1)环化法[4]。以巴豆酸乙酯和乙酰乙酸乙酯为原料,在乙醇钠的作用下使其发生环合反应,经溴化,催化氢解,再水解脱羧得到产物。2)磺化法[5]。以对甲苯胺为原料,经过浓H2SO4磺化得到磺化产物,再经过重氮化后直接水解脱氨基得到5-甲基-1,3-苯二磺酸的钠盐,最后碱融和酸化制得终产物。3)硝化法:以对(或邻)甲苯胺为原料,利用硝化反应[6]得到3,5-二硝基-4-氨基甲苯,同时在乙醇介质中一步完成重氮化和氢解反应得到3,5-二硝基甲苯,然后用Pd/C催化加氢得到3,5-二氨基甲苯,再经过重氮化和水解反应得到DGT。4)高温脱氯水解法[7]:以3-甲基-4-氯苯酚为原料,经过碱融高温脱氯,然后酸化水解,最后分离得到DGT。
本实验通过催化加氢法,以3,5-二羟基苯甲酸甲酯[8]为原料,经过选择性加氢反应直接制备3,5-二羟基甲苯。该合成工艺简单,反应时间短。
1 实验部分
1.1 催化剂的制备
根据文献[9-11],分别制备了Cu-Zn-Al, Cu-Zn-Mn和Cu/SiO2催化剂。采用逆流共沉淀法制备了Cu-Al-Ba催化剂:按照一定的摩尔比称取一定量的Cu(NO3)2·3H2O、Al(NO3)3·9H2O、Ba(NO3)2,在烧杯中配成10%的混合盐溶液,并称取一定量的沉淀剂(无水碳酸钠)配制成10%的Na2CO3溶液,在80 ℃水浴锅中,强烈搅拌下将混合盐溶液滴加到沉淀剂中,并控制pH值在8~9,在80 ℃水浴中老化3 h后,经过滤,水洗和干燥,于550 ℃下焙烧2 h。在H2气氛下,230 ℃还原上述的催化剂前驱体,冷却至温度用N2钝化,得到反应催化剂。
1.2 加氢反应
在80 mL间歇式高压反应釜中,分别加入原料,溶剂无水甲醇和催化剂。密闭高压釜,关闭进出气阀,先采用氮气置换出釜内的空气,再用氢气置换出氮气,然后通入2.0 MPa的氢气,并打开加热装置和搅拌器,程序升温至反应温度后,加压至反应压力。反应过程中,保持温度稳定,并且不断补充反应消耗的H2至反应结束。冷却后泄压,出料并滤除催化剂,得到的反应液采用气相色谱仪分析(CP-Sil 24CB毛细管柱,FID检测器),以面积归一法定量分析反应液中原料和产物,计算转化率和选择性。
2 结果与讨论
2.1 催化剂的选择
表1为Cu催化剂在高压反应釜中对3,5-二羟基苯甲酸甲酯加氢反应的催化性能。
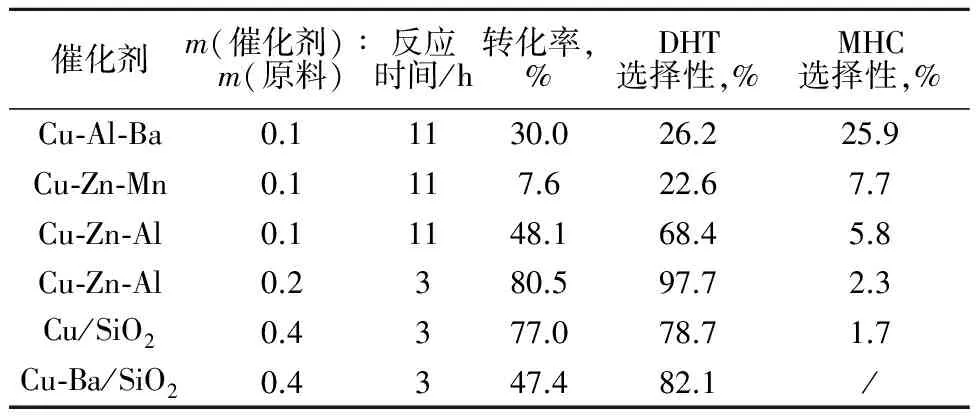
表1 不同催化剂对反应的影响
注:反应温度200 ℃,反应压力8 MPa,催化剂还原温度230 ℃。
3,5-二羟基苯甲酸甲酯加氢反应主要产物为3,5-二羟基甲苯(DHT),副产物为3-甲基环己醇(MHC)。由表1可以看出,Cu-Zn-Al催化剂对3,5-二羟基苯甲酸甲酯的转化率和DHT的选择性均较高,因此,选择Cu-Zn-Al催化剂进行反应历程研究。
2.2 反应历程的探索
以 Cu-Zn-Al为反应催化剂,在反应温度200 ℃和压力8 MPa下进行反应,采用气象色谱进行分析,检测反应物和各种反应产物随着反应时间的变化。在反应过程中,检测到的反应产物分别为:3,5-二羟基苯甲醇(DHBL)、3,5-二羟基甲苯(DHT)、和3-甲基环己醇(MHC),如图1。
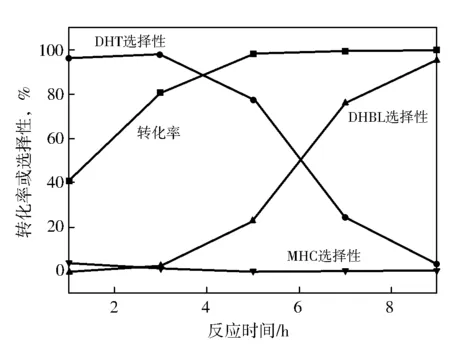
图1 3,5-二羟基苯甲酸甲酯转化率和选择性随反应时间的变化催化剂0.75 g,原料5 g,无水甲醇,25 mL。
由图1得出,3,5-二羟基苯甲酸甲酯的转化率随反应时间的延长而增加。在反应的初始阶段检测到了少量的DHBL,但DHBL不稳定,易被继续加氢生成DHT。而DHT的选择性随着反应时间的延长而下降,同时MHC的选择性随着反应时间的延长而上升。说明DHT随着反应时间的延长,不断地转化成MHC。3,5-二羟基苯甲酸甲酯的加氢反应的可能反应历程,如图2所示:
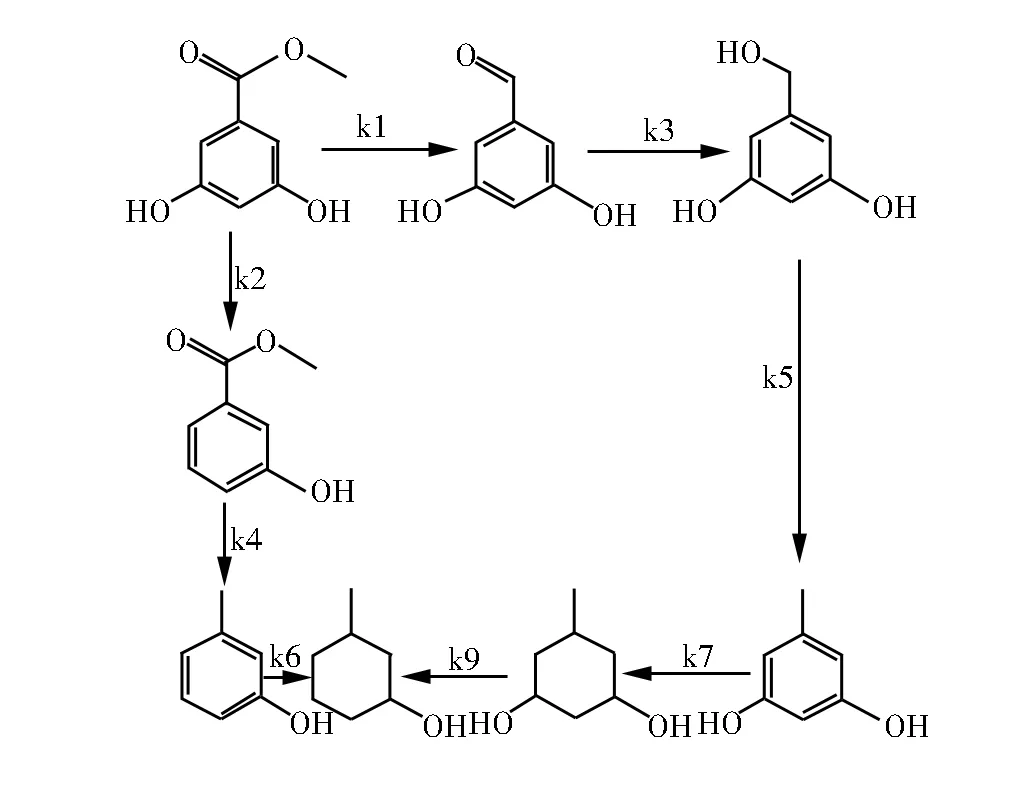
图2 3,5-二羟基苯甲酸甲酯的加氢反应历程
反应过程既没有检测到3-羟基苯甲酸甲酯,也没有检测到3-甲基苯酚,说明在实验条件下,3,5-二羟基苯甲酸甲酯加氢反应主要沿着k1,k3,k5,k7,k9的历程进行。
2.3 苯环上不同取代基对加氢反应的影响:
为了进一步理解3,5-二羟基苯甲酸甲酯加氢反应历程,在相同反应条件下,分别考察了间羟基苯甲酸甲酯、苯甲酸甲酯、苯甲醛、苯甲醇和甲苯的相对加氢反应速率。
2.3.1 间羟基苯甲酸甲酯加氢反应:
采用间羟基苯甲酸甲酯为原料,考察苯环上只有一个羟基时反应情况,结果见表2。

表2 间羟基苯甲酸甲酯反应情况
注:催化剂0.75 g,原料5 g,无水甲醇25 mL,反应温度200 ℃,反应压力8 MPa。
由表2可以看出:在反应进行到1 h转化率就达到了99.6%,反应主要产物是间甲酚,随着反应时间延长,有部分间甲酚进一步加氢生成3-甲基环己醇。
间羟基苯甲酸甲酯反应较快,为了研究反应转化率和选择性随着时间的变化趋势,将催化剂的量减为原来的1/5(0.15 g)时,反应情况如图3所示。
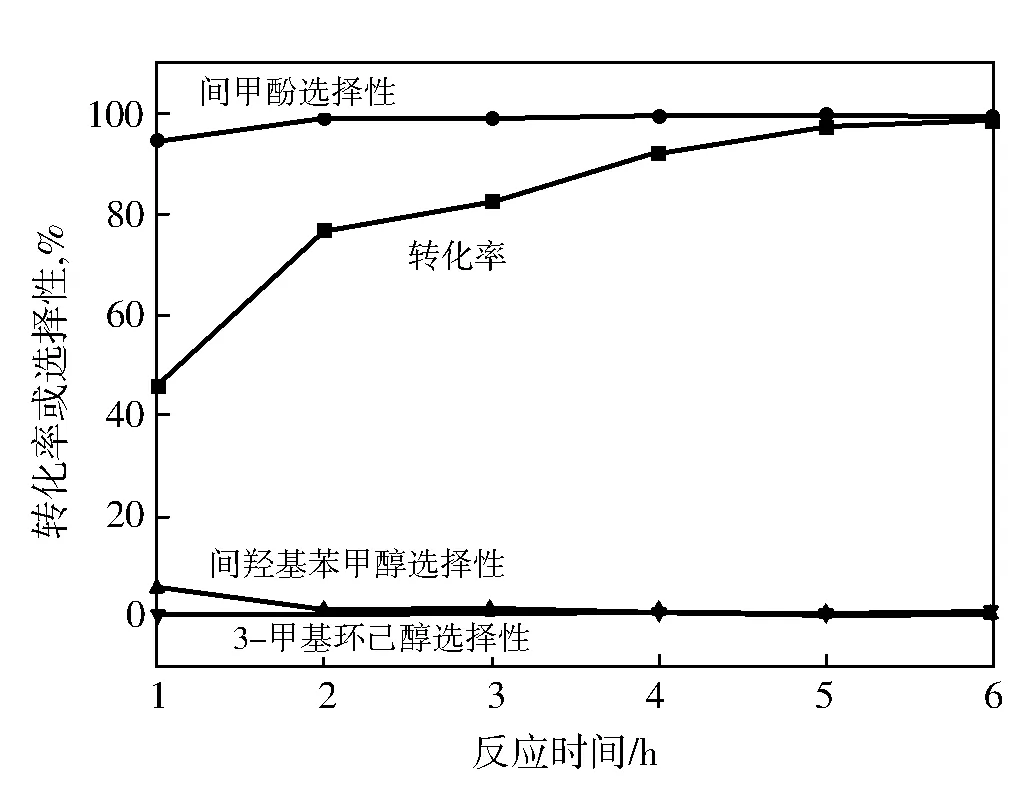
图3 间羟基苯甲酸甲酯的转化率和选择性随反应时间的变化曲线
从图3可以看出,当催化剂的量减少时,反应过程中出现了中间产物间羟基苯甲醇,随着反应的进行,进一步加氢脱水生成间甲酚,说明生成的间羟基苯甲醇易加氢变成间甲酚。随着反应的进行,只有极少量的间甲酚会进一步加氢生成3-甲基环己醇,说明间甲酚较为稳定,苯环不太容易被加氢。
比较间羟基苯甲酸甲酯与3,5-二羟基苯甲酸甲酯的加氢过程,可以看出,在两个羟基存在下,苯环被活化,更容易加氢饱和生成5-甲基-1,3-环己二醇,后者极易脱羟基生成3-甲基环己醇。另一方面,间羟基苯甲酸甲酯加氢生成间羟基甲苯的相对速率比3,5-二羟基苯甲酸甲酯加氢生成3,5-二羟基甲苯的速率快,这可能是由于3,5-二羟基苯甲酸甲酯空间位阻较大引起的。
2.3.2 苯甲酸甲酯加氢反应:
采用苯甲酸甲酯为原料,考察苯环上没有羟基时反应情况,结果见表3。
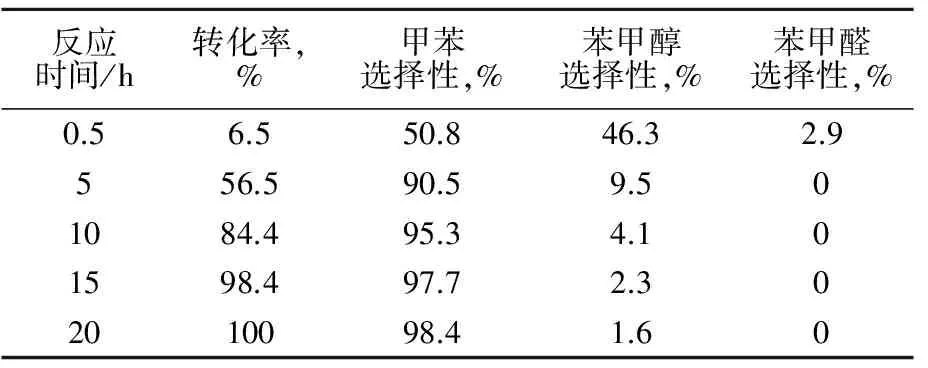
表3 苯甲酸甲酯反应情况
注:催化剂0.75 g,原料5 g,无水甲醇25 mL,反应温度200 ℃,反应压力8 MPa。
由表3看出:苯甲酸甲酯的加氢速率缓慢,反应主产物为甲苯和苯甲醇。反应反应初始阶段生成了苯甲醛,随着反应的进行,苯甲醛进一步反应成苯甲醇然后苯甲醇进一步加氢脱水生成甲苯。苯环上没有羟基存在时,羧酯基的加氢反应速率较慢,且不存在苯环加氢。
对比上述3个反应可以看出,间羟基苯甲酸和3,5-二羟基苯甲酸的加氢速率比苯甲酸甲酯快得多,说苯环上的羟基可促进苯环上酯基加氢生成甲基。另一方面,苯环上没有羟基存在时,生成的甲苯很稳定,苯环不会进一步被加氢。苯环上有一个羟基时,只有少量苯环加氢饱和产物,而两个羟基存在时,几乎完全转化为苯环加氢饱和产物。由此说明,苯环上羟基,既促进了酯基加氢也促进了苯环加氢。对苯环上羟基而言,其给电性的共轭效应大于吸电性的诱导效应,使苯环上电子云密度增加,从而使苯环活化[12],同时给电性的共轭效应也使得与苯环共轭的酯基中的CO键电子云密度增加,从而易加氢脱氧生成甲基。
2.3.3 苯甲醛的加氢反应:
采用苯甲醛为原料,反应情况见表4。
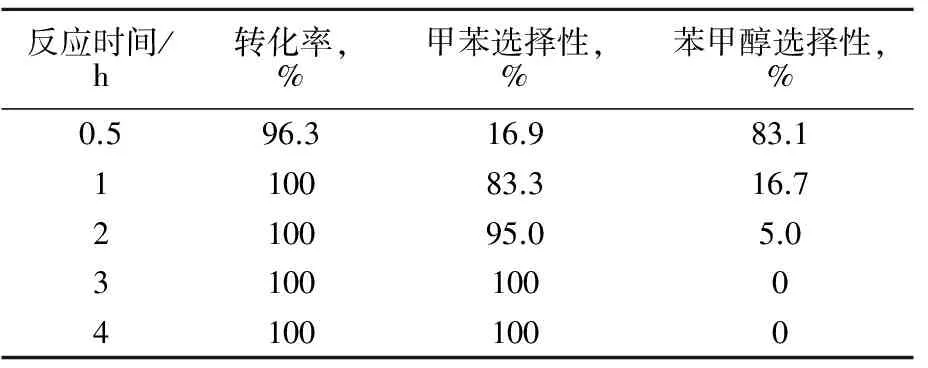
表4 苯甲醛反应情况
注:原料3.9 g(0.037 mol),催化剂0.15 g,无水甲醇25 mL,反应温度200 ℃,反应压力8 MPa。
由表4可以看出,在反应条件下,苯甲醛先转化为苯甲醇,然后苯甲醇进一步加氢生成甲苯。
苯甲醛反应较快,为了研究该反应转化率和选择性随着时间的变化趋势,将催化剂的量减为原来1/5(0.03 g)时,反应情况如图4所示。

图4 苯甲醛的转化率和选择性随反应时间的变化曲线
从图4可以看出,当催化剂的量减少时,苯甲醛的反应速率仍然很快,说明苯甲醛易生成苯甲醇。在反应过程中,苯甲醇的选择性不断下降,甲苯的选择性不断升高,从而最终反应生成甲苯。
2.3.4 苯甲醇的加氢反应:
采用苯甲醇为原料,反应情况见表5。

表5 苯甲醇反应情况
注:原料4 g(0.037 mol ),催化剂0.15 g,无水甲醇,25 mL,反应温度200 ℃,反应压力8 MPa
由表5看出,苯甲醇的反应速率较快,反应3 h完全转化为甲苯。说明苯甲醇在该反应条件下容易加氢脱水生成甲苯。
2.3.5 甲苯的加氢反应:
采用甲苯为原料,在反应温度为200 ℃,反应压力为8 MPa过程中不消耗氢气,反应7 h后通过GC对反应产物进行分析,没有检测到甲基环己烷,说明在Cu系催化剂下甲基对苯环几乎没有活化作用,不能使苯环进一步加氢。
对比在同一物质量,同一反应时间,使用相同量催化剂条件下,苯甲醛,苯甲醇和甲苯的反应速率,可以发现,苯甲醛的反应速率比苯甲醇的快,而甲苯几乎不反应,说明醛基和羟甲基都不稳定,容易被进加氢生成甲苯。从而进一步验证了3,5-二羟基苯甲酸甲酯的反应历程中,3,5-二羟基苯甲醛和3,5-二羟基苯甲醇都容易进一步加氢生成3,5-二羟基甲苯。
3 结 论
采用Cu-Zn-Al催化剂,在反应温度200 ℃和压力8 MPa下,反应时间3 h,3,5-二羟基苯甲酸甲酯的转化率为80.5%,3,5-二羟基甲苯的选择性为97.7% 。如反应时间过长,生成的3,5-二羟基甲苯会被进一步加氢生成3-甲基环己醇。
苯环上羟基对酯基和苯环加氢过程中,苯环上羟基的存在,由于给电子共轭效应,使苯环的电子云密度增加,从而使苯环及其上的共轭羰基活化,易发生加氢反应。
苯环上的醛基和羟甲基都不稳定,容易被进一步加氢生成甲苯,验证了3,5-二羟基苯甲酸甲酯加氢生成的3,5-二羟基苯甲醛、3,5-二羟基苯甲醇,进而生成3,5-二羟基甲苯的反应历程。
[1] 都建立,邹永,肖春芬.白藜芦醇的简便合成[J] .精细化工,2009,26(06):580-584.
[2] Jang M, Cai L, Udeani G O, et al. Cancer chemopreventive activity of resveratrol, a natural product derived from grapes [J]. Science, 1997, 275(5297):218-220.
[3] Lytollis W, Scannell R T, Hao Y A, et al. 5-Alkylresorcinols from hakea trifurcate, that cleave DNA [J].J Am Chem Soc. 1995, 117(51):12683-12690.
[4] Anker R M, Cook A H. A new synthesis of olivetol [J]. J Chem Soc, 1945:311-313.
[5] Chan J H, Hong J S. 2-Amino-6-arylsulfonylbenzonitriles as Non-nucleoside Reverse Transcriptase Inhibitors of HIV-1[J]. J Med Chem, 2001, 44(12): 1866-1882.
[6] McKay E. Pentose estimation by the orcinol method, with particular reference to plasma pentose [J]. Clin. Chim . Acta. 1964, 10(4): 320-329.
[7] 钱洪胜,钟光祥,陈利民,等.3,5-二羟基甲苯的合成研究[J].浙江工业大学学报,2004,32(5):578-580.
[8] 粟璐,朱志庆.3,5-二羟基苯甲酸甲酯催化加氢制备3,5-二羟基甲苯[J].上海化工,2009,34(3):6-10.
[9] Wang S, Liu H C. Selective hydrogenolysis of glycerol to propylene glycol on hydroxycarbonate - derived Cu-ZnO-Al2O3catalysts [J]. Chin J Catal, 2014, 35(5): 631-643.
[10] 阴秀丽,常杰,汪俊锋,等.Cu/Zn/Al/Mn催化剂上CO/CO2加氢合成甲醇特性研究[J] .燃料化学学报,2004,32(4):492-497.
[11] 徐华龙,黄静静,杨新艳,等.K-MnO/-Al2O3和Cu/SiO2催化剂应用于苯甲酸甲酯连续加氢合成无氯苯甲醇[J] .化学学报,2006,64(16):1615-1621.
[12] 周子英.取代基对苯环活性的影响[J].内蒙古石油化工,2003,29(2):18-19.
PREPARATION AND REACTION MECHANISM OF 3,5-DIHYDROXYTOLUENE FROM METHYL 3,5-DIHYDROXYBENZOATE BY CATALYTIC HYDROGENATION
Lu Fanwei, Zhang Wei, Lu Mohong, Li Mingshi, Shan Yuhua, Zhu Jianjun
(DepartmentofPetrochemicalEngineering,ChangzhouUniversity,Changzhou213164,Jiangsu,China)
Different catalysts were prepared for the synthesis of 3,5-dihydroxytoluene by hydrogena-tion of methyl 3,5-dihydroxybenzoate and their catalytic performance were evaluated. Results showed that high selectivity of 97.7% to 3,5-dihydroxytoluene with 80.5% conversion of methyl 3,5-dihydroxybenzoate was obtained over the selected Cu-Zn-Al catalyst under reaction conditions of 200 ℃ and 8 MPa at the reaction time of 3 h. The benzene ring of 3,5-dihydroxytoluene was unstable in the reaction conditions which resulted in the formation of 3-methylcyclohexanol. Hydroxyl in benzene ring increased the electron cloud density of benzene ring, which led to activation of benzene ring and benzene ring was easy to be further hydrogenated. Aldehyde group and hydroxymethyl in benzene ring was unstable and easy to be further hydrogenated. It is proposed that hydrogenation of methyl 3,5-dihydroxybenzoate resulted in the formation of the intermediates of 3,5-dihydroxybenzaldehyde and 3,5-dihydroxybenzyl alcohol which were unstable and easy to be further hydrogenated to 3,5-dihydroxytoluene.
Cu-Zn-Al catalyst; methyl 3,5-dihydroxybenzoate; 3,5-dihydroxytoluene; reaction mechanism.
2014-10-16;修改稿收到日期:2015-01-30。
陆樊委(1989-),在读硕士。
国家自然科学基金(20976076;21307009)。
TQ243.1
A
*通信联系人:Email:mingshili@cczu.edu.cn。
