SDF-1α改善高糖对骨髓间充质干细胞存活及迁移能力的抑制作用与分子机制的研究
2015-04-18李海瑞张爱东
李海瑞, 郑 栋, 江 灿, 郭 军, 张爱东
(暨南大学附属第一医院心血管内科,广东广州510630)
SDF-1α改善高糖对骨髓间充质干细胞存活及迁移能力的抑制作用与分子机制的研究
李海瑞, 郑 栋, 江 灿, 郭 军, 张爱东
(暨南大学附属第一医院心血管内科,广东广州510630)
目的:探讨基质细胞衍生因子-1α(SDF-1α)对高糖环境(25 mmol/L)下大鼠骨髓间充质干细胞(rMSCs)存活及迁移能力的影响及相关分子机制.方法:采用全髓贴壁法纯化培养rMSCs,通过MTT法检测细胞增殖率、Hoechst33258染色从形态学角度观察细胞凋亡评估SDF-1α对高糖环境下rMSCs存活的影响,同时通过transwell实验评估SDF-1α对高糖环境下rMSCs细胞迁移能力的影响.结果:实验结果发现,与低糖培养液(5.6 mmol/L)比较,高糖培养液可明显抑制rMSCs增殖、促进细胞凋亡(P<0.05),SDF-1α(50 ng/mL)可减轻高糖培养液对细胞增殖的抑制及诱导细胞凋亡的作用(P<0.05),CXCR4受体特异性拮抗剂AMD3100(10μg/mL)虽能进一步抑制细胞增殖、诱导细胞凋亡,但差异无显著性(P>0.05).Transwell实验发现高糖培养液可明显抑制rMSCs的迁移作用(P<0.05),SDF-1α(50 ng/mL)可逆转高糖培养液对细胞迁移的抑制作用(P<0.05),AMD3100(10μg/mL)可进一步抑制细胞迁移,且差异有显著性(P<0.05).结论:SDF-1α可能通过CXCR4受体改善高糖对骨髓间充质干细胞迁移能力的抑制,而其改善高糖对骨髓间充质干细胞存活的抑制则可能通过非CXCR4受体介导,为改善MSCs用于治疗冠心病合并糖代谢异常患者心梗后心力衰竭疗效进一步提供理论依据.
骨髓间充质干细胞; 基质细胞衍生因子-1α; 凋亡; 迁移
心肌梗死发病率日益增加,随着溶栓、经皮冠状动脉介入术等现代冠心病诊疗技术的进展,其死亡率虽有下降,但由于大面积的心肌细胞坏死,发展到末期往往容易导致心力衰竭.骨髓间充质干细胞(bone marrow derived mesenchymal stem cells,BMMSCs)是来源于骨髓基质的一类成体干细胞(somatic stem cells),因其具有多系分化潜能、旁分泌效应和免疫调节功能而作为适合心肌修复、治疗缺血性心脏病的重要候选种子细胞之一[1].目前国内外研究均已证实MSCs直接注射到心肌梗死心肌或经静脉途径注射可以诱导心肌的再生和改善心功能[2-4],但细胞移植归巢效率及存活率低是目前MSCs未能得以广泛应用于临床的重要原因[5],提高心肌梗死部位移植细胞的数量和存活率将有助于改善心功能.
目前研究发现临床上高达80%的冠心病患者合并糖代谢异常,以往研究发现高糖(H-DMEM,25 mmol/L)可诱导MSCs凋亡、抑制MSCs增殖、迁移及减少细胞因子的分泌[6-11],体外及在体实验均已证实在低糖(L-DMEM,浓度5.6 mmol/L)环境下SDF-1α/CXCR4信号轴参与MSCs的增殖、迁移、抗凋亡及旁分泌作用,迄今为止尚未见关于SDF-1α/CXCR4信号轴激活影响高糖对rMSCs作用的报道[12],因此本研究旨在探讨高糖(H-DMEM,浓度25 mmol/L)环境下SDF-1α/CXCR4信号轴的激活对rMSCs细胞凋亡、增殖及迁移作用的影响及相关机制.
1 材料与方法
1.1 材料
(1)实验动物及分组 SD大鼠(120~150 g),雌雄不拘,均由广东省实验动物中心提供.实验分5组:低糖组(LG,浓度5.6 mmol/L)、高糖组(HG,浓度25 mmol/L)、SDF组(质量浓度50 ng/mL)(HG+SDF-1α)、AMD组(质量浓度10μg/mL)(HG+AMD3100)、SDF(质量浓度50 ng/mL)+AMD(质量浓度10μg/mL)组(HG+SDF-1α+AMD3100).
(2)试剂与仪器 低糖DMEM、高糖DMEM、胎牛血清与胰蛋白酶购自美国Gibco公司,SDF-1α与AMD3100购自美国Sigma公司,Hoechst 33258染色试剂盒购自中国碧云天公司,transwell装置为Costar公司产品,型号CX31荧光显微镜与型号CKX31倒置相差显微镜均为日本Olympus公司产品.
1.2 方法
(1)大鼠骨髓间充质干细胞(rMSCs)的分离、培养 取健康成年SD大鼠(性别不限,体质量约150克,购自广东省医学实验动物中心,许可证号:SCXK2008-0002),体积分数为10%水合氯醛0.3 mL腹腔注射麻醉大鼠后脱臼处死,浸泡于体积分数为75%乙醇中5 min后无菌条件下分离取股、胫骨,剪开两端,取10 mL注射器吸取L-DMEM培养液冲洗骨髓腔冲出骨髓,反复冲洗直至骨髓腔变白,收集单细胞悬液,1 000 r/min离心5 min,去除上清液,用完全培养基(L-DMEM、体积分数为10%胎牛血清、浓度为2 mmol/L谷氨酰胺、青霉素与链霉素质量浓度均为100 mg/mL)重悬制成单细胞悬液,将提取的MSCs按105/mL的细胞密度接种于25 cm2培养瓶,37℃、体积分数为5%二氧化碳培养箱培养.24 h后首次换液,以后每3 d换液1次,待细胞接近70%融合时按1∶2~1∶3传代,通过不断的换液与传代逐渐纯化扩增MSCs,第4~5代细胞用于实验.
(2)诱导分化 成骨诱导:取P4细胞,用含EDTA的0.25%胰蛋白酶消化,制成单细胞悬液,以105/孔密度接种于6孔培养板,常规培养1 d后,加入2 mL成骨诱导分化培养液,每3 d换液1次,14~21 d后进行茜素红染色.
成脂分化:取P4细胞,用含EDTA的0.25%胰蛋白酶消化,制成单细胞悬液,以105/孔密度接种于6孔培养板,常规培养1 d后,加入2 mL成脂诱导分化培养液,每3 d换液1次,14 d后进行油红O染色.
(3)MTT实验[8]取P4细胞,用含EDTA的0.25%胰蛋白酶消化,制成单细胞悬液,细胞计数板计数,以1 500/孔密度接种于96孔培养板(每组10复孔),分别加入低糖(LG,浓度5.6 mmol/L)完全培养液、高糖(HG,浓度25 mmol/L)完全培养液、高糖完全培养液+SDF(质量浓度为50 ng/mL)、高糖完全培养液+AMD(质量浓度为10μg/mL)、高糖完全培养液+SDF(质量浓度为50 ng/mL)+AMD(质量浓度为10μg/mL)共200μL,空白对照组每孔加入低糖完全培养液200μL,37℃、体积分数为5%CO2培养箱培养,48小时后每孔加入MTT溶液(质量浓度为5 mg/mL)20μL,继续孵育4 h,终止培养,小心吸弃孔内培养液,每孔加150μL DMSO,振荡10 min,使结晶物充分融解,选择490 nm波长,在酶联免疫监测仪上测定各孔光吸收值,记录结果,以时间为横坐标,吸光值为纵坐标绘制细胞生长曲线,实验重复3次.
(4)Hoechst33258染色检测细胞凋亡[13]6孔板每孔加入适当大小的玻片.取P4细胞,用含EDTA的质量分数为0.25%胰蛋白酶消化,制成单细胞悬液后计数,以105/孔密度接种于6孔培养板,分别加入低糖(LG,浓度5.6 mmol/L)完全培养液、高糖(HG,浓度25 mmol/L)完全培养液、高糖完全培养液+SDF(质量浓度为50 ng/mL)、高糖完全培养液+AMD(质量浓度为10μg/mL)、高糖完全培养液+SDF(质量浓度为50 ng/mL)+AMD(质量浓度为10μg/mL)共2 mL,37℃、体积分数为5%CO2培养箱培养.每孔加入0.5 mL细胞固定液常温下固定10 min,PBS漂洗5 min共2次,均匀滴上0.5 mL Hoechst33258染色液染色5 min,PBS再次漂洗5 min共2次,滴1滴抗荧光淬灭封片液于载玻片上,盖上盖玻片,避免气泡,倒置荧光显微镜观察,深染固缩的细胞核提示凋亡细胞.随机选取5个视野(× 40)计算凋亡率(凋亡细胞数/总细胞数),所有实验重复3次计算平均值.
(5)Transwell实验[14]选用带8μm孔径聚碳酸酯膜的transwell装置在24孔板进行Transwell实验.取P4细胞,用含EDTA的质量分数为0.25%胰蛋白酶消化,制成单细胞悬液,细胞计数板计数.Transwell装置上室加入含6×105细胞/mL的完全培养液100μL(低糖组:LG-DMEM+0.5%FBS,高糖组:HG-DMEM+0.5%FBS),Transwell装置下室分别加入低糖(LG,浓度5.6 mmol/L)完全培养液、高糖(HG,浓度25 mmol/L)完全培养液、高糖完全培养液+SDF(质量浓度为50 ng/mL)、高糖完全培养液+AMD(质量浓度为10μg/mL)、高糖完全培养液+SDF(质量浓度为50 ng/mL)+AMD(质量浓度为10μg/mL)共600μL,于37℃、体积分数为5% CO2培养箱培养10小时后用棉签轻轻刮除聚碳酸酯膜上层的未迁移的细胞,多聚甲醛固定液固定15 min,然后0.5%结晶紫染色10 min,在高倍视野(× 100)随机选取5个视野计算迁移细胞数,所有实验重复3次计算平均值.
1.3 统计学分析
2 结果
2.1 rMSCs原代培养及传代培养的细胞形态
大鼠骨髓细胞呈圆形散在分布悬浮于培养液,24 h后首次换液可去除大部分非贴壁细胞,倒置显微镜下即可见稀少的呈长梭形的贴壁细胞,3 d后梭形贴壁细胞集落开始增多、扩大并逐渐开始融合(图1A、1B),10~12 d左右细胞融合达到80%~90%即可进行传代的.通过多次传代及换液后圆形细胞逐渐减少,P4代细胞倒置显微镜下观察可见大小形态较为均一、呈旋涡状或鱼群状排列的长梭形为主的MSCs细胞(图1C),P4~P5代细胞可用于实验.随着传代次数增加细胞逐渐衰老,表现为细胞变得扁平、形态各异或边界模糊(图1D).
2.2 成骨诱导分化及成脂诱导分化鉴定rMSCs
成骨诱导3周后进行茜素红染色,染色后可见橘红色矿化结节形成.成脂诱导后进行油红O染色,染色后可见胞浆内出现折光性较强的红染脂滴.
2.3 SDF-1促进高糖环境下rMSCs增殖
本实验采用MTT法检测SDF-1对rMSCs在高糖环境下增殖的影响,ΔA值与细胞数量成正比,ΔA值越大,细胞数量越高.与低糖组比较,高糖培养液可明显抑制rMSCs增殖(2)vs LG P<0.05),高糖培养液中加入SDF(质量浓度为50 ng/mL)可减轻高糖培养液对细胞增殖的抑制作用(3)vs HG P<0.05),加入AMD3100(质量浓度为10μg/mL)可进一步抑制细胞增殖,但差异无显著性(4)vs HG P>0.05,5)vs SDF P>0.05).

图1 rMSCs倒置显微镜(×40)下细胞形态(A)原代培养第3天可见稀少的呈长梭形的贴壁细胞;(B)原代培养第10天可见长梭形贴壁细胞集落逐渐扩大;(C)大小形态较为均一、呈旋涡状或鱼群状排列的长梭形为主的MSCs(P4代);(D)细胞变为扁平、形态各异或边界模糊(P6代).Fig.1 Morphology of MSCs under inverted Microscopy(A)MSCs on 3rd day of primary culture show a few spindle-shaped adherent cells;(B)MSCs on 10th day of primary culture show larger and larger colonies;(C)spindle-shaped MSCs with regular morphology in spiral or shoal shape;(D)MSCs become flatten,irregular in morphology.

图2 rMSCs诱导分化结果(A)成骨分化茜素红染色后可见橘红色矿化结节;(B)成脂分化油红O染色后可见胞浆内红染的脂滴(×100).Fig.2 Typical pictures of osteogenic and adipogenic differentiation(A)Alizarin Red staining of osteogenic differentiation showsorange-red calcified nodules.(B)oil red O staining of adipogenic differentiation shows cytoplasmic red-stained lipid vacuoles.
2.4 SDF-1减少高糖诱导rMSCs凋亡
本实验采用Hoechst 33258染色从形态学角度观察SDF-1对rMSCs在高糖环境下细胞凋亡的影响(图4),荧光显微镜下观察凋亡细胞细胞核形态变化,Hoechst 33258染色后凋亡细胞可见深染固缩的细胞核.与低糖培养液相比较,高糖培养液可明显诱导rMSCs凋亡,高糖培养液中加入SDF(质量浓度50 ng/mL)可减少高糖培养液诱导的细胞凋亡,加入AMD(质量浓度10μg/mL)并未明显增加细胞凋亡率.
2.5 SDF-1促进高糖环境下rMSCs迁移
本实验采用transwell实验观察SDF-1对rMSCs在高糖环境下迁移的影响.与低糖组(图5A)比较,高糖培养液(图5B)可明显促进rMSCs迁移(2)vs LG P<0.05),高糖培养液中加入SDF(质量浓度50 ng/mL)(图5C)可减轻高糖培养液对细胞迁移的抑制作用(3)vs HG P<0.05),AMD(质量浓度10 μg/mL)可明显抑制细胞迁移,且差异有显著性(4)vs HG P<0.05,5)vs SDF P<0.05).

图3 HG、SDF及AMD对rMSCs增殖的影响2)与LG组相比较,P<0.05;3)与HG组相比较,P<0.05;4)与HG组相比较,P>0.05;5)与SDF组相比较,P>0.05.Fig.3 Impact of HG,SDF and AMD on rMSCs proliferation2)vs LG P<0.05;3)vs HG P<0.05;4)vs HG P>0.05;5)vs SDF P>0.05
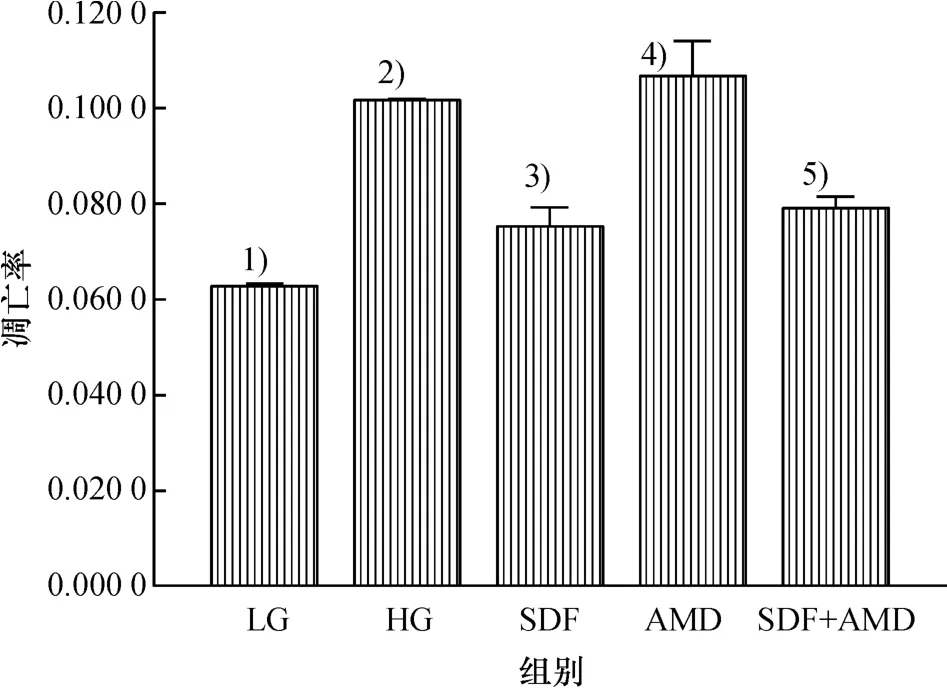
图4 HG、SDF及AMD对rMSCs凋亡率的影响2)与LG组相比较,P<0.05;3)与HG组相比较,P<0.05;4)与HG组相比较,P>0.05;5)与SDF组相比较,P>0.05.Fig.4 Impact of HG,SDF and AMD on rMSCs apoptosis2)vs LG P<0.05;3)vs HG P<0.05;4)vs HG P>0.05;5)vs SDF P>0.05

图5 HG、SDF及AMD对rMSCs迁移的影响A低糖组(LG),B高糖组(HG),C SDF组(HG+SDF),D AMD组(HG+AMD),E SDF+AMD组(HG+SDF+AMD).Fig.5 Impact of HG,SDF and AMD on rMSCsmigration(A)Low glucosemedium group(LG);(B)High glucose medium group(HG);(C)SDF group(HG+SDF);(D)AMD group(HG+AMD);(E)SDF+AMD group(HG+SDF+AMD).

图6 HG、SDF及AMD对rMSCs迁移的影响2)与LG组相比较,P<0.05;3)与HG组相比较,P<0.05;4)与HG组相比较,P<0.05;5)与SDF组相比较,P<0.05.Fig.6 Impact of HG,SDF and AMD on rMSCsmigration2)vs LG P<0.05;3)vs HG P<0.05;4)vs HG P<0.05;5)vs SDF P<0.05
3 讨论
心肌梗死发病率日益增加,随着溶栓、经皮冠状动脉介入术等现代冠心病诊疗技术的进展,其死亡率虽有下降,但由于大面积的心肌细胞坏死,发展到末期往往容易导致心力衰竭.近年来人们提出了细胞水平心肌移植术(cellular cardiomyoplasty,CCM)治疗慢性心肌梗死后心力衰竭,即用细胞移植的手段增加心肌细胞的数量,修复坏死的心肌,从而改善心功能,降低病死率.在众多的供体细胞中,骨髓间充质干细胞(mesenchymal stem cells,MSCs)倍受研究者的关注,因为与其他替代细胞如内皮祖细胞、肌成纤维细胞、心脏干细胞、胚胎干细胞等相比,MSCs具有较多优点如可以与宿主心肌细胞之间形成良好的电-机械耦连,多系分化能力及旁分泌作用,不存在免疫排斥反应,无伦理道德方面争议,取材方便等各种优势,因此具有大规模应用于临床的潜力,但细胞移植归巢效率及存活率低是目前MSCs未能得以广泛应用于临床的重要原因[9~11],提高心肌梗死部位移植细胞的数量和存活率将有助于改善心功能.
大量研究发现高糖可诱导MSCs凋亡、抑制MSCs增殖、迁移及减少细胞因子的分泌[7-11],并且大量体外及在体实验均已证实在低糖(L-DMEM,浓度5.6 mmol/L)环境下SDF/CXCR4信号轴参与MSCs的增殖、迁移、抗凋亡及旁分泌作用.目前研究发现临床上高达80%的冠心病患者合并糖代谢异常,因此,本实验探讨高糖(浓度为25 mmol/L)环境下SDF-1/CXCR4信号轴的激活对细胞凋亡、增殖、迁移及旁分泌作用的影响及相关机制,为MSCs治疗冠心病合并糖代谢异常患者心梗后心力衰竭提供理论依据.
本实验采用全骨髓贴壁法培养并通过不断的换液与传代的方法逐渐的纯化细胞,直至第4代细胞我们就可以获得纯度较高的可用于实验的rMSCs.本实验分别采用MTT法及Hoechst 33258染色观察SDF-1对rMSCs在高糖环境下增殖及凋亡的影响,实验结果发现,与低糖组比较,高糖培养液可明显抑制rMSCs增殖、促进细胞凋亡,加入SDF-1(质量浓度50 ng/mL)可改善高糖环境下rMSCs的增殖与凋亡,加入AMD(质量浓度10μg/mL)虽然可进一步抑制细胞增殖、诱导细胞凋亡,但无显著差异.Transwell实验也证实SDF-1对高糖环境下MSCs功能的保护作用与低糖组比较,高糖培养液可明显抑制rMSCs的迁移作用,当高糖培养液中加入SDF-1(质量浓度50 ng/mL)后可逆转高糖培养液对细胞迁移的抑制作用,加入AMD(质量浓度10μg/mL)可进一步抑制细胞迁移,且差异有显著性.
MSCs胞膜上不同受体的不同功能可能与SDF-1及AMD对高糖环境下增殖、凋亡及迁移作用的差异有关.Sierro等[15]研究发现,MSCs除在细胞膜上表达CXCR4外,还可以表达CXCR7,CXCR4及CXCR7受体均可与配体SDF-1结合而发挥相应的生物学效应.李强等[16]进一步研究发现,SDF-1/CXCR4及SDF-1/CXCR7信号轴均与MSCs迁移作用相关,而细胞增殖仅与SDF-1/CXCR7信号轴有关.本实验选用的SDF-1受体阻滞剂AMD3100为CXCR4受体特异性,对CXCR7无明显阻滞作用,因此,当高糖组和SDF组分别加入AMD3100后虽然可进一步抑制细胞增殖、促进细胞凋亡,但差异无显著性,而当高糖组和SDF组加入AMD3100后进一步抑制细胞迁移,且差异均有显著性.
以上实验结果显示,MSCs的存活(增殖、凋亡)及迁移与SDF密切相关.高糖环境下MSCs存活及迁移能力均明显下降,SDF-1α可改善高糖对MSCs存活及迁移的抑制作用,其中SDF-1α可能通过CXCR4受体改善高糖对骨髓间充质干细胞迁移能力的抑制,而其改善高糖对骨髓间充质干细胞存活的抑制则可能通过非CXCR4受体介导,为改善MSCs用于治疗冠心病合并糖代谢异常患者心梗后心力衰竭疗效进一步提供理论依据.
[1]CHOIY H,KURTZ A,STAMM C.Mesenchymal stem cells for cardiac cell therapy[J].Hum Gene Ther,2011,22:3-17.
[2]LIZ,GUO J,CHANG Q,ZHANG A.Paracrine role for mesenchymal stem cells in acute myocardial infarction[J].Biol Pharm Bull,2009,32:1343-1346.
[3]HELDMAN A W,DIFEDE D L,FISHMAN JE,et al.Transendocardial mesenchymal stem cells and mononuclear bone marrow cells for ischemic cardiomyopathy:the TAC-HFT randomized trial[J].JAMA,2014,311:62-73.
[4]HARE JM,FISHMAN JE,GERSTENBLITH G,et al.Comparison of allogeneic vs autologous bone marrow-derived mesenchymal stem cells delivered by transendocardial injection in patients with ischemic cardiomyopathy:the POSEIDON randomized trial[J].JAMA,2012,308:2369-2379.
[5]TEMPLIN C,ZWEIGERDT R,SCHEWANKE K,OLMER R,etal.Transplantation and tracking of humaninduced pluripotent stem cells in a pigmodel of myocardial infarction assessment of cell survival,engraftment,and distribution by hybrid single photon emission computed tomography/computed tomography of sodium iodide symporter transgene expression[J].Circulation,2012,126:430-439.
[6]YANG K,WANG X Q,HE Y S,et al.Advanced glycation end products induce chemokine/cytokine production via activation of p38 pathway and inhibit proliferation and migration of bone marrow mesenchymal stem cells[J].Cardiovasc Diabetol,2010,9:66.
[7]DHANASEKARAN M,INDUMATHI S,RAJKUMAR J S,et al.Effect of high glucose on extensive culturing of mesenchymal stem cells derived from subcutaneous fat,omentum fat and bonemarrow cell biochemistry and function[J].Cell Biochem Funct,2013,31:20-29.
[8]LIY M,SCHILLING T,BENISCH P,et al.Effects of high glucose on mesenchymal stem cell proliferation and differentiation[J].Biochem Biophys Res Commun,2007,363:209-215.
[9]KHAN M,AKHTAR S,MOHSIN S,et al.Growth Factor Preconditioning Increases the Function of Diabetes-Impaired Mesenchymal Stem Cells[J].Stem Cells Dev,2011,20:67-75.
[10]ISHIZUKA T,HINATA T,WATANABE Y.Superoxide induced by a high-glucose concentration attenuates production of angiogenic growth factors in hypoxic mouse mesenchymal stem cells[J].J Endocrinol,2011,208:147-159.
[11]LIU ZH,LEIM X,JIANG Y H,etal.High glucose attenuates VEGF expression in ratmultipotentadult progenitor cells in association with inhibition of JAK2/STAT3 signalling[J].JCell Mol Med,2009,13:3427-3436.
[12]GHADGE S K,MUHLSTEDT S,ÖZCELIK C,et al.SDF-1αas a therapeutic stem cell homing factor in myocardial infarction[J].Pharmacology&Therapeutics,2011,129:97-108.
[13]ZHEW,CHEN J,CONG X,et al.Hypoxia and serum deprivation-induced apoptosis in mesenchymal stem cells[J].Stem Cells,2006,24:416-425.
[14]CHENG Z,OU L,ZHOU X,etal.Targeted migration of mesenchymal stem cellsmodified with CXCR4 gene to infracted myocardium improves cardiac performance[J].Mol Ther,2008,16:571-579.
[15]SIERRO F,BIBEN C,MARTINEZ-MUNOZ L,et al.Disrupted cardiac development but normal hematopoiesis inmice deficient in the second CXCL12/SDF-1 receptor,CXCR7[J].Proc Natl Acad SciUSA,2007,104,14759-14764.
[16]LIQ,ZHANG A,TAO C,et al.The role of SDF-1-CXCR4/CXCR7 axis in biological behaviors of adipose tissue-derived mesenchymal stem cells in vitro[J].Biochem Biophys Res Commun,2013,441:675-680.
[责任编辑:孙升云 王景周]
SDF-1αattenuates the inhibitory effect of high-glucose on ratmesenchymal stem cells survival and m igration and the underlying molecular mechanism s
LIHairui, ZHENG Dong, JIANG Can, GUO Jun, ZHANG Aidong
(Department of Cardiology,the First Affiliated Hospital,Jinan University,Guangzhou 510630,China)
Aim:To explore the influence of SDF-1αon the inhibitory effect of high-glucose(25 mmol/L)to ratmesenchymal stem cells survival and migration.Methods:The survival of MSCs in different groups was examined by MTT assay for proliferation and Hoechst33258 staining for apoptosis.The migration of MSCs in different groups was assessed by Trans well assay.Results:Compared with low-glucose(5.6mmol/L),high-glucose inhibits rat mesenchymal stem cells survival and migration(P<0.05),the specific CXCR4 receptor antagonist AMD3100 can further inhibit cellmigration(P<0.05)but not survival(P>0.05),SDF-1αcan attenuate such inhibitory effects(vs high-glucose,P<0.05).Conclusion:SDF-1αattenuates the inhibitory effect of high-glucose on ratmesenchymal stem cellmigration via CXCR4 receptor,while itmay attenuate the inhibitory effect of high-glucose on ratmesenchymal stem cells survival via binding to non-CXCR4 receptor.
mesenchymal stem cells; SDF-1α; apoptosis; migration
R541.4
A
1000-9965(2015)02-0136-07
10.11778/j.jdxb.2015.02.008
2014-12-15
国家自然科学基金青年项目(81100078),教育部科学研究重点项目(211207);广东省科技厅博士启动项目(S2011040001392);广州珠江科技新星资助计划项目(2012J2200063)
郭 军,副主任医师,副教授,博士,研究方向:心血管病学,Tel:020-38688620;E-mail:dr.guojun@163.com
