低温对茶陵野生稻总基因组导入栽培稻后代耐冷性生理指标的影响
2015-04-18李*
李*
(1湖南农业大学生物科学技术学院,长沙410128;2株洲市农业科学研究所,湖南株洲412007;3国家海洋局第一海洋研究所生态中心,山东青岛266061)
低温对茶陵野生稻总基因组导入栽培稻后代耐冷性生理指标的影响
李颖邦1,康敏2,宋伟3,程鹏1,洪亚辉1*
(1湖南农业大学生物科学技术学院,长沙410128;2株洲市农业科学研究所,湖南株洲412007;3国家海洋局第一海洋研究所生态中心,山东青岛266061)
选用茶陵野生稻总基因组导入冷敏感品种R9810获得的导入后代Km16为材料,以受体品种R9810为对照,在幼苗期低温胁迫下,分别测定植株丙二醛、生长素、脱落酸含量以及SOD、CAT、POD活性。结果表明,导入后代Km16植株的丙二醛含量略低于R9810,而生长素、脱落酸含量则明显高于R9810。同样,Km16植株的3种酶活性也产生了明显的变化。
水稻;幼苗;耐冷性;生理指标
一般以抗氧化物酶活性、丙二醛含量以及植物激素含量变化作为指标来解释作物存在抗寒性状能力的原因以及受到冷伤害时作物有效应对的生理机制[1,2]。研究表明,植物细胞在遭受到低温胁迫时,细胞内的活性氧类物质(包括O-2、H2O2以及·OH等)的水平会显著提高,从而造成细胞的损害[3]。一些抗氧化物酶,如:超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)都是有效保护细胞免受活性氧损害的保护酶类[4]。对低温敏感的植物,其细胞抵御由低温而产生的氧化损伤能力,很大程度上受到抗氧化类物质如SOD、POD、CAT等表达量的抑制[5]。丙二醛(MDA)是植物体组织器官衰老或者受到某些逆境胁迫下细胞发生膜脂过氧化形成的产物,MDA含量愈高,则细胞膜受到的损害程度就愈大[6]。许多研究以MDA含量的变化作为细胞脂质过氧化的判断指标,用来表明细胞膜的脂质过氧化程度和对逆境胁迫的抵御情况[7]。脱落酸(ABA)和生长素(IAA)是两种参与植物应答生物和非生物胁迫的重要激素[8~10]。已有研究指出,在逆境胁迫下植物体内的ABA与钙信号的转导途径存在相互调控机制,ABA含量的变化与钙信号的出现和转导有密切的联系[11~13]。
野生稻具有抗低温、抗旱、抗盐碱等多种优良的生物性状,其基因资源已经得到愈来愈多的研究人员的重视[14~16]。本研究以导入茶陵野生稻总基因组的后代Km16与其受体冷敏感品种R9810为对象,旨在比较其抗氧化物酶活性、MDA含量、植物激素的变化,以对水稻抗寒机理进行初步探析。
1 材料与方法
1.1茶陵野生稻总基因组导入受体水稻R9810
株洲市农业科学研究所与湖南农业大学细胞生物学研究室合作,通过花粉管通道法[17]将茶陵野生稻总基因组DNA导入冷敏感品种R9810,得到表型各异的导入后代。对导入后代进行RAPD多态性分析,并筛选出具有明显耐寒能力的后代Km16。种子由湖南农业大学细胞生物学研究室保存。
1.2水稻幼苗的栽培与处理
将Km16及R9810水稻种子以蒸馏水室温浸泡2 d,种子出现破胸吐白后将其转移到固体琼脂培养基上继续生长。约7 d后长成幼苗,将幼苗移植到含有蛭石的人工基质土并转移到人工气候箱中培养。温度设定为30/25℃(光/暗),光照时间12 h,相对湿度70%。待水稻幼苗长至3叶期,将人工气候箱温度设置为4℃,光照和相对湿度不变,低温处理12 h,每隔3 h取样1次,剪取幼苗相同部位叶片进行各项指标测定。
1.3测定方法
MDA含量测定采用TBA显色法[18];SOD活性测定采用NBT光化还原法[19];POD活性测定采用愈创木酚比色法[20];CAT活性测定采用直接紫外分光光度法。植物激素样品处理方法同文献[21],由湖南农业大学植物激素研究室测定。
1.4统计分析
将数据汇总并进行正态分布检验,后进行单因素方差检验(one-way ANOVA)。在方差显著水平小于0.05时(p<0.05)进行邓肯氏多重比较。所有统计分析均使用SPSS 17.0软件进行。
2 结果
2.1 MDA含量变化
如图1所示,低温胁迫后Km16与R9810植株MDA含量出现显著上升(p<0.05),并在3 h处都达到最大值,而后MDA的含量出现明显的下降趋势(p<0.05),在9 h处达到最小值。初始及3 h取样时,两者MDA含量差异很小(p>0.05),至6 h时,Km16的MDA含量明显低于R9810(p<0.05),而在之后的两个取样点,两者差异较小(p>0.05)。存在不同的是,Km16的MDA含量在3 h处达到最大值后迅速下降,下降速率要比R9810快得多,表现出Km16的MDA含量对低温胁迫比R9810更为敏感,反应也更为迅速。

图1 低温胁迫下Km16与R9810植株MDA含量变化
2.2三种酶活性变化
如图2所示,Km16的SOD酶活力在低温胁迫后的9 h之内都呈现显著的上升趋势(p<0.05),而低温胁迫时间对R9810的SOD酶活性影响不显著(p>0.05)。在胁迫6 h与9 h时,Km16的SOD酶活性显著高于R9810(p<0.05),而在其他时间,两者差异较小。
对POD酶活性的测定结果(图3)表明,在受到低温胁迫时,两种材料植株内的POD活性显著低于其正常培养条件下的值(p<0.05)。在大多数时间内,Km16与R9810的POD酶活性差异不显著,但在12 h处,Km16的POD酶活显著高于R9810(p<0.05)。

图2 低温胁迫下Km16与R9810植株SOD活性变化
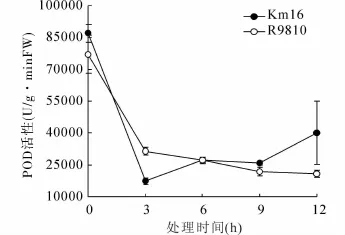
图3 低温胁迫下Km16与R9810植株POD活性变化
CAT酶活力测定结果(图4)表明,低温胁迫下,Km16的酶活性在3 h处达到最大值,且在大部分时间内显著高于R9810(p<0.05)。而在12 h处,两者酶活性差异较小。
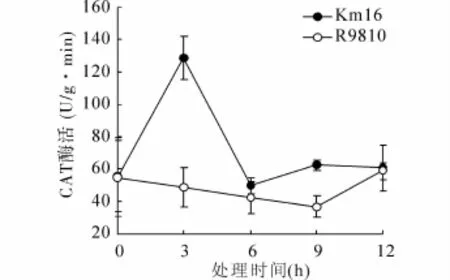
图4 低温胁迫下Km16与R9810植株中CAT活性变化
2.3 ABA与IAA含量变化
如图5所示,Km16与R9810在常温培养时其ABA含量差异很小。而在低温胁迫下,Km16的 ABA含量明显高于常温培养时的值(p<0.05),并在6 h时达到最大值。同时,在低温胁迫下,Km16中的ABA含量明显高于R9810(p<0.05)。对于IAA而言(图6),在低温胁迫下其含量显著低于常温(p<0.05),同时在大部分时间中,Km16的IAA含量显著高于R9810(p<0.05)。
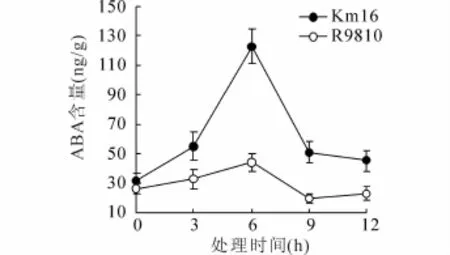
图5 低温胁迫下Km16与R9810植株中ABA含量变化
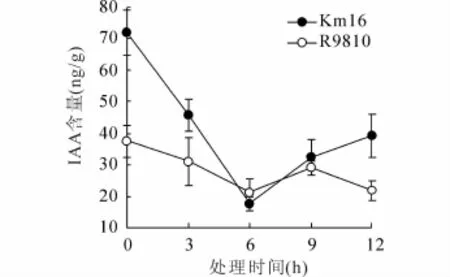
图6 低温胁迫下Km16与R9810植株中IAA含量变化
3 小结与讨论
MDA作为细胞脂质过氧化的判断指标,已在水稻抗逆性研究中广泛应用[22]。本研究发现,在受到低温胁迫的12 h之内,水稻叶片的MDA含量呈现先升高再下降最后基本持平的趋势。研究发现,在低温环境下,导入后代Km16与受体材料R9810相比较,虽然植株叶片中的总MDA含量相差较小,但Km16在6 h处首先出现了明显的下降,这说明在受到低温胁迫时,Km16能够较快地降低MDA含量,比R9810更加积极地响应由于低温造成的细胞脂质过氧化损伤。
SOD、POD以及CAT是生物体内有效的自由基清除剂,在清除机体内多余的超氧阴离子、解除超氧阴离子对生物体的毒性过程中起着关键性作用,并且能够有效地维持细胞内的活性氧代谢平衡,起到缓解活性氧毒性,保护细胞膜系统和其他生物大分子结构和功能的完整性[23]。通过测定导入后代Km16水稻植株的SOD活性表明,在低温胁迫下其SOD活性明显上升,且高于受体材料R9810的SOD酶活。Yong等[3]在对水稻进行抗冷能力驯化的研究中同样发现,在低温胁迫下水稻叶片中的SOD酶活性显著升高,这一点与笔者的结果相一致。对CAT酶活性测定结果表明,在3 h处导入后代Km16的CAT酶活性显著增高且高于受体材料R9810。然而通过对两种实验材料的POD酶活性测定后发现,低温条件下其POD酶活性都出现了显著下降。根据上述结果,笔者认为POD、SOD、CAT3种酶活处于动态平衡中,在低温胁迫的12 h之内,植株体优先调整并升高了SOD的酶活来抵御低温损伤,预计在12 h之后CAT和POD的酶活性将会升高。
ABA是植物抗逆胁迫时常涉及的生长激素,Km16在受到低温胁迫后,ABA含量出现了明显的增长,这可能是其在受到低温胁迫后,通过提高ABA含量来调动钙信号转导,从而达到积极抵御低温胁迫带来的损害[11~13]。通过IAA含量的测定发现,两组实验材料的IAA含量都出现了下降,推测原因是IAA属于促生长类激素,主要功能是影响植物体的生长发育,但在逆境条件下,植物体内的IAA含量水平会有所降低,生长速率放缓,以应对不良的生存环境[24]。另外,导入后代Km16的IAA含量仍是高于R9810的,这可能表明在低温条件下,Km16的生物活性高于R9810。
[1] 邓久英,陈光辉,刘 斌,等.水稻耐冷生理和遗传机制研究进展[J].广东农业科学,2009(5):25-28.
[2] 张卫星,朱德峰,林贤青,等.穗生长发育阶段水分逆境对超级稻叶片丙二醛含量的影响[J].华北农学报,2008,23(3):72-76.
[3] Yong IK,Ji SS,Nilda RB,etal.Antioxidative enzymesoffer protection from chilling damage in rice plants[J]. Crop Sci,2004,43(6):2109-2117.
[4] 李 锋,贾志红,沈 宏.低温胁迫对作物生理生化的影响及抗低温助剂的研发[J].江西农业学报,2011,23(12):12-14.
[5] 张智猛,戴良香,宋文武,等.干旱处理对花生品种叶片保护酶活性和渗透物质含量的影响[J].作物学报,2013,39(1):133-141.
[6] 吴 涛,董彦琪,原连庄,等.高温逆境短期处理下大白菜苗期丙二醛和叶绿素含量变化[J].长江蔬菜,2012(14):42-44.
[7] Becana M,Dalton DA,Moran JF,et al.Reactive oxygen species and antioxidants in legume nodules[J].Physiology Plant,2000,109(4):372-381.
[8] 曲凌慧,车永梅,刘 新,等.ABA和JA等激素参与葡萄对低温胁迫的应答[J].青岛农业大学学报,2010,27(1):36-41.
[9] 孙宽莹,陈 彦.植物激素的发现及生理效应的研究[J].聊城大学学报,2011,24(2):58-69.
[10]罗正荣.植物激素与抗寒力的关系[J].植物生理学通讯,1989(3):1-5.
[11]孙 芳,夏新莉,尹伟伦.逆境胁迫下ABA与钙信号转导途径之间的相互调控机制[J].基因组学与应用生物学,2009,28(2):391-397.
[12]刘子会,郭秀林,王 刚,等.干旱胁迫与ABA的信号转导[J].植物学通报,2004,21(2):228-234.
[13]张和臣,尹伟伦,夏新莉,等.非生物逆境胁迫下植物钙信号转导的分子机制[J].植物学通报,2007,24(1):114-122.
[14]张金伟,谢建坤,万 永.我国野生稻资源保护研究进展[J].安徽农业科学,2010,38(10):5015-5016.
[15]高立志,张寿洲,周 毅,等.中国野生稻的现状调查[J].生物多样性,1996,4(3):160-166.
[16]范树国,张再君,刘 林,等.中国野生稻遗传资源的保护及其在育种中的利用[J].生物多样性,2000,8(2):198-207.
[17]龚蓁蓁,沈慰芬,周光宇,等.授粉后外源DNA导入植株技术——通过花粉管通道进入胚囊[J].中国科学,1988(6):611-614.
[18]刘 琳.四川野生假俭草的抗寒性研究[D].雅安:四川农业大学硕士学位论文,2004.
[19]魏安智.仁用杏抗寒机理研究与抗寒物质筛选[D].杨凌:西北农林科技大学博士学位论文,2006.
[20]张志良,翟伟青.植物生理学实验指导[M].北京:高等教育出版社,2002.65-66.
[21]彭 琼.花生开花下针期生长素的极性运输及分布研究[D].长沙:湖南农业大学博士学位论文,2013.
[22]邱乾栋,吕晓贞,臧德奎,等.植物抗寒生理研究进展[J].山东农业科学,2009(8):53-57.
[23]Zhang Q,Chen QH,Ling S,et al.Rice and cold stress:methods for its evaluation and summary of cold tolerancerelated quantitative trait loci[J].Rice,2014,7:24-26.
[24]赵黎明.植物激素及其对水稻植株发育调控的研究进展[J].北方水稻,2009,39(6):63-69.
Effects of Low Tem perature on Physiological Indexes of Cold Tolerance in Progeny of Cultivated Rice Be Transferred the Total Genom ic DNA of Chaling W ild Rice
LIYing-bang1,KANG M in2,SONG W ei3,CHEN Peng1,HONG Ya-hui1*
(1 College of Bio-science and Technology,Hunan Agricultural University,Changsha,Hunan 410128,China;2 Zhuzhou Agricultural Sciences Institute,Zhuzhou,Hunan 412007,China;3 Center for Ecology,the First Institute of Oceanography,SOA,Qingdao,Shandong 266061,China)
Km16,the progeny of cold-sensitive rice variety R9810 be transferred the total genomic DNA of Chaling wild rice,and controlmaterial R9810 were used to determined the contents ofMDA,IAA,ABA,and activities of SOD,CAT and POD at seedling stage under low temperature stress.The results indicated that the content of MDA was slightly lower in Km16 than that in R9810,while the contents of IAA and ABA in Km16 were significantly higher.Similarly,the activities of SOD,CAT and POD were obviously varied in Km16.
rice;seedling;cold tolerance;physiological indexes
S511.01
A
1001-5280(2015)01-0001-04 DOI:10.3969/j.issn.1001-5280.2015.01.01
2014-10-16
李颖邦(1990-),男,硕士研究生,Email:liyingbang2012@163.com。*通信作者:洪亚辉,教授,Email:161740991@qq.com。
农业部948计划项目(2013-Z58);湖南省高校创新平台开放基金项目(10K031)。
