子痫前期孕妇体内S100A12水平检测及其血清对滋养细胞增殖、凋亡和RAGE表达的影响
2015-04-18赵先兰潘淑敏
赵先兰,潘淑敏,刘 彩
郑州大学第一附属医院妇产科 郑州 450052
子痫前期孕妇体内S100A12水平检测及其血清对滋养细胞增殖、凋亡和RAGE表达的影响
赵先兰△,潘淑敏,刘 彩
郑州大学第一附属医院妇产科 郑州 450052
△女,1965年10月生,博士,主任医师,研究方向:围产医学,E-mail:zxl12129@163.com
子痫前期;S100A12;RAGE;滋养细胞;细胞增殖;细胞凋亡
目的:检测子痫前期孕妇外周血和胎盘组织中S100A12蛋白的表达,观察其血清对滋养细胞的影响,探讨S100A12与子痫前期的关系。方法:选择轻度子痫前期孕妇30例,重度子痫前期孕妇30例,同期入院分娩的正常孕妇30例(正常对照组),采用ELISA法检测孕妇外周血中S100A12水平,免疫组化法检测胎盘组织中S100A12蛋白的表达水平。用各组孕妇血清体外培养滋养细胞48 h,另设无血清培养的空白对照组,应用MTT法和流式细胞仪检测细胞增殖及凋亡情况,Western blot 法检测细胞中晚期糖基化终末产物受体RAGE蛋白的表达。结果:轻、重度子痫前期组孕妇外周血及胎盘组织中S100A12水平均高于正常对照组(P<0.05),且重度子痫前期组高于轻度子痫前期组(P<0.05)。轻、重度子痫前期组滋养细胞早期凋亡率、晚期凋亡率、总凋亡率及RAGE蛋白的表达均明显高于正常孕妇及空白对照组(P<0.05),增殖率则降低(P<0.05);重度子痫前期组较轻度子痫前期组变化更显著(P<0.05)。结论:S100A12高表达可能是子痫前期的重要发病机制之一。
子痫前期是导致孕产妇和围产儿患病率及死亡率升高的主要原因之一,其发病机制迄今不明。研究[1]表明其病理根源在于胎盘。近年来子痫前期发病的炎症机制再次受到重视。S100A12是近年来发现的一种促炎因子,在炎症调节中起关键作用,参与机体的免疫防御或炎症反应,调节细胞生长分化、生长抑制、凋亡等,在炎症性肠病、关节炎、心血管疾病等许多疾病中发挥着重要作用[2]。目前尚不清楚S100A12与子痫前期之间的关系。该研究通过检测S100A12在子痫前期孕妇血清及胎盘中的表达,分析子痫前期孕妇血清对滋养细胞增殖、凋亡及晚期糖基化终末产物受体(receptor for advanced glycation end products,RAGE)表达的影响,探讨其与子痫前期发病的关系,为进一步寻找子痫前期的预测指标及治疗靶点提供依据。
1 对象与方法
1.1 研究对象 选择2013年3月至12月在郑州大学第一附属医院产科分娩的子痫前期患者60例,参照文献[3]的诊断标准及分类,其中轻度30例,年龄23~30(27.3±4.0)岁,孕1~3(1.6±0.7)次;重度30例,年龄25~32(29.1±2.7)岁,孕1~3(1.8±0.9)次。选择同期正常孕妇30例为正常对照组,年龄23~30(26.2±2.2)岁,孕1~3(1.7±0.6)次。所选研究对象均无其他妊娠期合并症及并发症。3组产妇年龄、孕产次等一般情况匹配。
1.2 标本的采集、处理及保存 采取孕妇空腹状态下肘静脉血10 mL,置于EDTA抗凝管中,3 000 r/min 离心10 min,取上清置于-20 ℃冰箱中保存备用。胎盘娩出后,在胎盘母体面中央避开出血、梗死及钙化区取胎盘组织约1 cm×1 cm×1 cm,冷生理盐水冲洗干净后,甲醛固定。
1.3 外周血中S100A12水平的测定 以离心后血清为标本,采用ELISA法按试剂盒(北京全式金生物科技有限公司)说明操作,在450 nm处测得吸光度(A)值,以标准物的浓度为横坐标,A值为纵坐标,绘制标准曲线,根据标准曲线计算出外周血中S100A12水平。
1.4 胎盘组织中S100A12蛋白的检测 固定后的胎盘组织常规石蜡包埋,连续切片,厚4 μm,脱蜡至水;用体积分数3%H2O2清除内源性过氧化物酶;采用免疫组化SP法检测胎盘组织中S100A12蛋白。S100A12抗人一抗购于美国Abcam生物技术公司,严格按免疫组化法操作步骤进行。以PBS代替一抗作阴性对照。参照Fromowitz等[4]阳性细胞半定量分级法,观察5个高倍视野,每个视野计数100个细胞,根据阳性细胞所占百分数计分:<5%为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,≥75%为4分;根据阳性细胞染色强度计分:无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。以两项得分相加的总分进行判定:<2分为阴性,≥2分为阳性。

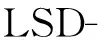
2 结果
2.1 各组孕妇外周血中S100A12水平和胎盘组织中S100A12蛋白表达的比较 见图1、表1。各组孕妇胎盘滋养细胞、蜕膜细胞等组织细胞中均可检测到S100A12蛋白的阳性表达,蛋白定位于细胞质中。轻度子痫前期组及重度子痫前期组孕妇外周血中S100A12水平和胎盘组织中S100A12蛋白阳性表达率均高于正常对照组,重度子痫前期组高于轻度子痫前期组。

图1 各组胎盘组织中S100A12蛋白的表达(SP,×200)

表1 3组孕妇外周血中S100A12水平及胎盘组织中S100A12阳性表达率比较
*:与正常对照组比较,P<0.001;#:与轻度子痫前期组比较,P<0.001。
2.2 子痫前期孕妇血清对滋养细胞增殖、凋亡和RAGE表达的影响
2.2.1 各组滋养细胞增殖情况的比较 用轻、重度子痫前期组孕妇血清孵育滋养细胞 48 h后,倒置相差显微镜下可见,细胞形态由长梭形或多边形变为椭圆或圆形,细胞间隙加大,细胞排列变疏松;正常孕妇组和空白对照组细胞形态基本正常、无变化。轻、重度子痫前期组细胞增殖率明显低于正常孕妇组和空白对照组;重度子痫前期组低于轻度子痫前期组。见表2。
2.2.2 各组滋养细胞凋亡率的比较 轻、重度子痫前期组滋养细胞早期凋亡率、晚期凋亡率以及总凋亡率均明显高于正常对照组及空白对照组。见表2。
2.2.3 各组细胞RAGE蛋白表达的比较 轻、重度子痫前期组滋养细胞中RAGE蛋白的表达均明显高于正常对照组及空白对照组,见图2、表2。
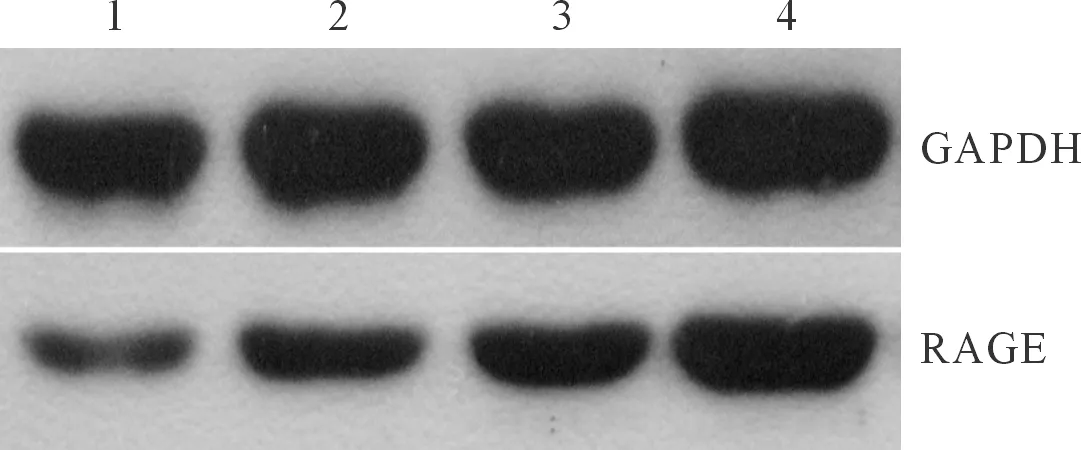
图2 各组滋养细胞中RAGE的表达
1:空白对照组;2:正常对照组;3:轻度子痫前期组;4:重度子痫前期组。

表2 4组滋养细胞增殖、凋亡和RAGE表达的比较
*:与空白对照组比较,P<0.05;#:与正常组比较,P<0.05;△:与轻度组比较,P<0.05。
3 讨论
S100A12是一种存在于中性粒细胞中的胞质蛋白, 是一种相对分子质量较小的酸性蛋白,属于细胞表面免疫球蛋白超家族中的一员[5],具有S100蛋白家族的一些共性,有独有的结构和功能特点,是一种具有促进炎性反应的钙结合蛋白,其主要作用是使血管内皮细胞黏附分子表达上调,激活炎性细胞、化学趋化和抗微生物作用[2]。Saito等[6]研究表明慢性冠状动脉疾病患者血清S100A12水平与C反应蛋白水平呈正相关。RAGE是一种多配体的膜受体,与配体结合后可启动多条信号通路,引起细胞内氧化应激和炎症反应等,导致细胞功能紊乱[7-8]。S100A12与其受体RAGE结合后可激活包括磷脂酶C、蛋白激酶C、钙调蛋白激酶Ⅱ、分裂原激活蛋白激酶的激酶等[9]途径,最终促使NF-κB入核,调节重要的目的基因的表达,如肿瘤坏死因子(TNF-α)、白介素-1(IL-1)、白介素-6(IL-6)等,这些细胞因子可促进炎症发生。同时NF-κB也是RAGE基因的核转录因子,可上调RAGE基因的表达。因此,S100A12-RAGE结合后可通过正反馈调节使信号级联反应持续发生,使“炎症-抗炎”系统失衡,形成机体内过度炎症反应。
近来越来越多的学者认为,子痫前期是母体对妊娠的一种过度性炎症反应。有学者[10-11]用内毒素刺激成功建立了子痫前期动物模型,且抗炎治疗有效。国内外应用抗炎药物干预子痫前期的研究[12]均表明早期应用小剂量阿司匹林可降低高危妇女子痫前期的发生率。也有学者[1]认为子痫前期病理根源在于胎盘。滋养细胞功能障碍导致血管重塑,胎盘浅着床进而导致胎盘缺血缺氧,胎盘发生缺血再灌注损伤,引起炎症反应,炎症因子释放后再作用于胎盘,形成“炎症-胎盘缺血损伤”正反馈,形成子痫前期的病理特征。
该研究结果显示:S100A12在正常及子痫前期孕妇外周血及胎盘组织中均有表达,但在轻、重度子痫前期组高表达;进一步研究发现,子痫前期孕妇血清可抑制滋养细胞增殖,促进滋养细胞凋亡,而RAGE蛋白表达在子痫前期孕妇血清干预的滋养细胞中也呈相应的高表达。提示S100A12可能参与了子痫前期的发病过程,子痫前期孕妇胎盘组织局部分泌并释放S100A12是其重要来源。S100A12正常表达于中性粒细胞,同时在淋巴细胞、单核细胞中有低表达。正常妊娠时,孕妇自身分泌少量S100A12蛋白,促进多种炎性介质的释放,从而引发全身性炎症反应,并在一定水平上维持“炎症-抗炎”系统的平衡。当这种平衡被打破时,过多的炎症因子可引起免疫细胞分泌包括S100A12在内的促炎因子,形成一个正反馈环路,S100A12的作用被放大,加重了靶器官的损伤,形成了子痫前期状态下的病理改变。
综上所述,S100A12在子痫前期的发病机制中可能发挥重要作用,然而其通过何种机制作用于子痫前期还需进一步研究。
[1]Xu F,Wang H,Zhang X,et al.Cell proliferation and invasion ability of human choriocarcinoma cells lessened due to inhibition of Sox2 expression by microRNA-145[J].Exp Ther Med,2013,5(1):77
[2]Pietzsch J,Hoppmann S.Human S100A12: a novel key player in inflammation?[J].Amino Acids,2009,36(3):381
[3]谢幸,苟文丽.妇产科学[M].北京:人民卫生出版社,2013.
[4]Fromowitz FB,Viola MV,Chao S,et al.Ras p21 expression in the progression of breast cancer[J].Hum Pathol,1987,18(12):1268
[5]Donato R.RAGE: a single receptor for several ligands and different cellular responses: the case of certain S100 proteins[J].Curr Mol Med,2007,7(8):711
[6]Saito T,Hojo Y,Ogoyama Y,et al.S100A12 as a marker to predict cardiovascular events in patients with chronic coronary artery disease[J].Circ J,2012,76(11):2647
[7]Chekir C,Nakatsuka M,Noguchi S,et al.Accumulation of advanced glycation end products in women with preeclampsia: possible involvement of placental oxidative and nitrative stress[J].Placenta,2005,27(2/3):225
[8]Remor AP,de Matos FJ,Ghisoni K,et al.Differential effects of insulin on peripheral diabetes-related changes in mitochondrial bioenergetics:involvement of advanced glycosylated end products[J].Biochim Biophys Acta,2011,1812(11):1460
[9]Mikkelsen SE, Novitskaya V,Kriajevska M,et al.S100A12 protein is a strong inducer of neurite outgrowth from primary hippocampal neurons[J]. J Neurochem, 2001,79(4):767
[10]Canakci V,Canakci CF,Canakci H,et al.Periodontal disease as a risk factor for pre-eclampsia: a case control study[J].Aust N Z J Obstet Gynaecol,2004,44(6):568
[11]Sharma A,Satyam A,Sharma JB.Leptin, IL-10 and inflammatory markers (TNF-alpha,IL-6 and IL-8) in pre-eclamptic,normotensive pregnant and healthy non-pregnant women[J].Am J Reprod Immunol,2007,58(1):21
[12]Chiaffarino F,Parazzini F,Paladini D,et al.A small randomised trial of low-dose aspirin in women at high risk of pre-eclampsia[J].Eur J Obstet Gynecol Reprod Biol,2004,112(2):142
(2014-09-13 收稿 责任编辑王 曼)
Expression of S100A12 in preeclampsia and effects of serum from preeclampsia patients on proliferation, apoptosis and RAGE expression of trophoblast cells
ZHAOXianlan,PANShumin,LIUCai
DepartmentofObstetricsandGynecology,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052
preeclampsia;S100A12;RAGE;trophoblast cell;cell proliferation;cell apoptosis
Aim: To detect the expression of S100A12 in materal periphera blood, placenta of patients with preeclampsia, and investigate the effects of serum from the patients with preeclampsia on proliferation and apoptosis of trophoblast cells. Methods: A total of 60 women with preeclampsia(including 30 cases of mild preeclampsia and 30 cases of severe preeclampsia) and 30 healthy pregnant women(normal control group) were collected. The level of S100A12 protein in maternal peripheral blood was detected by ELISA. Immunohistochemistry method was used to measure the protein expression level of S100A12 in placenta. The trophoblast cells were cultured in vitro for 48 h with the serum from the three groups,and a blank control group was set up as well.The proliferation and apoptosis of trophoblast cell were measured by MTT assay and flow cytometry,and RAGE protein expression was measured by Western blot. Results: The level of S100A12 in maternal peripheral blood and placenta from patients with mild and severe preeclampsia was significantly higher than that of the normal control group(P<0.05). The proliferation rates of trophoblast cells in the mild and severe preeclampsia groups were significantly lower than those in normal control group and the blank control group(P<0.05).The early phase apoptosis rate,late phase apoptosis rate and total apoptosis rate and the level of RAGE protein of trophoblast cells in the mild and severe preeclampsia groups were significantly higher than those in the normal control group and the blank control group(P<0.05). The changes of severe preeclampsia group were more significant than that of the mild group(P<0.05).Conclusion: The high expression of S100A12 protein may play an important role in pathogenesis of preeclampsia.
10.13705/j.issn.1671-6825.2015.03.015
R714.51
