丙泊酚对HepG2肝母细胞瘤细胞侵袭能力的影响*
2015-04-18宋平义景桂霞张晓琪南克俊沙保勇
高 巍,宋平义,景桂霞#,张晓琪,南克俊,沙保勇
1)西安交通大学医学部第一附属医院麻醉科 西安 710061 2)西安交通大学医学部第一附属医院肿瘤内科 西安 710061 3)西安医学院基础医学部基础医学研究所 西安 710021
丙泊酚对HepG2肝母细胞瘤细胞侵袭能力的影响*
高 巍1),宋平义1),景桂霞1)#,张晓琪1),南克俊2),沙保勇3)#
1)西安交通大学医学部第一附属医院麻醉科 西安 710061 2)西安交通大学医学部第一附属医院肿瘤内科 西安 710061 3)西安医学院基础医学部基础医学研究所 西安 710021
#通信作者:沙保勇,男,1982年3月生,博士,讲师,研究方向:中枢神经功能损伤与重建,E-mail:shabaoyong@gmail.com;景桂霞,女,1958年9月生,教授,研究方向:麻醉药物对肿瘤的影响,E-mail:jgx666@126.com
丙泊酚;肝母细胞瘤;MMP-2;MMP-9;TIMP-1;侵袭
目的:探讨丙泊酚对HepG2肝母细胞瘤细胞侵袭能力的影响及相关机制。方法:用不同质量浓度(0、3、6、9和12 mg/L)丙泊酚培养HepG2细胞24 h后,通过细胞侵袭实验检测侵袭率;培养24、48和72 h后用MTT法检测细胞活性;培养48 h后采用RT-PCR和Western blot法检测细胞中MMP-2、MMP-9 mRNA及MMP-2、MMP-9和TIMP-1蛋白的表达。结果:随丙泊酚质量浓度的增加,HepG2细胞的侵袭能力逐渐降低(F=4 883.900,P<0.001),细胞活性逐渐降低(F=38.334,P<0.001),MMP-2及MMP-9 mRNA及蛋白的表达亦逐渐降低(P<0.05),而TIMP-1蛋白的表达逐渐升高(F=44.918,P<0.001)。结论:丙泊酚能降低HepG2细胞的侵袭能力及细胞活性,其机制与抑制MMP-2和MMP-9蛋白的表达及促进TIMP-1蛋白的表达有关。
丙泊酚(propofol)是烷基酚类短效静脉麻醉药。除麻醉作用外,丙泊酚还可影响肿瘤的生物学行为,但对不同的肿瘤细胞有不同的作用效果[1-3]。丙泊酚可通过调节Ca2+内流重组肌动蛋白,增强乳癌细胞的迁移能力[4]。作为γ-氨基丁酸A(GABAA)受体的激动剂,丙泊酚可通过激活GABAA受体,减少基质金属蛋白酶(matrix metalloproteinases,MMPs)的生成及降低其活性,从而抑制大肠癌细胞的侵袭[5]。将骨肉瘤细胞移植到大鼠背部皮下后, 40 mg/(kg·d)的丙泊酚腹腔持续泵注能降低肺转移肿瘤细胞的数量,但无法抑制其生长[1]。通过激活核因子E2相关因子2(Nrf2)上调血红素氧合酶-1的表达,丙泊酚可促进胆囊癌细胞的增殖及转移,并抑制其凋亡[6]。
肝母细胞瘤为儿童肝脏高发病率肿瘤,肝母细胞瘤手术过程及术后镇静均会大量用到丙泊酚,但有关丙泊酚对肝母细胞瘤细胞侵袭能力的影响及机制的研究较少。因此,作者对丙泊酚处理后肝母细胞瘤HepG2细胞侵袭能力进行了观察,并对其MMP-2、MMP-9及TIMP-1的表达情况进行了检测,以期为肝母细胞瘤手术中丙泊酚的使用及术后镇静药物的选择提供一定的参考。
1 材料与方法
1.1 细胞来源 HepG2细胞由西安交通大学肿瘤内科实验室提供,于含体积分数10%胎牛血清、终浓度为100 U/mL青、链霉素的DMEM培养基中,在37 ℃和体积分数5%CO2条件下培养。培养好的细胞经细胞计数板计数后用于后续实验。
1.2 主要试剂 DMEM细胞培养液购自Gibco公司,胎牛血清购自Hyclone公司,RNA提取试剂盒、逆转录试剂盒等购自Thermo公司,MMP-2、MMP-9及TIMP-1抗体购自Cell Signaling Technology公司,竟安丙泊酚中/长链脂肪乳注射液购自北京费森尤斯卡比医药有限公司,脂肪乳购自华瑞制药有限公司。如非特殊说明,其他试剂耗材均购自Sigma公司。

1.4 细胞活性实验 将培养好的细胞消化计数后加入96孔板中,每孔100 μL细胞悬液(细胞密度为5×104mL-1)。待细胞贴壁后,分别加入0、3、6、9及12 mg/L的丙泊酚或脂肪乳,培养24、48和72 h。完成孵育后,取出96孔培养板,弃去培养液并用PBS清洗,加入含MTT(终质量浓度为5 g/L)的DMEM培养液100 μL,继续培养细胞4 h后,弃去培养液,每孔加100 μL二甲基亚砜,摇床振荡溶解结晶物。以630 nm 处吸光度(A)为参照,用酶联免疫检测仪(Multiskan Go)测量570 nm 处的A,计算细胞活性。细胞活性=[(实验组A(570 nm)-实验组A(630 nm)]/[(正常对照组A(570 nm)-正常对照组A(630 nm)]×100%。实验重复3次,每个实验点4个复孔。
1.5 HepG2细胞中MMP-2、MMP-9和TIMP-1 mRNA和蛋白的检测 将培养好的细胞消化计数后加入6孔板中(细胞密度为5×105mL-1),待细胞贴壁后,分别加入0、3、6、9及12 mg/L的丙泊酚或脂肪乳培养48 h,收集细胞,分别进行HepG2细胞中MMP-2、MMP-9 mRNA(RT-PCR法)和MMP-2、MMP-9 及TIMP-1蛋白(Western Blot法)的测定。
1.5.1 RT-PCR 提取细胞总RNA,逆转录得cDNA,以此为模板进行PCR。MMP-2引物上游:5’-TCCCCTTCTTGTTCAATGG-3’,下游:5’-GGAAGCG GAATGGAAACTT-3’。MMP-9引物上游:5’-CGAT GACGAGTTGTGGTCC-3’,下游:5’-GTACTGCAC CAGGGCAAGC-3’。于无菌无酶PCR管中配制50 μL反应体系,反应条件为94 ℃60 s,60 ℃50 s,72 ℃90 s,40次循环后,72 ℃延伸10 min;4 ℃保存以备20 g/L琼脂糖凝胶电泳。实验重复3次,每个实验点2个复孔。
1.6 统计学处理 应用SPSS 13.0进行数据分析。不同质量浓度丙泊酚或脂肪乳处理后HepG2细胞侵袭率,MMP-2、MMP-9和TIMP-1表达的比较采用单因素方差分析及LSD-t检验,细胞活性的比较采用5×3析因设计的方差分析,检验水准α=0.05。
2 结果
2.1 丙泊酚对HepG2细胞侵袭率的影响 见图1和表1。可以看出,HepG2细胞的侵袭率随丙泊酚质量浓度的增加而降低。

图1 丙泊酚(A)及脂肪乳(B)处理后的HepG2细胞(Transwell,×400)

表1 丙泊酚对HepG2细胞侵袭率的影响 %
丙泊酚组各浓度间两两比较,P均<0.05。
2.2 丙泊酚对HepG2细胞细胞活性的影响 0、3、6、9和12 mg/L的脂肪乳作用24~72 h后,HepG2细胞活性无明显变化(表2)。0、3、6、9和12 mg/L的丙泊酚作用24~72 h后,随着丙泊酚质量浓度的增加,HepG2细胞活性降低并呈现浓度和时间依赖性(表3)。

表2 脂肪乳对HepG2细胞活性的影响(n=12) %
F时间=0.394,P=0.687;F浓度=3.266,P=0.072;F交互=0.187,P=0.991。

表3 丙泊酚对HepG2细胞活性的影响(n=12) %
F时间=12.090,P=0.004;F浓度=38.334,P<0.001;F交互=14.078,P<0.001。
2.3 丙泊酚对HepG2细胞中相关mRNA和蛋白表达的影响 丙泊酚及脂肪乳处理48 h后,HepG2细胞中MMP-2及MMP-9 mRNA的表达情况见图2。可以看出,随丙泊酚质量浓度的增加,MMP-2及MMP-9 mRNA条带逐渐变浅,提示HepG2细胞中两者表达逐渐减弱。MMP-2、MMP-9及TIMP-1蛋白的表达情况见图3、表4和表5。可见,随丙泊酚质量浓度的增加,HepG2细胞中MMP-2、MMP-9蛋白的表达逐渐下降,TIMP-1蛋白表达逐步升高。

图2 丙泊酚(上)及脂肪乳(下)对MMP-2和MMP-9 mRNA表达的影响
1~5:分别为0、3、6、9和12 mg/L丙泊酚或脂肪乳作用48 h后MMP-2 mRNA的表达;6~10:分别为0、3、6、9和12 mg/L丙泊酚或脂肪乳作用48 h后MMP-9 mRNA的表达;M:Marker。

图3 丙泊酚及脂肪乳对MMP-2、MMP-9及TIMP-1蛋白表达的影响
A:丙泊酚;B:脂肪乳;C:内参;1~5:分别为0、3、6、9和12 mg/L。
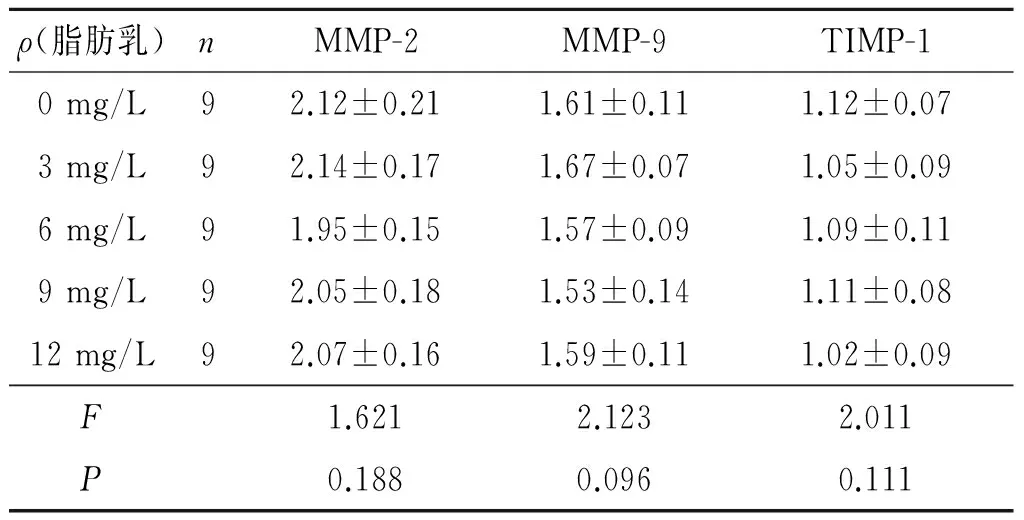
表4 脂肪乳对MMP-2、MMP-9及TIMP-1蛋白表达的影响

表5 丙泊酚对MMP-2、MMP-9及TIMP-1蛋白表达的影响
*:与0 mg/L相比。
3 讨论
肝母细胞瘤发病隐匿,恶性程度高,发展迅速,可通过血液和淋巴途径转移到肺、腹腔、脑等部位,仅1/3的肝母细胞瘤患者术后可存活5 a,患者多因癌细胞的远处转移而死亡[7]。目前,手术治疗已成为国内外治疗肝母细胞瘤的首选方法,无论是手术过程中还是术后镇静,都会大量用到丙泊酚。因此,丙泊酚对肝母细胞瘤细胞生物学行为的影响也逐渐受到人们的关注[8]。
该研究采用不同质量浓度的丙泊酚和脂肪乳处理HepG2细胞,观察细胞侵袭能力的变化。临床上使用的丙泊酚一般为白色、均匀、乳状的注射液,含有助于丙泊酚溶解的大豆油和脂肪乳。在该研究中使用的丙泊酚实际为丙泊酚中/长链脂肪乳注射液。为明确丙泊酚这种物质对肿瘤细胞行为的影响,该研究中所有实验均以脂肪乳作为对照。临床手术时,丙泊酚的血浆浓度范围为3~8 mg/L[9]。考虑到90%的丙泊酚通过肝脏代谢,丙泊酚有在肝脏中富集的可能性[10],故该研究选用3、6、9和12 mg/L的丙泊酚处理HepG2细胞,探究其对肿瘤细胞侵袭能力的影响及潜在机制,更切合临床实际。
侵袭转移是恶性肿瘤的标志特征之一。肿瘤细胞需要克服细胞外基质和多种细胞因子构成的物理化学屏障后,才能侵入到周围组织,进而侵入循环系统[11]。因此,基底膜及细胞外基质的降解成为肿瘤细胞能否侵袭转移的关键,在此过程中发挥关键作用的酶主要是MMPs,尤其是MMP-2和MMP-9[11]。该研究中,经丙泊酚处理后的HepG2细胞侵袭能力降低,细胞活性降低并呈现浓度和时间依赖性,TIMP-1表达升高,MMP-2及MMP-9的表达下降,这与丙泊酚抑制SMMC-7721侵袭的结果[12]相似。MMP-2在肿瘤发生的早期能改变组织原有的特异结构,为肿瘤细胞提供合适的生长微环境,促进肿瘤细胞的转移和侵袭[13]。MMP-2还能诱导细胞表面黏附分子水解脱落,激活更多细胞因子,调控肿瘤细胞的代谢及凋亡[14-15]。MMP-9与Ⅳ型胶原有高度亲和力,能发挥基底膜降解酶的作用,在肿瘤侵袭中作用极其重要[16]。而且,MMP-9能诱导蛋白聚糖β亚基和连接蛋白-1的裂解,增强肿瘤的原位分离和侵袭[17]。作为MMPs抑制剂的TIMP-1,其在侵袭能力强的肿瘤中低表达,在侵袭能力弱的肿瘤中高表达[18]。基于以上研究结果,作者认为丙泊酚可能通过上调TIMP-1的表达,抑制MMP-2和MMP-9的表达,降低HepG2细胞的侵袭能力。
总之,该研究发现,丙泊酚对HepG2细胞的侵袭能力有抑制作用,这为将丙泊酚用于肿瘤侵袭抑制提供了一定的实验依据,但要真正实现丙泊酚在缓解肿瘤患者痛苦的同时发挥抑癌的双重作用,还需要大量的动物实验来证实,并需考虑诸多临床实际问题。
[1]Mammoto T,Mukai M, Mammoto A,et al.Intravenous anesthetic,propofol inhibits invasion of cancer cells[J].Cancer Lett,2002,184(2):165
[2]Wang P,Chen J,Mu LH,et al.Propofol inhibits invasion and enhances paclitaxel-induced apoptosis in ovarian cancer cells through the suppression of the transcription factor slug[J].Eur Rev Med Pharmacol Sci,2013,17(13):1722
[3]Zhang J,Zhang D,Wu GQ,et al.Propofol inhibits the adhesion of hepatocellular carcinoma cells by upregulating microRNA-199a and downregulating MMP-9 expression[J].Hepatobiliary Pancreat Dis Int,2013,12(3):305
[4]Garib V,Lang K,Niggemann B,et al.Propofol-induced calcium signalling and actin reorganization within breast carcinoma cells[J].Eur J Anaesthesiol,2005,22(8):609
[5]Miao Y,Zhang Y,Wan H,et al.GABA-receptor agonist,propofol inhibits invasion of colon carcinoma cells[J].Biomed Pharmacother,2010,64(9):583
[6]Coetzee JF,Glen JB,Wium CA,et al.Pharmacokinetic model selection for target controlled infusions of propofol. Assessment of three parameter sets[J].Anesthesiology,1995,82(6):1328
[7]Hoffmann K,Schmidt J.New surgical approaches in the treatment of hepatocellular carcinoma[J].Z Gastroenterol,2009,47(1):61
[8]刘叶,阮林,刘华.丙泊酚对肝癌细胞HepG2生物学行为的影响[J].临床麻醉学杂志,2013,29(5):491
[9]Kushida A,Inada T,Shingu K.Enhancement of antitumor immunity after propofol treatment in mice[J].Immunopharmacol Immunotoxicol,2007,29(3/4):477
[10]杨婉花,陈冰,李娟,等.丙泊酚药物代谢动力学研究概述[J].中国药师,2008,11(10):1243
[11]Sternlicht MD,Werb Z.How matrix metalloproteinases regulate cell behavior[J].Annu Rev Cell Dev Biol,2001,17:463
[12]李培生,黄晓光,杨惠钿,等.丙泊酚对肝癌细胞侵袭能力的影响[J].分子诊断与治疗杂志,2012(6):385
[13]Bourboulia D,Stetler-Stevenson WG.Matrix metalloproteinases (MMPs) and tissue inhibitors of metalloproteinases (TIMPs):positive and negative regulators in tumor cell adhesion[J].Semin Cancer Biol,2010,20(3):161
[14]Sbardella D,Fasciglione GF,Gioia M,et al.Human matrix metalloproteinases:an ubiquitarian class of enzymes involved in several pathological processes[J].Mol Aspects Med,2012,33(2):119
[15]Tang N,Xie Q,Wang X,et al.Inhibition of invasion and metastasis of MHCC97H cells by expression of snake venom cystatin through reduction of proteinases activity and epithelial-mesenchymal transition[J].Arch Pharm Res,2011,34(5):781
[16]Chambers AF,Matrisian LM. Changing views of the role of matrix metalloproteinases in metastasis[J].J Natl Cancer Inst,1997,89(17):1260
[17]Schenk S,Quaranta V.Tales from the crypt[ic] sites of the extracellular matrix[J].Trends Cell Biol,2003,13(7):366
[18]Mohanam S,Wang SW,Rayford A,et al.Expression of tissue inhibitors of metalloproteinases:negative regulators of human glioblastoma invasion in vivo[J].Clin Exp Metastasis,1995,13(1):57
(2014-09-15 收稿 责任编辑王 曼)
Effects of propofol on the invasion ability of hepatoblastoma HepG2 cells
GAOWei1),SONGPingyi1),JINGGuixia1),ZHANGXiaoqi1),NANKejun2),SHABaoyong3)
1)DepartmentofAnesthesiology,theFirstAffiliatedHospital,Xi′anJiaotongUniversity,Xi′an710061 2)DepartmentofOncology,theFirstAffiliatedHospital,Xi′anJiaotongUniversity,Xi′an710061 3)InstituteofBasicMedicalSciences,Xi′anMedicalUniversity,Xi′an710021
propofol;hepatoblastoma;MMP-2;MMP-9;TIMP-1;invasion
Aim: To investigate the effects and related mechanism of propofol on the invasion ability of HepG2 cells. Methods: Different concentrations(0,3,6,9 and 12 mg/L) of propofol were used to treat HepG2 cells. The invasion ability was detected by Transwell after 24 h treatment; cell viability of HepG2 cells was studied through MTT assay after 24,48,and 72 h treatment. The expressions of MMP-2,MMP-9 and TIMP-1 were measured through RT-PCR and Western blot after 48 h treatment. Results: The invasion ability and cell viability of HepG2 cells, the mRNA and protein expressions of MMP-2 and MMP-9, were significantly decreased with the increase of propofol concentration(P<0.05). The protein expression of TIMP-1 was significantly increased with the increase of propofol concentration(F=44.918,P<0.001). Conclusion: Propofol could reduce the invasive activity and cell viability of HepG2 cells through the inhibition of MMP-2 and MMP-9, and overexpression of TIMP-1.
10.13705/j.issn.1671-6825.2015.03.003
*国家自然科学基金青年项目 81301308,81301040;陕西省自然科学基础研究计划项目 2014JQ4158;陕西省青年科技新星项目 2014KJXX-76
R735.7
