芍药苷抑制大鼠小脑浦肯野细胞对急性缺氧的功能反应*
2015-04-17任颖鸽谭晓丽杜永平张月萍
任颖鸽, 谭晓丽, 陈 静, 张 静, 杜永平, 张月萍△
(第四军医大学西京医院 1全军中医内科中心, 2儿科脑发育研究室,陕西 西安 710032)
芍药苷抑制大鼠小脑浦肯野细胞对急性缺氧的功能反应*
任颖鸽1,2, 谭晓丽2, 陈 静2, 张 静2, 杜永平1△, 张月萍2△
(第四军医大学西京医院1全军中医内科中心,2儿科脑发育研究室,陕西 西安 710032)
目的: 研究芍药苷(paeoniflorin,Pae)对大鼠小脑浦肯野细胞(Purkinje cells,PCs)急性缺氧电生理反应的影响。方法: 采用全细胞膜片钳记录法,记录大鼠小脑PCs膜电位、兴奋性和平行纤维(parallel fibre,PF)-PC兴奋性突触后电流(excitatory postsynaptic currents,EPSCs),观察急性缺氧和芍药苷对上述电生理功能的影响。结果: 缺氧后PCs 首先表现为短暂的超极化,继之以短暂的去极化和持续超极化,芍药苷完全阻断了PCs的缺氧性超极化,并使PCs缺氧性去极化的幅度减小,持续时间缩短;缺氧上调了PCs兴奋性,芍药苷对缺氧引起的PCs的高兴奋性无显著影响;急性缺氧引起了PF-PC EPSCs的长时程抑制(long-term depression,LTD);芍药苷可部分逆转缺氧引起的PF-PC EPSCs衰减。结论: 芍药苷显著减轻了大鼠小脑PCs的缺氧反应,可能增强了PCs对急性缺氧的耐受性。
芍药苷; 缺氧; 浦肯野细胞; 膜电位; 突触传递
哺乳类动物中枢神经系统神经元对缺氧非常敏感,数分钟缺氧即可改变神经元的功能,甚至导致神经元损伤或死亡。缺氧引起的神经元功能改变主要包括细胞膜去极化和突触传递衰减[1-2]。近几十年来,缺氧损伤的机制已在海马和皮层神经元中得到广泛的研究。然而,对缺氧高度敏感的小脑神经元却未受到足够的关注[3]。小脑主神经元浦肯野细胞(Purkinje cells,PCs)不仅接受来自苔状纤维和爬行纤维(climbing fibre, CF)的兴奋性输入,而且接受来自中间神经元的抑制性输入[4],因而是研究缺氧损伤和缺氧保护机制的理想模型。
芍药苷(paeoniflorin,Pae)作为芍药的重要活性成分,有良好的神经保护作用[5]。由于芍药苷能够迅速透过血脑屏障,因而具有治疗神经系统各种疾病的潜力。研究发现芍药苷能够对抗缺氧引起的兴奋性氨基酸浓度升高[6],抑制细胞内钙超载[7],而且能阻断钠离子通道[8],激活腺苷A1受体[9],从而发挥缺氧保护作用。然而,芍药苷对小脑神经元的缺氧性功能反应有无影响尚不清楚。本研究采用全细胞膜片钳技术记录大鼠小脑PCs在急性缺氧时膜电位和突触传递的变化,发现芍药苷能显著抑制PCs的缺氧反应,现报道如下。
材 料 和 方 法
1 材料
1.1 实验动物 出生7~10 d的SD大鼠,由第四军医大学实验动物中心提供。
1.2 试剂 NaCl、KC1、NaH2PO4·H2O、MgSO4·7H2O、CaCl2·2H2O、NaHCO3、葡萄糖、葡萄糖酸钾、HEPES、EGTA、磷酸肌酸二钠、Na2ATP、Na3GTP和KOH均购自Sigma;芍药苷购自中国药物检定所。
1.3 溶液 人工脑脊液(artificial cerebrospinal fluid,ACSF)成分(mmol/L):NaCl 126.0,KCl 5.0,NaH2PO4·H2O 1.25,MgSO4·7H2O 2.0,CaCl2·2H2O 2.0,NaHCO326.0,葡萄糖10.0,pH 7.35~7.45,渗透压310~320 mOsm/L。电极内液成分(mmoL/L):葡萄糖酸钾 120.0,KC1 5.0,HEPES 10.0,EGTA 5.0,CaCl2·2H2O 0.5,MgSO4·7 H2O 2.0,磷酸肌酸二钠 2.0,Na2ATP 4.0,Na3GTP 0.3,用浓度为0.5 mol/L的KOH调pH为7.35~7.45,渗透压285~300 mOsm/L。
1.4 仪器 振动切片机(Leica),正置显微镜(Zeiss),微电极操纵仪(Sutter Instrument),放大器(Axon Instrument),模拟-数字转换器(Axon Instruments),电极拉制仪(Sutter Instrument),刺激器(CYGNUS),渗透压测定仪(FISKE Associate),恒流泵(上海沪西仪器厂)。
2 方法
2.1 脑片制备 取SD幼鼠小脑,放入充95% O2、5% CO2混合气的0 ℃ ACSF中,约1 min后取出,修整后移入切片槽内固定,用振动切片机切出300 μm厚的脑片,立即转移至32 ℃的ACSF中孵育约30 min,移至室温下继续孵育1 h后开始记录。整个过程通以95% O2、5% CO2混合气体。实验操作及内容符合西京医院实验动物保护和使用委员会的规定。2.2 全细胞膜片钳记录 将脑片移至记录浴槽内,先在低倍镜下确定小脑皮层的细胞层,然后在高倍镜下选择表面光滑、轮廓清晰、立体感强的PCs进行全细胞膜片钳记录。玻璃微电极充灌内液后电阻为7~9 MΩ,电压钳状态下钳制电压为-70 mV。记录过程中使用恒流泵持续向记录浴槽内灌注含95% O2、5% CO2混合气体的ACSF,流速为2 mL/min。在保持膜电位为-60 mV左右的电流钳状态下,通过向细胞内注射去极化电流(-50~300 pA,300 ms)诱发记录细胞的动作电位。将充有ACSF的玻璃微电极刺激小脑脑片的分子层,通过刺激器给予方波刺激(波宽0.1 ms,强度20~50 μA),则可在PCs上记录到平行纤维(parallel fibre,PF)兴奋引起的兴奋性突触后电流(excitatory postsynaptic currents,EPSCs)。所有记录在室温(20~25 ℃)下进行。
2.3 缺氧处理和药物干预 稳定记录3 min后,将充以95% O2、5% CO2的ACSF转换为充95% N2、5% CO2混合气的ACSF灌流脑片2 min进行急性缺氧处理,2 min后再转换为正常灌流液。进行药物干预时,在充95% N2、5% CO2混合气的ACSF加入芍药苷(300 μmol/L)。研究表明芍药苷的神经保护作用存在明显的量效关系[5],300 μmol/L是最佳作用剂量。
3 统计学处理
数据采集使用pCLAMP软件,数据测量使用Clampfit软件。数据应用Origin 8.0分析,以均数±标准差(mean±SD)表示,采用t检验或方差分析比较组间差异,以P<0.05为差异有统计学意义。
结 果
1 芍药苷对急性缺氧大鼠小脑PCs膜电位的影响
在电流钳模式下,记录PCs的膜电位。共记录78个PCs,平均静息膜电位为(-58.6±10.1) mV。缺氧首先使PCs表现为短暂的早期超极化,紧接着一个短暂的较大的去极化和稳定的缺氧后超极化,缺氧后超极化伴随自发放电频率增加,可持续30 min以上。早期超极化的时程为(0.47±0.14) min,去极化时程为(2.46±0.50) min。从缺氧处理开始到缺氧反应出现的时间延迟为0.69 min。
为了研究芍药苷对PCs膜电位缺氧性变化的影响,在缺氧灌流液中加入芍药苷(300 μmol/L),结果发现PCs膜电位仅表现为短暂的去极化[ΔV=(18.8±2.8) mV,去极化时程为(1.84±0.35) min],复氧后膜电位恢复到静息膜电位。与单纯缺氧相比,去极化时间显著缩短(P<0.05),去极化的幅度显著减小(P<0.05)。早期超极化和缺氧后超极化均未出现。此外,芍药苷使缺氧反应的延迟增加到1.2 min,与单纯缺氧相比有显著差异(P<0.05),见图1、表1。
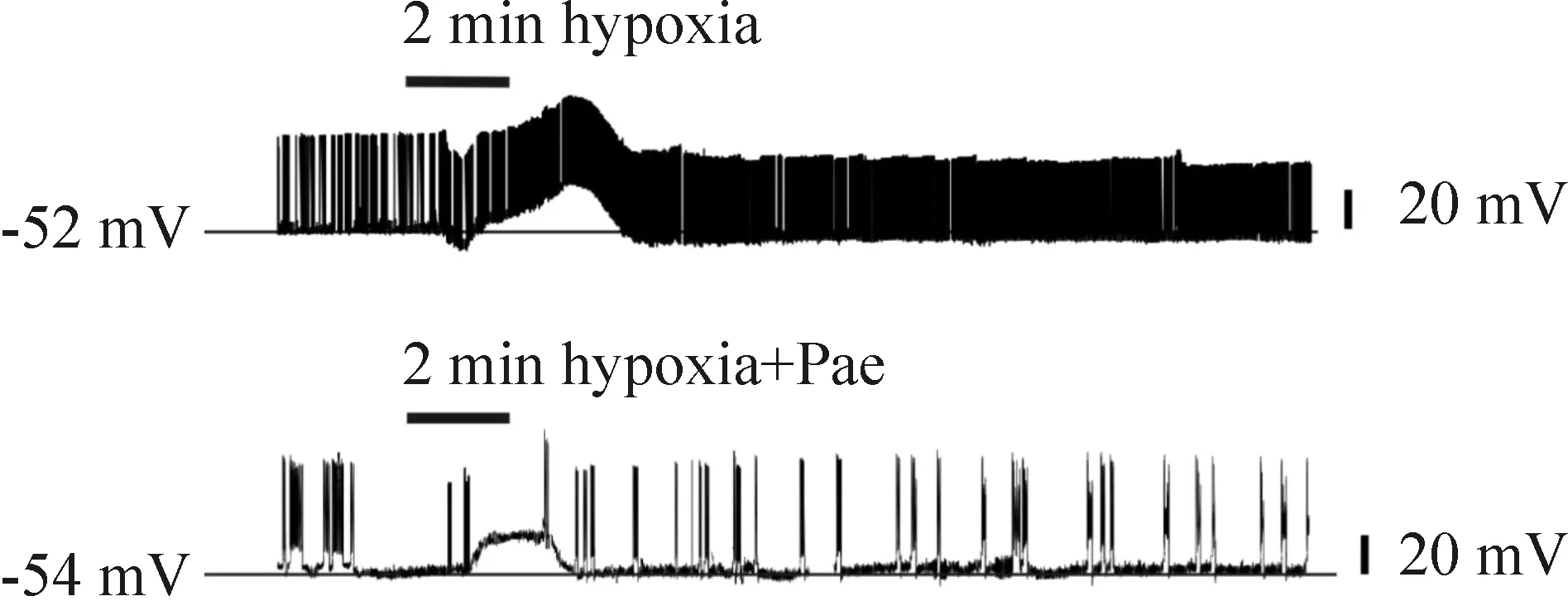
Figure 1.The effects of Pae on the hypoxia-induced changes in membrane potential.
图1 芍药苷对缺氧引起的PCs膜电位变化的影响

表1 芍药苷对缺氧引起的PCs膜电位变化的影响
R: resting potential; H: hypoxia hyperpolarization; D: depolarization; PH: post-hypoxia hyperpolarization.*P<0.05vshypoxia.
2 芍药苷对急性缺氧大鼠小脑PCs兴奋性的影响
电流钳模式下,细胞被钳制在-60 mV左右,细胞内注射去极化电流诱发PCs动作电位。结果发现缺氧使PCs动作电位的阈值由(102.8±20.5) pA 降低到(77.1±12.3) pA(P<0.01);同时发现,缺氧后诱发动作电位的频率增高(P<0.05)。表明缺氧上调了PCs的兴奋性,见图2。
缺氧灌流液中加入芍药苷,仍然使PCs的动作电位阈值降低(P<0.01),诱发动作电位的频率增高(P<0.05),表明芍药苷并没有改变缺氧引起的PCs高兴奋性,见图2。

Figure 2.The effects of Pae on the hypoxic changes of PC excitability. A: an example of a PC spikes in response to depolarizing current step (60 pA) before and after 2 min of hypoxic insult; B: pooled data of 9 PCs show that the spike frequency increased after hypoxic insult; C: the threshold of spikes was decreased significantly by hypoxic insult in rat PCs; D: an example of a PC spikes in response to depolarizing current step (60 pA) before and after hypoxia episode with Pae treatment; E: pooled data of 6 PCs show that the spike frequency increased after hypoxic insult with the presence of Pae; F: the threshold of spikes was still decreased by hypoxic insult with the presence of Pae in rat PCs. Mean±SD.n=9 in B and C;n=6 in E and F.*P<0.05,**P<0.01vscontrol.
图2 芍药苷对缺氧引起的PCs兴奋性变化的影响
3 芍药苷对急性缺氧大鼠小脑PF-PC突触传递的影响
急性缺氧使大鼠小脑PF-PC突触传递迅速抑制,PF-PC EPSCs的曲线下面积(area under the curve,AUC)降低到缺氧前的(43.0±4.9)%(P<0.01)并持续30 min以上,即LTD。若缺氧的同时给予芍药苷,PF-PC EPSCs的AUC仅降低到缺氧前的(65.0±7.6)%(P<0.01),与单纯缺氧引起的EPSCs AUC相比,差异显著(P<0.05),见图3。
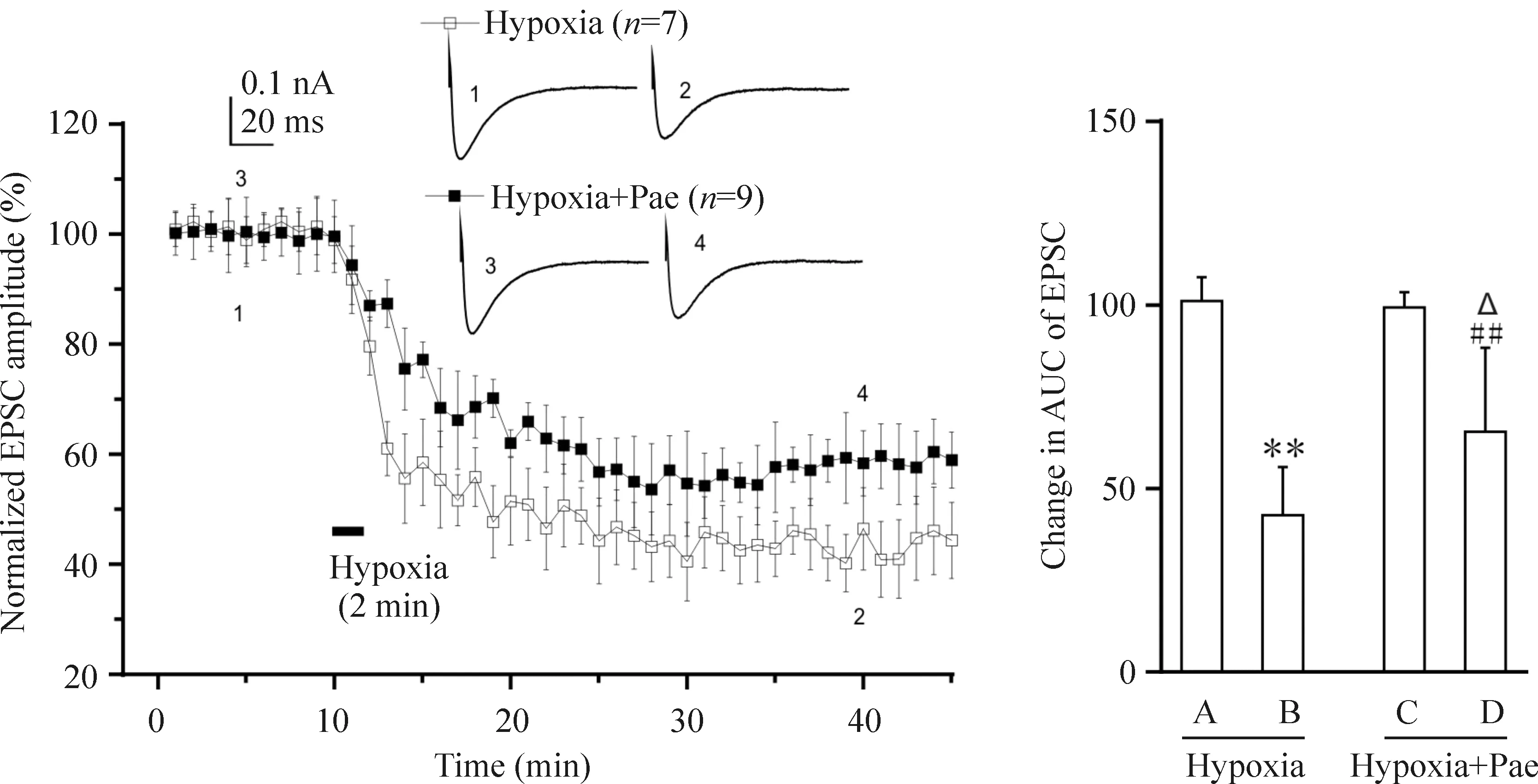
Figure 3.The effects of Pae on the hypoxia-induced changes in PF-PC EPSCs. Insets are averaged PF-PC EPSCs from 6 sweeps taken before and after hypoxia. A,C: the first 10 min of the record; B,D: the last 10 min of the record.**P<0.01vsA;##P<0.01vsC;△P<0.05vsB.
图3 芍药苷对缺氧引起的PF-PC EPSC变化的影响
讨 论
本研究发现急性缺氧引起了大鼠PCs膜电位的3相变化,首先表现为短暂的缺氧性超极化,随后是较大的去极化,接着又是缺氧后超极化。缺氧引起的PCs膜超极化和去极化均较在其它脑区神经元观察到的超极化或去极化的幅度大[10]。这一现象表明小脑PCs对缺氧的敏感性更高。在海马神经元的研究显示缺氧时由于能量代谢障碍导致ATP水平降低,激活ATP敏感的钾离子通道引起钾离子外流,以及腺苷释放增多而激活腺苷A1受体,是引起缺氧性超极化的主要机制[11]。有研究发现芍药苷能够激活腺苷A1受体[9],提示芍药苷有可能通过神经元超极化而产生神经保护作用。但本实验结果却显示芍药苷阻断了缺氧引起的PCs早期超极化和缺氧后超极化,提示在小脑主神经元PCs中,芍药苷不是通过超极化机制发挥神经保护作用的。而芍药苷在小脑环路的神经保护作用与腺苷A1受体激活是否相关,有待进一步研究。
缺氧性去极化被认为是神经元缺氧性损伤的触发机制。本研究中,芍药苷抑制了PCs缺氧性去极化的幅度和时程,并延长了PCs膜电位缺氧性反应的潜伏期,表明芍药苷的存在增强了PCs的缺氧耐受性。有研究表明芍药苷能对抗缺氧引起的兴奋性氨基酸过度释放[6],阻断钠离子通道[8],这可能与芍药苷抑制了PCs缺氧性去极化有关。
关于缺氧后神经元兴奋性的改变文献报道不一致。Doolette等[12]报道缺氧后海马CA1区神经元兴奋性增高,Zhao等[13]研究发现缺氧并没有改变CA1区神经元的兴奋性。本研究发现缺氧上调了PCs的兴奋性。芍药苷虽然部分抑制了PCs的去极化,却未改变PCs的缺氧性高兴奋性。一般认为神经元缺氧状态下兴奋性增高会加速能量消耗,是导致缺氧损伤的重要机制[10]。然而,在小脑神经元环路中,如果PCs兴奋性降低,PCs对小脑深部核团的传出细胞的抑制将会减弱,小脑传出到其它脑区的信号则会随之增强。所以,我们认为,缺氧引起的PCs高兴奋性应该是小脑环路的代偿性保护机制之一,目的是有效抑制传出细胞的兴奋性输出。以往的研究已从多方面证实芍药苷有抑制神经元缺氧性高兴奋性的作用[5-8],因此,我们的研究结果提示芍药苷对神经元兴奋性的调节可能受不同神经元环路的影响:芍药苷可能容易对那些释放兴奋性神经递质神经元产生抑制,而对于释放抑制性神经递质的神经元的兴奋性却没有明显的抑制作用。芍药苷阻断PCs的缺氧性超极化,不影响PCs的缺氧性高兴奋性,正是一种通过维持PCs兴奋性,从而维持全脑抑制水平的一种神经环路保护机制。
缺氧可引起谷氨酸能突触传递的迅速抑制[14],这种抑制在多个脑区均是可逆的,甚至表现为缺氧后增强[15]。许多研究表明缺氧引起的突触传递抑制与腺苷A1受体激活有关[15]。而在小脑脑片的研究显示对腺苷不敏感的PF-PC突触也同样表达缺氧性抑制。本研究中,缺氧迅速引起了PF-PC LTD,与文献报道一致,但这种抑制不因复氧而恢复,更未显示缺氧后增强现象。虽然神经元突触传递的缺氧性抑制被认为是一种保护机制,然而,PF-PC的突触传递的抑制,可能导致PC-小脑深核传出细胞的突触传递的衰减,不利于小脑环路输出信息的稳定。芍药苷显著抑制了PF-PC突触传递的缺氧性衰减,表明芍药苷能部分挽救缺氧后PF-PC突触的功能状态,有利于小脑环路输出信息的稳定,这可能是芍药苷发挥神经保护作用的一个重要机制。然而,芍药苷是否对缺氧时CF-PC突触传递和抑制性突触传递有影响,有待我们的进一步研究。
综上所述,缺氧可引起PCs膜电位的3相型改变,使PCs兴奋性增高,迅速抑制PF-PC突触传递。芍药苷能够完全阻断PCs的缺氧性超极化,部分抑制PCs去极化,部分逆转缺氧引起的PF-PC突触传递衰减。我们认为芍药苷对PCs缺氧性功能反应的抑制有利于维持小脑环路的稳定输出,从而具有神经保护意义。
[1] Hyllienmark L, Brismar T. Effect of hypoxia on membrane potential and resting conductance in rat hippocampal neurons[J]. Neuroscience, 1999, 91(2):511-517.
[2] Zhu PJ, Krnjevic K. Anoxia selectively depresses excitatory synaptic transmission in hippocampal slices[J]. Neurosci Lett, 1994, 166(1):27-30.
[3] Barenberg P, Strahlendorf H, Strahlendorf J. Hypoxia induces an excitotoxic-type of dark cell degeneration in cerebellar Purkinje neurons[J]. Neurosci Res, 2001, 40(3):245-254.
[4] Zhang Y, Shi Z, Magnus G, et al. Functional circuitry of a unique cerebellar specialization: the valvula cerebelli of a mormyrid fish[J]. Neuroscience, 2011, 182:11-31.
[5] 朱叶芳,党姗姗,华子瑜. 芍药苷神经保护机制的研究进展[J]. 中国中药杂志, 2010, 35(11):1490-1493.
[6] 孙 蓉,衣银萍,吕丽莉,等. 芍药苷对大鼠全脑缺血模型的影响[J]. 中国中药杂志, 2007, 32(23):2518-2522.
[7] 杨 军,何丽娜,何素冰,等. 芍药甙对大鼠皮层神经细胞钙超载损伤的保护作用[J]. 中国药理学与毒理学杂志, 2001,15(3):164-168.
[8] Zhang GQ, Hao XM, Chen SZ, et al. Blockade of paeoniflorin on sodium current in mouse hippocampal CA1 neurons[J]. Acta Pharmacol Sin, 2003, 24(12):1248-1252.
[9] Liu H, Zhang W, Luo X, et al. Paeoniflorin attenuates neuroinflammation and dopaminergic neurodegeneration in the MPTP model of Parkinson’s disease by activation of adenosine A1 receptor[J]. Br J Pharmacol, 2006, 148(3):314-325.
[10]Fujiwara N, Higashi H, Shimoji K, et al. Effects of hypoxia on rat hippocampal neuronesinvitro[J]. J Physiol, 1987, 384:131-151.
[12]Doolette DJ, Kerr DI. Hyperexcitability in CA1 of the rat hippocampal slice following hypoxia or adenosine[J]. Brain Res, 1995, 677(1):127-137.
[13]Zhao YD, Cheng SY, Ou S, et al. Functional response of hippocampal CA1 pyramidal cells to neonatal hypoxic-ischemic brain damage[J]. Neurosci Lett, 2012, 516(1):5-8.
[14]李 晶,杜永平, 张月萍. 缺氧对谷氨酸能和GABA能突触传递的影响[J]. 中国病理生理杂志,2013, 29 (2):371-375.
[15]Nieber K. Hypoxia and neuronal function underinvitroconditions[J]. Pharmacol Ther, 1999, 82(1):71-86.
Paeoniflorin inhibits functional responses of rat cerebellar Purkinje cells to acute hypoxia insult
REN Ying-ge1, 2, TAN Xiao-li2, CHEN Jing2, ZHANG Jing2, DU Yong-ping1, ZHANG Yue-ping2
(1DepartmentofTraditionalChineseMedicine,2LaboratoryofBrainDevelopment,DepartmentofPediatrics,XijingHospital,TheFourthMilitaryMedicalUniversity,Xi’an710032,China.E-mail:ypzhang@fmmu.edu.cn;ddyypp@fmmu.edu.cn)
AIM: To investigate the effects of paeoniflorin (Pae) on the functional responses induced by acute hypoxic insult in the rat cerebellar Purkinje cells (PCs). METHODS: The whole-cell patch clamp was used for the intracellular recording of PCs in the rat cerebellar slices to evaluate the changes of membrane potential, the excitability of PCs, and the parallel fibre (PF)-PC excitatory postsynaptic currents (EPSCs) upon acute hypoxic insult alone or with the pre-sence of Pae. RESULTS: PCs showed an initial hyperpolarization followed by brief depolarization and long lasting post-hypoxia hyperpolarization after hypoxia exposure. Pae completely blocked hypoxia-induced hyperpolarization and decreased the amplitude and the duration of hypoxic depolarization. Hypoxia up-regulated the excitability of rat PCs. Pae didn’t show any significant effect on the hypoxia-induced hyperexcitability in PCs. Acute hypoxia induced long-term depression (LTD) in rat cerebellar PF-PC EPSCs, and Pae partially reversed hypoxia-induced depression in PF-PC EPSCs. CONCLUSION: Pae significantly suppresses hypoxia-induced responses in rat PCs and probably increases the tolerance of rat PCs to acute hypoxia.
Paeoniflorin; Hypoxia; Purkinje cells; Membrane potential; Synaptic transmission
1000- 4718(2015)04- 0664- 05
2014- 12- 15
2015- 03- 12
国家自然科学基金资助项目(No. 30871029);第四军医大学西京医院助推计划(No. XJZT10T07)
R363; R338.8
A
10.3969/j.issn.1000- 4718.2015.04.016
△通讯作者 张月萍 Tel: 029-84773367; E-mail: ypzhang @fmmu.edu.cn; 杜永平 Tel: 029-84771307; E-mail: ddyypp@fmmu.edu.cn
