RNA干扰FABP5基因对人肝癌HepG2细胞裸鼠移植瘤生长的影响*
2015-04-17周玲丽杨香娣骆成飘唐艳萍
周玲丽, 曹 骥, 李 薇 , 罗 旺 , 杨香娣 , 杨 春, 骆成飘, 唐艳萍, 李 瑗
(1广西壮族自治区肿瘤防治研究所实验研究部, 2广西医科大学研究生学院,广西 南宁 530021)
RNA干扰FABP5基因对人肝癌HepG2细胞裸鼠移植瘤生长的影响*
周玲丽1,2, 曹 骥1△, 李 薇1,2, 罗 旺1,2, 杨香娣1,2, 杨 春1, 骆成飘1, 唐艳萍1, 李 瑗1
(1广西壮族自治区肿瘤防治研究所实验研究部,2广西医科大学研究生学院,广西 南宁 530021)
目的: 研究脂肪酸结合蛋白5(FABP5)基因沉默的慢病毒载体对人肝癌HepG2细胞成瘤效应的影响。方法: 采用RNA干扰技术构建重组逆转录慢病毒载体。HepG2细胞分为3组:实验组以FABP5基因沉默慢病毒颗粒(LV-shRNA-FABP5)感染HepG2细胞;阴性对照组以空载体慢病毒颗粒(LV-shRNA-NC)感染HepG2细胞;空白对照组不做任何处理。将裸鼠随机分为3组,接种肿瘤细胞后观察裸鼠成瘤情况。4周后测量肿瘤的体积和重量,绘制移植瘤生长曲线。Real-time PCR、Western blot及免疫组织化学法检测裸鼠移植瘤中FABP5的表达。结果: LV-shRNA-FABP5可以降低HepG2细胞FABP5的表达。3组裸鼠接种癌细胞后均有肿瘤形成。与空白对照组和阴性对照组相比,实验组肿瘤生长速度明显减慢,且体积及重量明显减小(P<0.05);实验组裸鼠肝癌移植瘤组织的FABP5 mRNA和蛋白表达水平相比空白对照组和阴性对照组表达明显下降(P<0.05)。结论: 沉默FABP5基因表达能有效抑制人肝癌裸鼠移植瘤的生长。FABP5可能成为肝癌基因治疗的一个有效靶点。
RNA干扰; 脂肪酸结合蛋白5; 肝癌; 裸鼠; 移植瘤; 基因治疗
肝细胞癌(hepatocellular carcinoma,HCC)为常见的的恶性肿瘤之一,而且预后差。2007年全世界肝癌的死亡例数达到68 000,在全球的肿瘤死亡原因中位居第三,其中55%以上发生在中国[1]。发现和了解肝癌形成的关键分子对于研究肝癌发生发展机制和实现基因的靶向治疗有着重要的意义。脂肪酸结合蛋白(fatty acid-binding proteins,FABPs)是一组多源性的小分子胞内蛋白质,广泛存在于哺乳动物的小肠、肝脏、脂肪、心脑等多种细胞内,其中表皮相关型又称为FABP5。FABP5与包括肿瘤在内的多种疾病的发生发展密切相关。研究发现细胞表达的FABP5不仅可以转运脂肪酸为细胞生长提供能量及原材料,而且可以结合和转运各种配体,参与肿瘤生长相关的信号转导[2]。本课题组前期应用跨种属肿瘤基因筛选策略,筛选出多种作用于肝癌的关键分子,且通过研究发现在肝癌中FABP5的表达显著上调[3-5]。首先我们采用RNA干扰技术构建了FABP5-shRNA慢病毒载体,沉默HepG2细胞中的FABP5基因,成功验证了其能明显降低FABP5的表达。本研究通过构建裸鼠肝癌移植瘤模型,观察HepG2细胞中FABP5基因沉默后对裸鼠移植瘤生长情况的影响,从而进一步探讨FABP5在肝癌的发生发展中所起的作用。
材 料 和 方 法
1 材料
人肝癌细胞株HepG2和慢病毒购自上海吉凯基因技术有限公司;30只雌性BALB/c裸鼠,4~6 周龄,(16±3)g,购自广西医科大学动物实验中心(许可证号:SCXK桂2009-0002);DMEM、胎牛血清和PBS均购自Hyclone;Trizol试剂购自Invitrogen;逆转录试剂盒购自Fermentas;荧光定量PCR试剂盒购自TaKaRa;Western blot及IP细胞裂解液、苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)、5×SDS蛋白上样缓冲液、BCA蛋白浓度测试试剂盒(增强型)、20×TBS缓冲液等均购自江苏碧云天生物技术研究所;蛋白质预染Marker购自Fermentas;PVDF膜购自Millipore;兔抗人FABP5单克隆抗体购自Abcam;兔抗人β-actin单克隆抗体购自Santa Cruz;免疫组化SP试剂盒和DAB浓缩显色液均购自北京中杉金桥生物技术有限公司。Real-time PCR仪购自Bio-Rad。PCR引物采用Primer 5.0设计,由上海生工生物工程公司合成。
2 方法
2.1 细胞培养 人肝癌细胞株HepG2用含10%胎牛血清,加1×105U/L左氧氟沙星的DMEM培养基,在37 ℃、5% CO2的培养箱中进行培养。取对数生长期的细胞用于实验。
2.2 慢病毒载体转染人肝癌细胞HepG2 转染前12 h取对数生长期的HepG2细胞,胰酶消化后进行细胞计数,将细胞接种于6孔板中,每孔细胞数约为6×105,按MOI=10的条件下,待细胞融合度达20%左右时进行转染,实验组中加入LV-shRNA-FABP5(干扰序列为5’-TGGGAAGGAAAGCACAATA-3’),阴性对照组加入LV-shRNA-NC(干扰序列为5’-TTCTCCGAACGTGTCACGT-3’),每组均设3个重复孔,每孔均加入polybrene及感染增强液,增强病毒的感染力。空白对照组常规培养(control组)。通过预实验确定嘌呤霉素的最终工作浓度为3 mg/L,转染72 h后每孔加入嘌呤霉素筛选稳定转染的细胞,96 h后荧光最强,在荧光显微镜下观察细胞的转染情况。之后使用含0.1 mg/L嘌呤霉素的培养基继续培养细胞,保持病毒整合后的稳定性。
2.3 构建肝癌裸鼠移植瘤模型 按照随机分组的原则将30只雌性裸鼠随机分成3组,分别作为空白对照组、阴性对照组和实验组。胰酶消化处于对数生长期的各组细胞,离心并计数后用血清制成约1×1010/L的细胞悬液,分别接种于3组裸鼠右腋下0.5 cm处,实验组接种转染LV-shRNA-FABP5的HepG2细胞,阴性对照组接种转染LV-shRNA-NC的HepG2细胞,空白对照组接种正常培养的HepG2细胞。裸鼠在SPF级动物房中饲养, 4周后处死,完整剥离肿瘤组织后称瘤体重量并计算肿瘤体积。肿瘤体积 (mm3)=长径×短径2/2。取适当瘤体组织置于-80 ℃冰箱中,用于做real-time PCR及Western blot实验,剩余瘤体组织置于4%多聚甲醛溶液中固定做免疫组织化学实验。
2.4 实时荧光定量PCR检测瘤组织中FABP5 mRNA的表达 Trizol法分别提取3组肿瘤组织总RNA,并逆转录为cDNA,进行PCR扩增反应。FABP5的上游引物为5’-TGAAGGAGCTAGGAGTGGGAA-3’,下游引物为5’-TGCACCATCTGTAAAGTTGCAG-3’;内参照GAPDH的上游引物为5’ -TGACTTCAACAGCGACACCCA-3’,下游引物为5’-CACCCTGTTGCTGTAGCCAAA-3’。反应体系为20 μL,SYBR 10.0 μL,上、下游引物各0.5 μL,cDNA 1 μL,双蒸水8 μL。采用2-ΔΔCt分析法,Ct值为每个反应管内的荧光信号到达设定的域值时所经历的循环。以GAPDH为内参照。
2.5 Western blot检测裸鼠移植瘤中FABP5蛋白的表达 提取各组细胞总蛋白,BCA蛋白定量试剂测定蛋白浓度,-80 ℃保存备用。常规制胶、上样,进行蛋白质电泳;转膜;用TBST配制5%脱脂牛奶封闭1 h,然后FABP5和β-actin I抗4 ℃下孵育过夜(FABP5 的I抗稀释度为1∶200),第2天用TBST洗膜,室温摇床孵育II抗(II抗稀释度均为1∶10 000)1 h,TBST洗膜5 min 3次。采用ECL化学发光法显色,对PVDF膜进行扫描,获取图像。
2.6 免疫组织化学检测肿瘤组织中FABP5蛋白的表达 从裸鼠右腋下取肿瘤组织,用4%多聚甲醛液固定,脱水后石蜡包埋肿瘤组织,连续切片,常规脱蜡处理。实验过程采用SP法,步骤按照试剂盒说明书进行操作。兔抗FABP5单克隆抗体1∶200稀释,DAB显色,苏木素复染。用已知阳性切片作阳性对照,以0.01 mol/L磷酸盐缓冲液(phosphate-buffered saline,PBS)代替 I 抗作为阴性对照。免疫组织化学染色结果判断:FABP5蛋白以细胞核或(和)细胞浆呈黄色颗粒为阳性,综合强度和阳性细胞数量进行判定。(1)按切片中细胞着色深浅评分:0分为细胞无显色;1分为黄色;2分为棕黄色;3分为棕褐色。(2)按阳性细胞率评分:阳性细胞数<5%为0分;5%~25%为1分;26%~50%为2分;51%~75%为3分;>75%为4分。取2项评分的乘积作为总评分:0分为阴性(-);1~4分为弱阳性(+);5~8分为中等强度阳性(++);≥9分为强阳性(+++)。以乘积0~3分为阴性表达,≥4分为阳性表达。其中以阴性(-)和弱阳性(+)记为低表达组,以中阳性(++)和强阳性(+++)记为高表达组。
3 统计学处理
应用SPSS 16.0统计软件进行统计分析,各组计量资料数据以均数±标准差(mean±SD)表示,多组间均数的比较采用单因素方差分析(one-way ANOVA);免疫组化各计数资料的比较采用χ2检验或Fisher精确概率检验;以P<0.05为差异有统计学意义。
结 果
1 慢病毒感染HepG2细胞
在MOI值为10的条件下,实验组和阴性对照组中绿色荧光蛋白(green fluorescent protein,GFP)于72 h开始表达,96 h表达稳定增强。由图可知96 h荧光显微镜下细胞转染的情况,慢病毒感染HepG2细胞的效率>95%,图1。

Figure 1.Human hepatocellular carcinoma HepG2 cells transfected with the recombinant lentivirial vector and GFP expression examined using fluorescence microscopy (×200).
图1 慢病毒感染HepG2细胞
2 动态观察裸鼠移植瘤
大约1周左右,各组裸鼠右腋下均有肉眼可见的肿瘤长出,成瘤率100%。从各组裸鼠成瘤开始,分别在接种第1、2、3、4周测量移植瘤体积,然后绘制生长曲线。4周连续观察3组裸鼠的成瘤体积,结果得出实验组肿瘤生长缓慢且体积明显小于空白对照组和阴性对照组,差异有统计学意义(P<0.05)。各组裸鼠成瘤28 d后,将裸鼠处死并完整剥离皮下肿瘤,测量肿瘤体积和重量,结果见图2、3。各组裸鼠移植瘤生长曲线见图4。空白对照组、阴性对照组和实验组的瘤体平均体积分别为(100.51±47.45)mm3、(104.02±52.89)mm3和(29.41±8.98)mm3,差异有统计学意义(P<0.05),见图5;空白对照组、阴性对照组和实验组的瘤体重量平均分别为(0.632±0.203)g、(0.629±0.226)g和(0.204±0.067)g,差异有统计学意义(P<0.05),见图6。
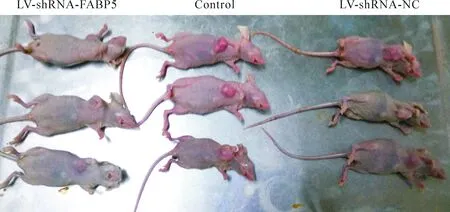
Figure 2.The tumor formation of the nude mice 4 weeks after transplantation of HepG2 cells transfected with different RNAi lentiviral vectors.
图2 4周后各组裸鼠移植瘤大小的比较

Figure 3.The volumes of the transplanted tumors 4 weeks after transplantation of HepG2 cells transfected with different RNAi lentiviral vectors.
图3 4周后各组裸鼠移植瘤大小的比较

Figure 4.The growth curves of the subcutaneously transplanted tumors in the nude mice. Mean±SD.n=10.
图4 裸鼠皮下移植瘤的生长曲线
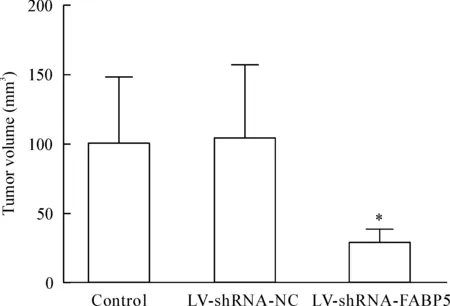
Figure 5.The changes of the tumor volumes in the nude mice 28 d after transplantation. Mean±SD.n=10.*P<0.05vscontrol.
图5 28 d后各组裸鼠移植瘤体积的比较
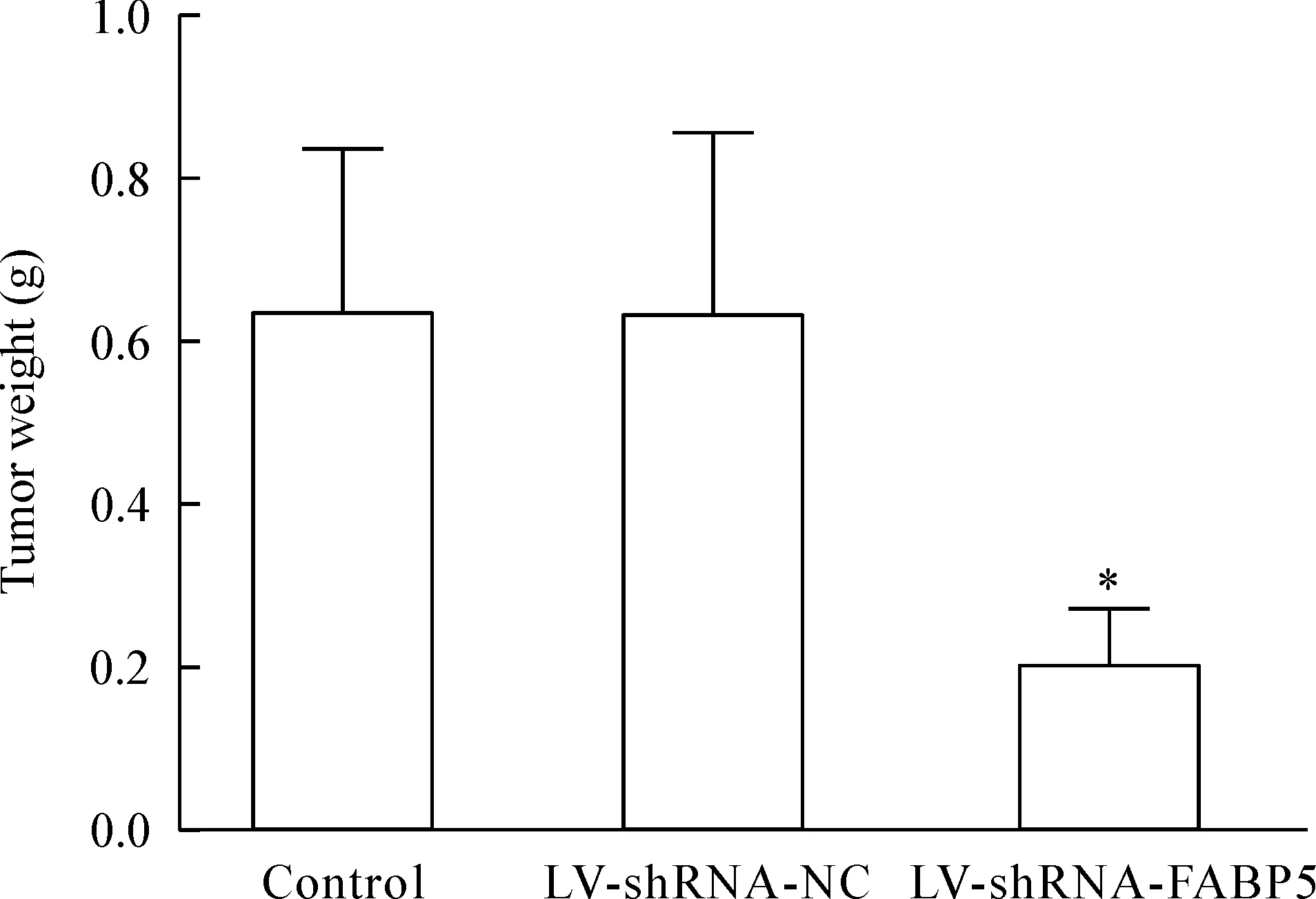
Figure 6.The changes of the tumor weight in the nude mice 28 d after transplantation. Mean±SD.n=10.*P<0.05vscontrol.
图6 28 d后各组裸鼠移植瘤重量的比较
3 Real-time PCR检测各组裸鼠皮下移植瘤中FABP5 mRNA的表达
Real-time PCR结果显示,空白对照组和阴性对照组、实验组瘤组织中FABP5 mRNA的相对表达量分别为1.112±0.107、1.068±0.114和0.145±0.046。实验相比阴性对照组和空白对照组明显下降,差异有统计学意义,阴性对照组和空白对照组比较差异无统计学意义,见图7。
4 Western blot检测各组裸鼠皮下移植瘤组织中FABP5蛋白表达
以β-actin为内参照,实验组分别与空白对照组和阴性对照组相比,FABP5蛋白水平均减少达80%以上,差异有统计学意义(P<0.05);空白对照组和阴性对照组比较差异无统计学意义。该结果提示RNA干扰沉默FABP5基因可显著减少裸鼠移植瘤组织中的FABP5蛋白的表达,见图 8。
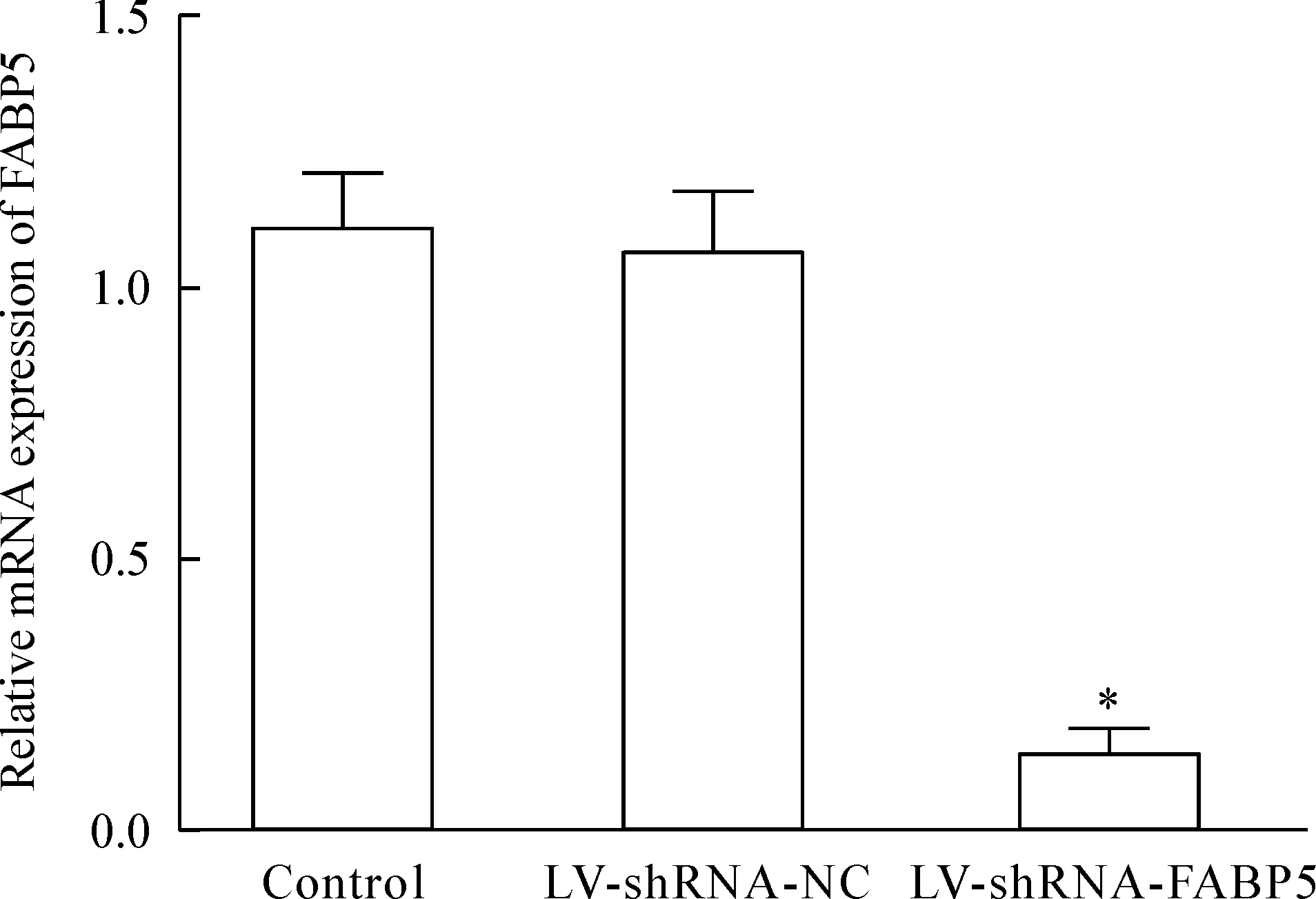
Figure 7.The effects of LV-shRNA-FABP5 on the mRNA expression of FABP5 in the subcutaneous tumor tissues detected by real-time PCR. Mean±SD.n=10.*P<0.05vscontrol.
图7 Real-time PCR检测LV-shRNA-FABP5对裸鼠移植瘤FABP5 mRNA表达的影响
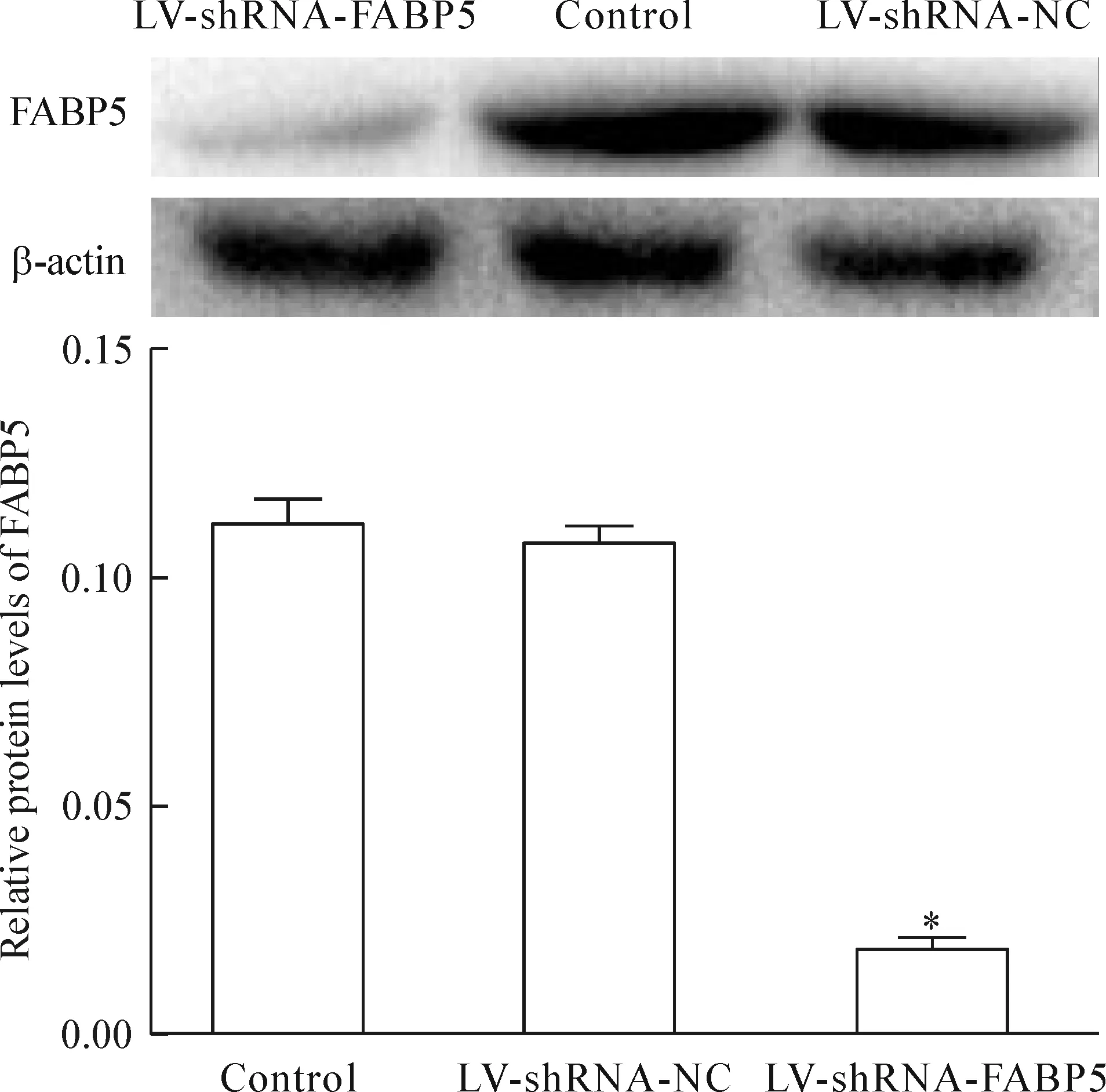
Figure 8.The relative protein levels of FABP5 in the subcutaneous tumor tissues determined by Western blot. Mean±SD.n=10.*P<0.05vscontrol.
图8 FABP-5蛋白在各组移植瘤组织中的相对表达量
5 免疫组织化学法检测移植瘤组织FABP5蛋白表达情况
裸鼠肝癌移植瘤组织表达FABP5阳性信号定位于细胞核和(或)细胞浆中,呈现棕黄色或棕褐色(图9)。实验组中FABP5蛋白的表达明显低于空白对照组和阴性对照组,差异有统计学意义,而空白对照组和阴性对照组相比差异无统计学意义,见表1。这表明实验组FABP5蛋白表达在RNA干扰后显著减少。
讨 论
FABP5是FABPs的家族成员之一,主要来源于表皮细胞,分子量为15 kD,由135个氨基酸组成,其编码基因已被克隆和测序,位于人8号染色体的q21.13区。FABP5主要参与脂肪酸的运输代谢、细胞内信号转导、基因表达等[6]。FABP5作为维甲酸(retinoic acid,RA)的转运蛋白,结合并转运RA,活化过氧化物酶体增殖物激活受体 β/δ(peroxisome proliferator-activated receptor β/δ,PPARβ/δ),进而调节细胞分化、促进细胞增殖和抑制细胞的凋亡[7]。研究发现FABP5与多种肿瘤有关,早在1999年就发现在胰腺癌的耐药细胞株该基因表达上调。此外,在黑色素瘤[8]、肝内胆管细胞癌[9]、子宫内膜癌[10]等肿瘤中FABP5的表达量均增加。Forootan等[11]用前列腺PC-3M细胞接种于裸鼠体内,成瘤后将FABP5小干扰RNA注射到肿瘤周围,结果肿瘤的平均大小比对照组小3倍以上;免疫组织化学和Wes-tern blot提示实验干扰组瘤组织中FABP5蛋白的表达水平低于对照组,推测FABP5水平下调可以抑制前列腺癌的发生。Liu等[12]发现乳腺癌中FABP5表达高的患者预后差,FABP5基因的表达情况是影响乳腺癌患者预后的独立因素。Uma等[13]研究比较舌鳞状细胞癌的原位癌组织和发生淋巴结转移的癌组织,发现有67%的原位癌组织FABP5 mRNA表达量是其转移后的癌组织中表达量的4倍,提示FABP5不但可以促进舌鳞状细胞癌的发生,还参与其转移过程。
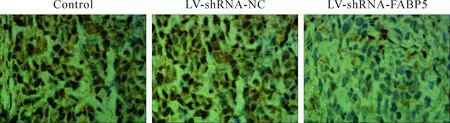
Figure 9.The protein expression of FABP5 in the subcutaneous tumor tissues detected by immunohistochemical staining (×400).
图9 免疫组织化学染色法检测FABP5蛋白在各组移植瘤组织中的表达
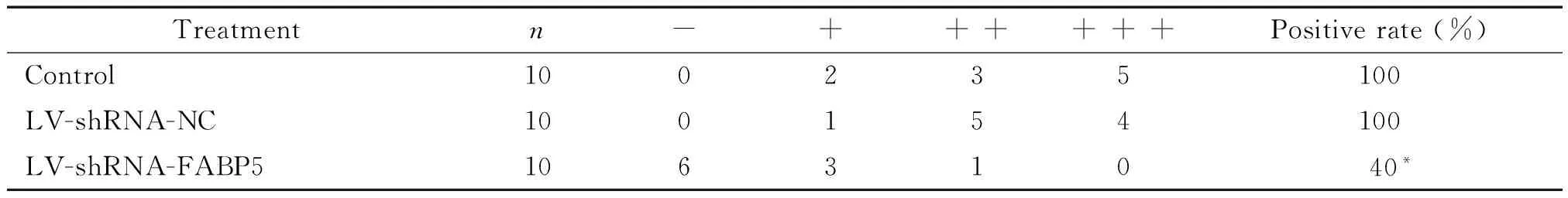
表1 FABP5在各组移植瘤组织中的表达
*P<0.05vscontrol.
本研究构建了人肝癌裸鼠移植瘤模型,将FABP5基因沉默重组慢病毒颗粒(LV-shRNA- FABP5)组、空载体慢病毒颗粒(LV-shRNA-NC)组和空白对照组3组肿瘤细胞培养后分别种植于裸鼠皮下,发现3组接种后均可见成瘤,但实验组的成瘤速度和瘤体积大小明显低于空白对照组和阴性对照组,而空白对照组和阴性对照组比较无明显差异。人肝癌HepG2细胞株异体移植成功率达到100%,说明通过皮下注射成瘤建立的人肝癌裸鼠移植瘤模型是可行的。Real-time PCR和Western blot检测结果中,实验组移植瘤组织中FABP5的mRNA和蛋白表达水平均比其它2组显著降低。免疫组织化学法显示,与空白对照组和阴性对照组相比,实验组移植瘤组织中FABP5蛋白的表达阳性率明显下降。
综上所述,RNA干扰技术沉默人肝癌HepG2细胞中FABP5基因不仅能够明显抑制人肝癌裸鼠移植瘤的生长,而且可以降低瘤组织FABP5的表达水平。因此,FABP5基因有望成为肝癌个性化靶向治疗研究的新方向。
[1] Thun MJ, DeLancey JO, Center MM, et al. The global burden of cancer: priorities for prevention[J]. Carcinogenesis, 2010, 31(1):100-110.
[2] Kitanaka N, Owada Y, Abdelwahab SA, et al. Specific localization of epidermal-type fatty acid binding protein in dendritic cells of splenic white pulp[J]. Histochem Cell Biol, 2003, 120(6):465-473.
[3] 朱伶群,曹 骥,卢晓旭,等. 跨种属研究Smad3在肝癌组织中的表达及意义[J]. 中国病理生理杂志, 2013, 29(1):70-75.
[4] 卢晓旭,曹 骥,李 媛,等. Cdc25a在跨种属肝癌组织中的表达及其意义[J]. 中国病理生理杂志, 2014, 30(5):820-824.
[5] 史俊林,曹 骥,苏建家,等. 表皮型脂肪酸结合蛋白在跨种属肝癌组织中的表达[J]. 中华肝脏病杂志, 2012, 20(4):270-274.
[6] 刁建升,张 曦,郭树忠. 表皮型脂肪酸结合蛋白的研究进展[J]. 国际病理科学与临床杂志, 2009, 29(1):50-53.
[7] Di-Poï N, Tan NS, Michalik L, et al. Antiapoptotic role of PPARβ in keratinocytes via transcriptional control of the Akt1 signaling pathway[J]. Mol Cell, 2002, 10(4):721-733.
[8] Brouard MC, Saurat JH, Ghanem G, et al. Urinary excretion of epidermal-type fatty acid-binding protein and S100A7 protein in patients with cutaneous melanoma[J]. Melanoma Res, 2002, 12(6):627-631.
[9] Jeong CY, Hah YS ,Cho BI, et al. Fatty acid-binding protein 5 promotes cell proliferation and invasion in human intrahepatic cholangiocarcinoma[J]. Oncol Rep, 2012, 28(4):1283-1292.
[10]Li Z, Min W, Huang C, et al. Proteomics-based approach identified differentially expressed proteins with potential roles in endometrial carcinoma[J]. Int J Gynecol Cancer, 2010, 20(1):9-15.
[11]Forootan SS, Bao ZZ, Forootan FS, et al. Atelocollagen-delivered siRNA targeting the FABP5 gene as an experimental therapy for prostate cancer in mouse xenografts[J]. Int J Oncol, 2010, 36(1):69-76.
[12]Liu RZ, Graham K, Glubrecht DD, et al. Association of FABP5 expression with poor survival in triple-negative breast cancer: implication for retinoic acid therapy[J]. Am J Pathol, 2011, 178(3):997-1008.
[13]Uma RS, Naresh KN, D’Cruz AK, et al. Metastasis of squamous cell carcinoma of the oral tongue is associated with down-regulation of epidermal fatty acid binding protein (E-FABP)[J]. Oral Oncol, 2007, 43(1):27-32.
Effects of RNA interference ofFABP5 on subcutaneous tumor of human hepatocellular carcinoma cell line HepG2 transplanted in nude mice
ZHOU Ling-li1, 2, CAO Ji1, LI Wei1, 2, LUO Wang1, 2, YANG Xiang-di1, 2, YANG Chun1, LUO Cheng-piao1, TANG Yan-ping1, LI Yuan1
(1ResearchDepartment,GuangxiCancerInstituteofGuangxiZhuangAutonomousRegion,2GraduateSchoolofGuangxiMedicalUniversity,Nanning530021,China.E-mail:caojicn@163.com)
AIM: To investigate the effect of recombinant lentiviral vector for RNA interference (RNAi) on the expression of fatty acid-binding protein 5 (FABP5) gene in hepatocellular carcinoma HepG2 cells and tumor formation in nude mice. METHODS: RNAi lentiviral vector was used in the experiment. Human hepatocellular carcinoma HepG2 cells were divided into 3 groups: the HepG2 cells in experimental group were transfected with the recombinant lentivirirus vector LV-shRNA-FABP5, the cells in negative control group were transfected with a control lentiviral vector LV-shRNA-NC, and the cells in normal control group were without any treatment. The nude mice were randomly divided into 3 groups. The growth of the transplanted tumor cells in the nude mice was observed. The tumor growth curve, volume and weight were determined 4 weeks after the cell inoculation. The expression of FABP5 was detected by real-time PCR, Western blot and immunohistochemical staining. RESULTS: Transfection of the lentiviral vector FABP5-shRNA obviously reduced FABP5 expression in the HepG2 cells. Tumor formation was all positive in the 3 groups of the nude mice inoculated with the tumor cells. Compared with normal control group and negative control group, the tumor growth slowed significantly in experimental group with smaller volume and weight. FABP5 expression in the transplanted tumor tissues was significantly down-regulated at mRNA and protein levels in experimental group as compared with normal control group and negative control group. CONCLUSION: RNAi-induced down-regulation ofFABP5 effectively inhibits the growth of transplanted hepatocellular carcinoma, suggesting thatFABP5 gene may be an effective target for gene therapy in treating liver cancer.
RNA interference; Fatty acid-binding protein 5; Liver cancer; Nude mice, Neoplasm transplantation; Gene therapy
1000- 4718(2015)04- 0603- 06
2014- 10- 30
2014- 12- 19
国家自然科学基金资助项目(No. 30960428)
R730.23
A
10.3969/j.issn.1000- 4718.2015.04.005
△通讯作者 Tel: 0771-5310593; E-mail: caojicn@163.com
