FK228和雷帕霉素协同促进人乳腺癌细胞凋亡和细胞周期阻滞*
2015-04-17彭晓丹诸梦露高绿芬刘婷婷欧阳媛李若玢刘礼飞刘晓宇郑晓鹤林绍强
彭晓丹, 诸梦露, 高绿芬, 刘婷婷, 刘 艳, 欧阳媛, 李若玢, 刘礼飞, 李 译, 刘晓宇, 郑晓鹤△, 林绍强,△
(1温州医科大学药学院,浙江 温州 325035; 2暨南大学附属第一医院,广东 广州 510632; 3浙江海正药业集团有限公司,浙江 台州 318000)
·论 著·
FK228和雷帕霉素协同促进人乳腺癌细胞凋亡和细胞周期阻滞*
彭晓丹1▲, 诸梦露1▲, 高绿芬2, 刘婷婷1, 刘 艳2, 欧阳媛2, 李若玢2, 刘礼飞3, 李 译3, 刘晓宇3, 郑晓鹤3△, 林绍强1,2△
(1温州医科大学药学院,浙江 温州 325035;2暨南大学附属第一医院,广东 广州 510632;3浙江海正药业集团有限公司,浙江 台州 318000)
目的: 探讨组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitor,HDACi)FK228和哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)特异性抑制剂雷帕霉素(rapamycin,Rapa)联合应用对体外人乳腺癌细胞株生长和凋亡的影响及其可能的分子机制。方法: 以乳腺癌细胞系MDA-MB-435和MCF-7为研究对象,经不同浓度的FK228和雷帕霉素处理后,磺酰罗丹明B(SRB)比色法检测肿瘤细胞的生长抑制率,计算两药的联合指数;Western blotting检测乳腺癌细胞中凋亡相关蛋白、周期调控蛋白以及核酸相关蛋白的表达;流式细胞术检测细胞周期。结果: (1) FK228或雷帕霉素单独使用时均抑制肿瘤细胞生长,抑制率与时间、剂量呈正相关;当总抑制率为50%~70%时联合指数(CI)值小于1,提示两药联合应用具有协同效应;(2) 联合用药后,凋亡蛋白表达较单药使用组明显升高(P<0.05);同时,p-Akt 蛋白表达下降,活化的caspase-3表达上调;(3) 联合用药后,周期调控蛋白表达较单药使用组明显下降(P<0.05),细胞周期阻滞在G2/M期;联合用药后出现更为显著的H2AX的磷酸化和H3的乙酰化(P<0.05)。结论: FK228和雷帕霉素联合给药能协同促进人乳腺癌细胞凋亡和细胞周期阻滞,具有良好的抗肿瘤前景。
FK228; 雷帕霉素; 乳腺癌; 协同作用
乳腺癌是严重危害女性健康的恶性肿瘤,是全世界排名第二的肿瘤疾病,每年有近50万女性患者死于乳腺癌[1]。尽管乳腺癌的诊断和治疗水平有很大的提高,但是乳腺癌的发病率和死亡率仍然相对较高,这就需要我们进行更多的研究,开发更好的治疗方法用于乳腺癌的治疗,提高患者的生存质量和延长患者的生存期[2]。
FK228是从紫色素杆菌发酵产物中分离得到的环四肽类组蛋白去乙酰化酶抑制剂(histone deacetylases inhibitors,HDACi),是新型的抗肿瘤药物[3]。FK228能够选择性杀伤肿瘤细胞,改变细胞染色体结构,导致连接DNA的组蛋白乙酰化,使细胞周期停滞,同时能引起DNA损伤,最终导致细胞凋亡[4]。在体外实验中,FK228单独用药对多种肿瘤细胞如肺癌、肝癌、乳腺癌、卵巢癌、结肠癌、黑色素瘤和前列腺癌细胞等具有很强的杀伤作用。体外研究结果表明,FK228与其它抗肿瘤药物联合,表现出更好的抗肿瘤效应[5-6]。
雷帕霉素(rapamycin, Rapa)是哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)的特异性抑制剂,是番薯链霉菌中提取出来的大环内酯类免疫抑制剂[7]。在动物实验及临床应用中发现,雷帕霉素是一种疗效好,低毒,无肾毒性的新型免疫抑制剂并有抗肿瘤作用[8-9]。在乳腺癌治疗中,mTOR抑制剂结合激素治疗表现出显著的治疗效果[10]。mTOR信号通路PI3K-AKT-mTOR与肿瘤的发生、发展密切相关。Kumar等[11]研究发现,PI3K能够维持DNA稳定性以及修复DNA损伤。
FK228和雷帕霉素在影响DNA和调控细胞周期蛋白方面具有不同的抗肿瘤机制,由此我们推测两者可能在抗肿瘤作用上具有协同作用。本文就FK228和雷帕霉素对乳腺癌细胞的作用进行了体外研究,并探究这2种药物的协同作用,为临床联合用药治疗乳腺癌提供了一定的理论依据。
材 料 和 方 法
1 主要试剂
乳腺癌MDA-MB-435及MCF-7细胞株购自ATCC;DMEM培养基、L15培养基、胰蛋白酶及胎牛血清(fetal bovine serum, FBS)购自Gibco;磺基罗丹明B钠盐、二甲基亚砜(dimethyl sulfoxide, DMSO)、碘化丙啶(pyridine iodide, PI)、雷帕霉素购自Sigma;FK228由浙江海正药业股份有限公司王继栋博士馈赠;caspase-3 活性检测试剂盒购自碧云天;Bcl-2 抗体、Akt抗体、p-Akt抗体、cyclin D1抗体、cyclin E抗体、β-actin 抗体和鼠Ⅱ抗、兔Ⅱ抗均购自Santa Cruz;anti-acetyl-histone H3、anti-phospho-histone H2AX购自Millipore;cleaved-PARP购自Cell Signaling。
2 主要仪器
DL-CJ-1N医用超净工作台;Olympus CK40倒置相差显微镜;Model550酶标仪(Bio-Rad);流式细胞仪(BD);曝光仪(Bio-Rad)。
3 方法
3.1 细胞培养 乳腺癌细胞株MDA-MB-435用含10% FBS的L15培养基、MCF-7用含10% FBS的DMEM培养基,在5% CO2、37 ℃、饱和湿度条件下培养,细胞呈贴壁生长。
3.2 磺酰罗丹明B(sulforhodamine B, SRB)比色法 MDA-MB-435、MCF-7以每孔5×103个细胞接种于96 孔板中,常规培养24 h。实验分为4组:FK228组、雷帕霉素组、联合组、正常对照组(药物溶剂对照)。FK228组药物浓度以100 nmol/L为最高浓度,4倍梯度稀释,设5个浓度;雷帕霉素组药物浓度以1 800 nmol/L为最高浓度,2倍梯度稀释,设5个浓度;联合组为单独给药组的药物联合。各组各浓度分别设3个复孔,实验重复3次。药物作用24 h、48 h、72 h后分别用SRB法检测细胞抑制率,采用联合指数( combination index,CI)表示。抑制率按公式:细胞的增殖抑制率(%)=[对照组A值-实验组A值]/对照组A值×100%。CI值的计算参见参考文献[12-13]。
3.3 流式细胞仪测定细胞周期 MDA-MB-435、MCF-7以每孔4×105个细胞接种于6孔板中,常规培养24 h。实验分4组:FK228组、雷帕霉素组、联合组、正常对照组(药物溶剂对照),培养24 h后,用冷PBS 洗涤2 次,收集各组处理后的细胞,用冰预冷的75% 乙醇固定,PBS 洗涤、离心,加入含有0.1% RNaseA 的PBS 于37℃水浴1 h后用含10 mg /L PI的PBS染色至少20 min后,流式细胞仪检测细胞周期。
3.4 Western blotting检测细胞相关蛋白表达 MDA-MB-435、MCF-7以每孔4×105个细胞接种于6孔板中,常规培养24 h。实验分4组:FK228组、雷帕霉素组、联合组、正常对照组(药物溶剂对照),继续培养48 h。细胞裂解液裂解细胞提取蛋白,用12% SDS-PAGE进行蛋白分离,将蛋白质转移至聚偏二氟乙烯(polyvinylidene difluoride, PVDF)膜,用5%脱脂奶粉封闭后,加入Ⅰ抗,4℃孵育过夜,TBST 洗涤,再加对应的Ⅱ抗,孵育1 h,TBST 洗涤。加入ECL显影液,用凝胶成像仪进行拍照记录。
3.5 Caspase-3活性检测 MDA-MB-435、MCF-7以每孔4×105个细胞接种于6孔板中,常规培养24 h。实验分4组:FK228组、雷帕霉素组、联合组、正常对照组(药物溶剂对照),培养48 h 后,收集细胞,加入裂解液在冰上裂解细胞10 min。按照试剂盒操作说明加入各反应体系,37℃孵化2 h,在405 nm处测定吸光度。
4 统计学处理
实验数据用均数±标准差( mean±SD)表示。采用SPSS 11.5统计软件进行统计学分析,组间数据比较采用单因素方差分析( one-way ANOVA)。以P<0.05为差异有统计学意义。
结 果
1 单独应用FK228与雷帕霉素和联合应用两药对乳腺癌细胞生长的影响
FK228在较低浓度就具有较强的杀伤作用,浓度增加,抑制率逐渐增强,并且联合给药组抑制率大于单独给药组(P<0.05)。FK228、雷帕霉素对乳腺癌细胞MDA-MB-435、MCF-7体外的抑制作用随时间推移抑制率增加,见图1。
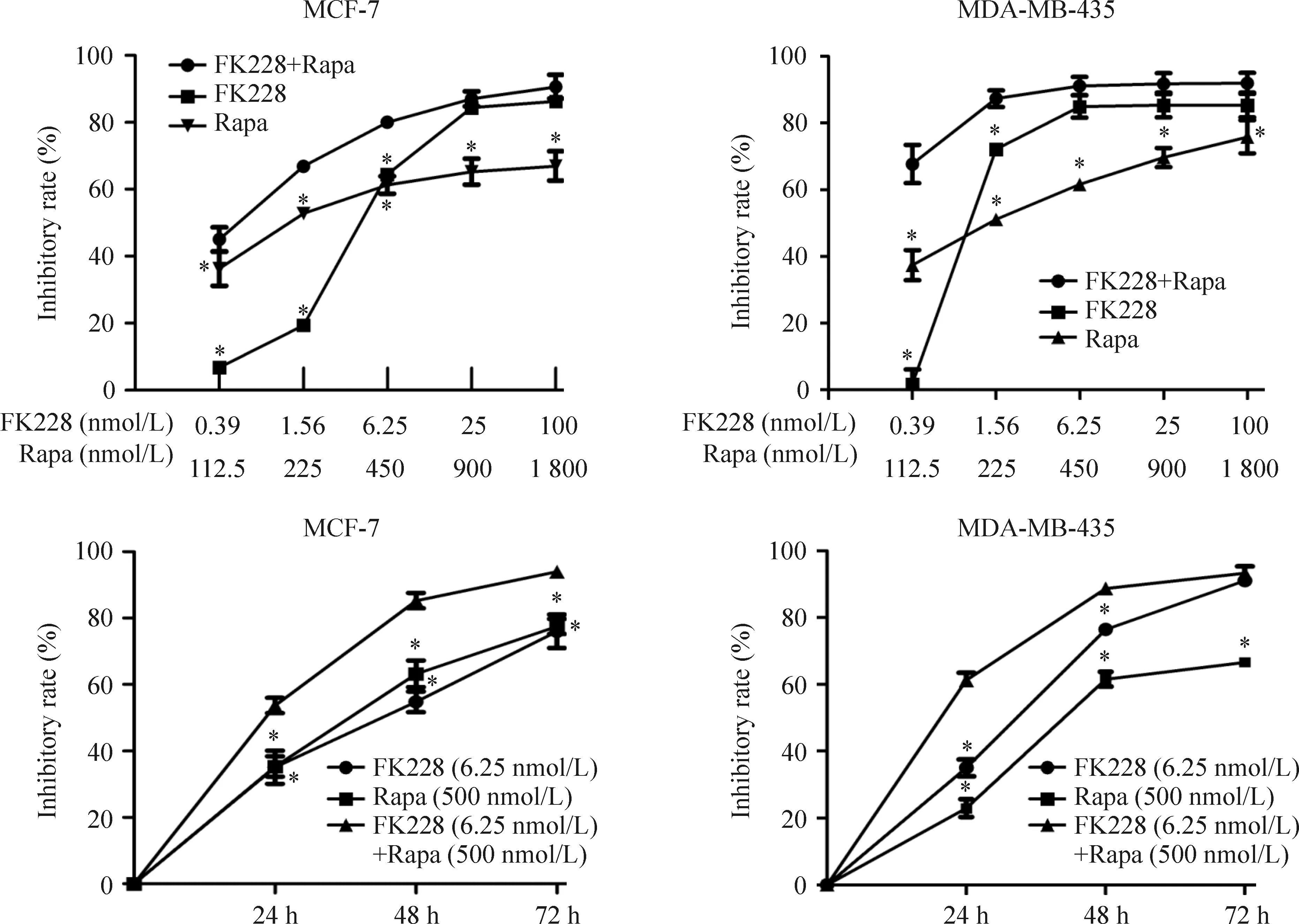
Figure 1.The inhibitory rate of MCF-7 and MDA-MB-435 treated with FK228,Rapa and FK228 combined with Rapa. Mean±SD.n=3.*P<0.05vsFk228+Papa.
图1 FK228、雷帕霉素以及两者联合用药后MCF-7和MDA-MB-435细胞的抑制率
2 FK228与雷帕霉素合用的CI值
CI=(D)A/(Dx)A+(D)B/(Dx)B+(D)A×(D)B/[(Dx)A×(Dx)B]。其中(D) A 为药物A在联合应用A、B两药产生效应x时A药的浓度;(D) B为药物B在联合应用A、B两药产生效应x时B药的浓度;(Dx) A 为药物A单独产生效应x时A药的浓度;(Dx) B为药物B单独产生效应x时B药的浓度。CI值大于1时两药拮抗,小于1时协同。本实验中,在总抑制率为50%~70%时的CI值小于1,协同效应显著,由此显示FK228与雷帕霉素的协同作用明显,见图2。

Figure 2.The CI of MCF-7 and MDA-MB-435 for the drug treatments at 30% effective dose(ED30), ED50 and ED70. Mean±SD.n=3.
图2 在ED30、ED50和ED70时MCF-7和MDA-MB-435细胞的CI值
3 FK228和雷帕霉素联合给药促进乳腺癌细胞凋亡
蛋白水平检测显示,与对照组相比,MCF-7和MDA-MB-435细胞中FK228和雷帕霉素单独作用时诱导促凋亡蛋白cleaved-PARP表达增多,caspase-3活性升高,抗凋亡蛋白Bcl-2表达减少,下游通路中Akt的磷酸化水平降低,联合用药时较单独用药更为显著,见图3。
4 FK228和雷帕霉素联合给药使乳腺癌细胞周期调控蛋白改变
蛋白水平检测显示,与对照组相比,MCF-7和MDA-MB-435细胞中FK228和雷帕霉素单独作用时调控细胞周期蛋白cyclin A和cyclin D1有所降低,联合用药时较单独用药更为明显,见图4。流式结果显示在MCF-7细胞中当FK228单独作用时出现了G2/M期的上升,而雷帕霉素单独作用时并无G2/M期的上升,联合用药后G2/M期的上升较单独用药更为明显,在MDA-MB-435细胞中FK228和雷帕霉素单独作用时均出现了G2/M期的上升,联合用药后G2/M期的上升较单独用药更为明显,见图5、表1。综上所述,FK228和雷帕霉素联合给药后乳腺癌细胞出现更加显著的G2/M期阻滞。
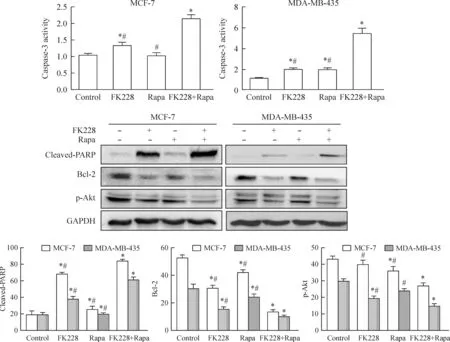
Figure 3.The effect of FK228(2 nmol/L) or/and Rapa(500 nmol/L) on the expression of cleaved-PARP, Bcl-2, p-Akt and caspase-3 activity in MCF-7 and MDA-MB-435 cells. Mean±SD.n=3.*P<0.05vscontrol;#P<0.05vsFK228+Rapa.
图3 FK228、雷帕霉素以及两者联合用药后MCF-7和MDA-MB-435细胞凋亡蛋白的表达
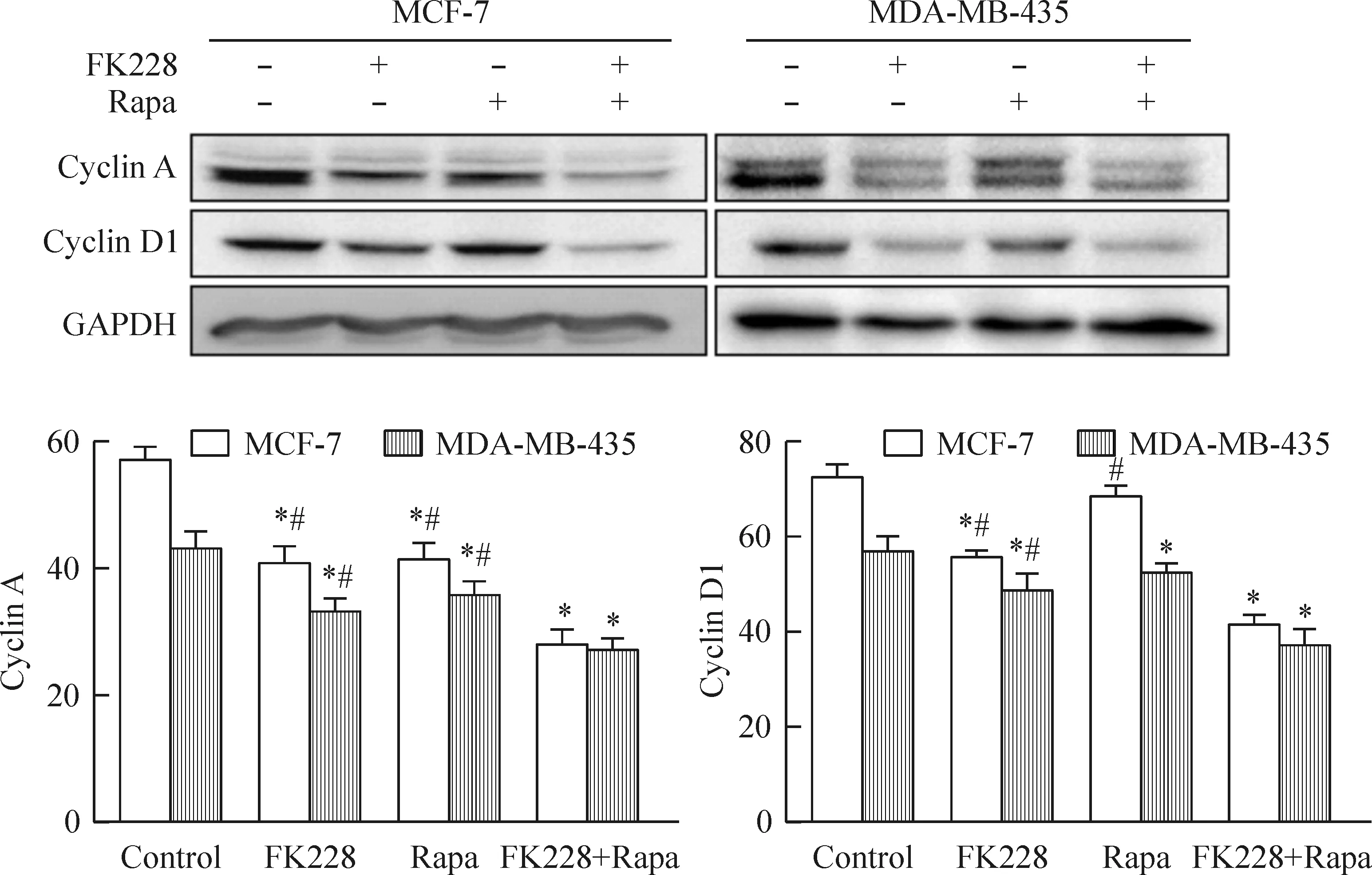
Figure 4.The expression of cyclical proteins in MCF-7 and MDA-MB-435 cells treated with FK228(2 nmol/L), Rapa(500 nmol/L)and FK228 combined with Rapa using Western blotting. Mean±SD.n=3.*P<0.05vscontrol;#P<0.05vsFK228+Rapa.
图4 MCF-7和MDA-MB-435细胞在FK228、雷帕霉素以及两者联合用药后周期蛋白的表达
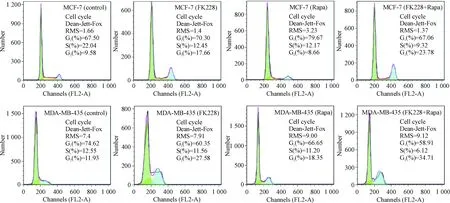
Figure 5.The detection of cell cycle in MCF-7 and MDA-MB-435 cells treated with FK228(2 nmol/L),Rapa(500 nmol/L)and FK228 combined with Rapa using flow cytometry.
图5 MCF-7和MDA-MB-435细胞在FK228、雷帕霉素以及两者联合用药后的流式周期分析
5 FK228和雷帕霉素联合给药促进DNA损伤
H2AX蛋白的磷酸化和H3的乙酰化会导致DNA损伤。与对照组相比,MCF-7和MDA-MB-435细胞中FK228单独作用时出现H2AX的磷酸化和H3的乙酰化,雷帕霉素单独作用时没有明显H2AX的磷酸化和H3的乙酰化,但两者联合用药后出现更为显著的H2AX的磷酸化和H3的乙酰化。由此说明FK228和雷帕霉素联合给药后能更显著地促进DNA损伤的产生,见图6。
表1 MCF-7和MDA-MB-435细胞在FK228、雷帕霉素以及两者联合用药后的流式周期分析
Table 1.The detection of cell cycle in MCF-7 and MDA-MB-435 cells treated with FK228 (2 nmol/L), Rapa (500 nmol/L) and FK228 combined with Rapa using flow cytometry (%. Mean±SD.n=3)
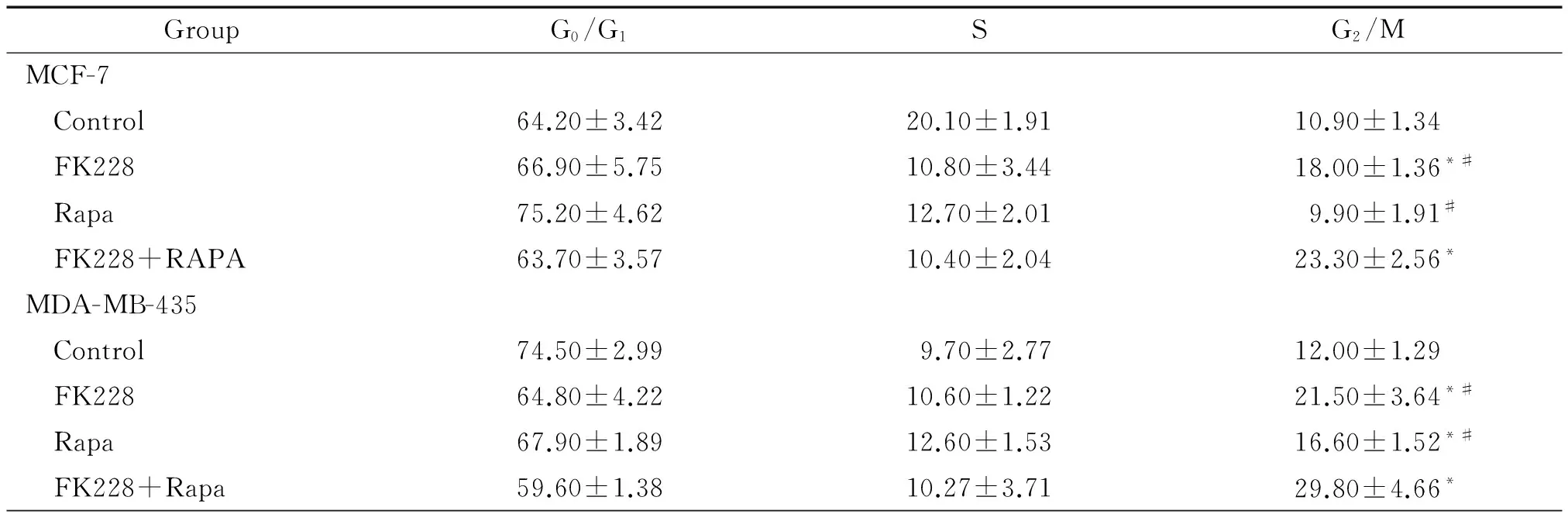
GroupG0/G1SG2/MMCF-7 Control64.20±3.4220.10±1.9110.90±1.34 FK22866.90±5.7510.80±3.4418.00±1.36*# Rapa75.20±4.6212.70±2.019.90±1.91# FK228+RAPA63.70±3.5710.40±2.0423.30±2.56*MDA-MB-435 Control74.50±2.999.70±2.7712.00±1.29 FK22864.80±4.2210.60±1.2221.50±3.64*# Rapa67.90±1.8912.60±1.5316.60±1.52*# FK228+Rapa59.60±1.3810.27±3.7129.80±4.66*
*P<0.05vscontrol;#P<0.05vsFK228+Rapa.
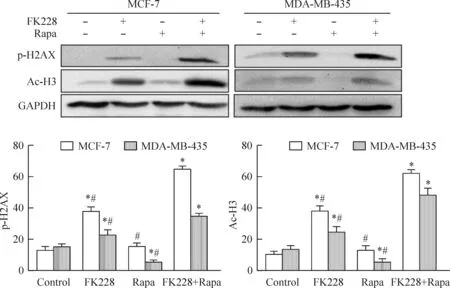
Figure 6.The expression of DNA repair proteins in MCF-7 and MDA-MB-435 cells treated with FK228 (2 nmol/L), Rapa (500 nmol/L) and FK228 combined with Rapa. Mean±SD.n=3.*P<0.05vscontrol;#P<0.05vsFK228+Rapa.
图6 MCF-7和MDA-MB-435细胞在FK228、雷帕霉素以及两者联合用药后DNA蛋白水平的表达
讨 论
实验证明,FK228联合雷帕霉素能协同杀伤人乳腺癌细胞(MDA-MB-435、MCF-7)。FK228在其单独用药或与雷帕霉素联合用药均具有很强的抑制肿瘤细胞生长作用,并呈时间、剂量依赖性;同时,FK228联合雷帕霉素增强p-H2AX和ac-H3等一些DNA损伤修复蛋白的表达。p-H2AX能在早期反应DNA双链的损伤,随着DNA损伤的严重程度,p-H2AX呈线性增加,其中H2AX丝氨酸139以其独特的羰基末端结构能在1~3 min左右对DNA损伤作出应答[14]。p-H2AX的持续激活,说明真核细胞受到药物或者外界刺激,其双链DNA开始受到损伤,并导致细胞凋亡[15]。FK228作用于DNA组蛋白,使其乙酰化,影响正常的转录[16],引起DNA损伤。从实验结果显示,在FK228与雷帕霉素联合作用后,pH2AX的激活较单独用药更加显著,说明FK228和雷帕霉素联合用药在一定程度上增强了DNA损伤介导的细胞凋亡。雷帕霉素是mTOR特异性抑制剂,其抑制肿瘤细胞生长的机制主要为影响因子的受体-PI3K-PTEN-Akt- mTOR(Raptor) 通路[17-18],PI3K、PTEN以及Akt 与DNA损伤修复有关[19]。在实验结果中,FK228与雷帕霉素联合作用后,Akt磷酸化水平明显降低,而两者单独用药时没有表现出明显磷酸化水平改变。在乳腺癌细胞或者其它肿瘤细胞中,p-Akt水平变化可以作为雷帕霉素及其衍生物作用效果的重要标记[20]。因此我们推测,FK228与雷帕霉素可能协同影响Akt上游通路,共同诱导影响Akt的磷酸化,影响DNA损伤修复,抑制肿瘤细胞增殖,促进细胞凋亡。
在许多肿瘤细胞中,HDACi包括FK228能下调细胞周期调控基因p21的表达,并且阻断细胞周期蛋白/CDK的表达,导致细胞周期阻滞,抑制细胞生长[21]。雷帕霉素及其衍生物能特异性地结合到mTOR,抑制细胞周期过程中特异性mRNA的转录,阻断细胞从G1进入到S期,从而影响细胞代谢,导致细胞周期阻滞于G2/M期,最终诱发凋亡[22]。流式结果中发现,FK228和雷帕霉素在单独用药时,均出现不同程度的G2/M期阻滞,联合用药时表现出更显著的周期阻滞。在周期相关蛋白检测中发现两者联合给药后,出现了明显的周期相关蛋白Cyclin A、Cyclin D1的表达下调。在我们研究中发现,FK228与雷帕霉素的协同作用中主要以FK228的作用为主,雷帕霉素单用没有显著的周期阻滞作用,这可能与选择的用药剂量有关。
本研究中, FK228与雷帕霉素联合作用后诱导促凋亡蛋白cleaved-PARP剪切增多,同时caspase-3 表达上升,抗凋亡蛋白Bcl-2表达减少,这些信号通路的增强或减弱都促进了肿瘤细胞凋亡,说明两者联合用药后其杀伤肿瘤细胞作用更加显著。
FK228以及雷帕霉素这两个特异性抑制剂是目前具有研究前景的抗癌药物,尤其是针对非实体瘤。FK228作为孤儿药,用于治疗皮肤T细胞淋巴瘤于2009年11月获得FDA批准上市,2011年FK228治疗外周T细胞淋巴瘤也获得批准[15]。mTOR抑制剂雷帕霉素在临床器官移植患者中广泛使用,有较好的临床用药经验[23],同时mTOR信号通路的异常失调也可能与肿瘤或者人类其它疾病相关[24]。最近研究发现, 雷帕霉素及其衍生物CCI-779[25]、RAD001[26]和AP-23573[27]对包括乳腺癌在内的多种肿瘤细胞具有广泛的抗肿瘤作用。但是,由于FK228和雷帕霉素的信号通路及其作用机制的复杂性,它们在治疗乳腺癌中的进展受到一定程度的限制。在本次研究中,FK228和雷帕霉素联合用药对于乳腺癌细胞起到更加显著的抑制效果,它们的抑制肿瘤细胞生长作用比单独使用其中任何一种治疗效果要强。雷帕霉素还可以提高细胞毒素剂的效果。我们的研究成果提供了它们在体外实验联合用药的依据。
[1] Bhatelia K, Singh K, Singh R. TLRs: Linking inflammation and breast cancer[J]. Cell Signal, 2014, 6 (11): 2350-2357.
[2] Zhang BN, Cao XC, Chen JY, et al. Guidelines on the diagnosis and treatment of breast cancer [J]. Gland Surg, 2012, 1 (1):39-61.
[3] Furumai R, Matsuyama A, Kobashi N, et al. FK228 (depsipeptide) as a natural prodrug that inhibits class I histone deacetylases[J]. Cancer Research, 2002, 62 (17):4916-4921.
[4] Kim JH, Bae SC. Histone deacetylase inhibitors: molecular mechanisms of action and clinical trials as anti-cancer drugs[J]. Am J Transl Res, 2011, 3 (2):166-179.
[5] Wilson AJ, Lalani AS, Wass E, et al. Romidepsin(FK228) combined with cisplatin stimulates DNA damage-induce cell death in ovarian cancer[J]. Gynecol Oncol, 2012, 127(3): 579-586.
[6] Adachi M, Zhang Y, Zhao X, et al. Synergistic effect of histone deacetylase inhibitors FK228 and m-carboxycinnamic acid bis-hydroxamide with proteasome inhibitors PSI and PS-341 against gastrointestinal adenocarcinoma cells[J]. Clin Cancer Res, 2004, 10(11):3853-3862.
[7] Stephan S, Datta K, Wang E, et al. Effect of rapamycin alone and in combination with anti-angiogenesis therapy in an orthotopic model of human pancreatic cancer[J]. Clin Cancer Res, 2004, 10(20):6993-7000.
[8] Shen Y, Wang X, Xia W, et al. Antiproliferative and overadditive effects of rapamycin and FTY720 in pancreatic cancer cellsinvitro[J]. Transplant Proc, 2008, 40(5):1727-1733.
[9] 金 柱, 高安宝. 雷帕霉素对顺铂作用下人肺腺癌A549 及耐药A549 /DDP 细胞增殖、侵袭、黏附及自噬凋亡的影响[J]. 中国病理生理杂志, 2014, 30(12):2120-2127.
[10]Paplomata E, O’Regan R. The PI3K/AKT/mTOR pathway in breast cancer: targets, trials and biomarkers[J]. Ther Adv Med Oncol, 2014, 6(4):154-166.
[11]Kumar A, Fernandez-Capetillo O, Carrera AC. Nuclear phosphoinositide 3-kinase beta controls double-strand break DNA repair[J]. Proc Natl Acad Sci U S A, 2010, 107(16):7491-7496.
[12]Chou TC. Theoretical basis, experimental design, and computerized simulation of synergism and antagonism in drug combination studies[J]. Pharmacological Review, 2006, 58(3):621-681.
[13]许成芳, 李小毛, 李 田, 等. 雷帕霉素增强子宫内膜癌细胞对阿霉素的敏感性[J]. 中国病理生理杂志, 2011, 27(11):2090-2095.
[14]Paull TT, Rogakou EP, Yamazaki V, et al. A critical role for histone H2AX in recruitment of repair factors to nuclear foci after DNA damage[J]. Curr Biol, 2000, 10(15):886-895.
[16]Thaler F, Mercurio C. Towards selective inhibition of histone deacetylase isoforms: what has been achieved, where we are and what will be next[J]. Chem Med Chem, 2014, 9(3):523-526.
[17]Shi YH, Fan J, Zhou J, et al. The study of the role PI3K/Akt/mTOR signaling pathways in the autophagy of liver cancer [J]. Chin J Digest Surg, 2007, 6(1):39-43.
[18]Liu P, Cheng H, Roberts TM,et al. Targeting the phosphoinsitide 3-kinase pathway in cancer[J]. Nat Rev Drug Discov, 2009, 8 (8):627-644.
[19]Kao GD, Jiang Z, Fernandes AM,et al. Inhibition of phosphatidylinositol-3-OH kinase/Akt signaling impairs DNA repair in glioblastoma cells following ionizing radiation[J]. J Biol Chem, 2007, 282(29):21206-21212.
[20]Meric-Bernstam F, Akcakanat A, Chen H, et al. PIK3CA/PTEN mutations and AKT activation as markers of sensitivity to allosteric mTOR inhibitors[J]. Clin Can-cer Res, 2012, 18(6): 1777-1789.
[21]Sandor V, Senderowicz A, Mertins S, et al. P21-depen-dent G1arrest with downregulation of cyclin D1 and upre-gulation of cyclin E by the histone deacetylase inhibitor FR901228[J]. Br J Cancer,2000, 83(6):817-825.
[22]Huang S, Houghton PJ. Inhibitors of mammalian target of rapamycin as novel antitumor agent: from bench to clinic [J]. Curr Opin Investig Drugs, 2002, 3(2):295-304.
[23]Shihab F, Christians U, Smith L, et al. Focus on mTOR inhibitors and tacrolimus in renal transplantation: Pharmacokinetics, exposure-response relationships, and clinical outcomes[J]. Transpl Immunol, 2014, 31(1):22-32.
[24]Watanabe R, Wei L, Huang J. mTOR signaling, function, novel inhibitors, and therapeutic targets[J]. J Nucl Med, 2011, 52(4):497-500.
[25]Chan S, Scheulen ME, Johnston S, et al. Phase II study of temsirolimus (CCI-779), a novel inhibitor of mTOR, in heavily pretreated patients with locally advanced or metastatic breast cancer[J]. J Clin Oncol, 2005, 23(23):5314-5322.
[26]Yee KW, Zeng Z, Konopleva M, et al. Phase I/II study of the mammalian target of rapamycin inhibitor everolimus (RAD001) in patients with relapsed or refractory hematologic malignancies[J]. Clin Cancer Res, 2006, 12(17):5165-5173.
[27]Nemunaitis J, Hochster HS, Lustgarten S, et al. A phase I trial of oral ridaforolimus (AP23573; MK-8669) in combination with bevacizumab for patients with advanced can-cers[J]. Clin Oncol (R Coll Radiol), 2013, 25(6):336-342.
Combination therapy of FK228 with rapamycin synergistically promotes human breast cancer cell apoptosis by DNA damage and cell cycle arrest
PENG Xiao-dan1, ZHU Meng-lu1, GAO Lü-fen2, LIU Ting-ting1, LIU Yan2, OU-YANG Yuan2, LI Ruo-fen2, LIU Li-fei3, LI Yi3, LIU Xiao-yu3, ZHENG Xiao-he3, LIN Shao-qiang1, 2
(1WenzhouMedicalUniversity,Wenzhou325035,China;2TheFirstAffiliatedHospitalofJinanUniversity,Guangzhou510632,China;3ZhejiangHisunPharmaceuticalCompany,Taizhou318000,China.E-mail:tlshq@jnu.edu.cn;zhengxh@hisunpharm.com)
AIM: To investigate the depressant effect of FK228 combined with rapamycin on the human breast cancer cell line MCF-7 and MDA-MB-435. METHODS: FK228, a new histone deacetylase inhibitor, and rapamycin, the specific inhibitor of the mammalian target of rapamycin (mTOR) protein, were used in the study. MCF-7 cells and MDA-MB-435 cells were exposed to different concentrations of FK228 and rapamycin. The inhibitory rate of cell growth was determined by SRB assay. Combination index (CI) was used to evaluate the interaction between FK228 and rapamycin. The expression of the apoptotic proteins, cycle proteins and nucleic acid proteins were detected by Western blotting. The cell cycle was analyzed by flow cytometry. RESULTS: Both FK228 and rapamycin showed growth inhibitory effects on the breast cancer cell lines in a time- and dose-dependent manner. CI of the 2 drugs was less than 1 when the inhibitory rate of the cell growth was 50% effective dose (ED50)~ED70, indicating a synergistic effect. The combination therapy of FK228 with rapamycin increased the apoptotic proteins, and induced the down-regulation of phosphorylated Akt and over-expression of caspase-3 compared with a single use of the drugs. The combination therapy of FK228 with rapamycin reduced the cycle proteins, and the cell cycle was arrested in G2/M. The levels of phosphorylated H2AX and acetylated H3 were ob-viously increased after combination therapy. CONCLUSION: The combination therapy of FK228 with rapamycin inhibits the cell proliferation and increases apoptosis with a synergistic effect, which may become a new trend for treating endometrial cancer.
FK228; Rapamycin; Breast cancer; Synergistic effect
1000- 4718(2015)04- 0577- 08
2014- 12- 26
2015- 01- 27
国家自然科学基金资助项目(No. 81071751; No. 81172074);暨南大学附属第一医院科研启动基金(2012)资助项目(No.11614103)
R730.23
A
10.3969/j.issn.1000- 4718.2015.04.001
△通讯作者 林绍强 Tel: 020-38688511; E-mail:tlshq@jnu.edu.cn; 郑晓鹤 Tel: 0576-88828271; E-mail:zhengxh@hisunpharm.com
▲并列第1作者
