bFGF在恶性肿瘤中的表达及其临床病理意义*
2015-04-17赵建夫赵凤芝胡鹏辉向军俭
赵建夫, 徐 萌△, 赵凤芝, 胡鹏辉, 全 强, 向军俭, 王 宏
(暨南大学 1附属第一医院肿瘤科, 2生命科学抗体工程研究中心, 广东 广州 510632)
bFGF在恶性肿瘤中的表达及其临床病理意义*
赵建夫1, 徐 萌1△, 赵凤芝1, 胡鹏辉1, 全 强1, 向军俭2, 王 宏2
(暨南大学1附属第一医院肿瘤科,2生命科学抗体工程研究中心, 广东 广州 510632)
目的: 检测临床常见恶性肿瘤(非小细胞肺癌、乳腺癌、结肠癌和黑色素瘤)组织中碱性成纤维细胞生长因子(bFGF)的表达情况,并分析其与恶性肿瘤临床病理学特征之间的相关性。方法: 采用免疫组织化学SP技术检测208例原发性恶性肿瘤(肺癌68例,乳腺癌80例,结肠癌41例和黑色素瘤19例)石蜡包埋组织中bFGF蛋白的表达水平。结果: 在肺癌中bFGF蛋白高表达多见于伴有淋巴结转移的低分化患者,与肿瘤原发灶大小、淋巴结受累、远处转移(TNM)分期呈正相关,且bFGF的表达对患者中位生存期无明显影响;在乳腺癌中,bFGF高表达多见于伴淋巴结转移的晚期患者;在结肠癌中bFGF蛋白表达多见于伴有区域淋巴结转移的中高分化患者;此外,在晚期有淋巴结转移的黑色素瘤患者中,bFGF蛋白呈高表达。 结论: bFGF可能参与了临床常见恶性肿瘤的发生和演变过程,bFGF蛋白表达可能成为判断恶性肿瘤是否发生转移的有效参考指标之一。
恶性肿瘤; 碱性成纤维细胞生长因子; 临床病理特征
现代分子生物学研究表明,碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)过度表达与肿瘤发生、发展及预后有密切关系[1]。bFGF是一种来源于中胚层及神经外胚层细胞增殖的多肽生长因子[2],其最显著的生物功能是促进细胞增殖分裂,而在病理情况下它参与肿瘤的发生发展、促进损伤组织修复。肿瘤组织中bFGF及其受体表达成为抗肿瘤治疗的潜在靶标[3],靶向抗bFGF抗体、成纤维细胞生长因子受体(fibroblast growth factor receptor, FGFR)拮抗剂可抑制肿瘤细胞增殖、转移,阻断肿瘤生长所需的营养和转移途径。近年来,有关于bFGF在肿瘤细胞中表达的报道,但其研究较为分散,样本量小,肿瘤种类单一,因此本实验旨在研究临床常见恶性肿瘤如非小细胞肺癌(non-small-cell lung cancer, NSCLC)、乳腺癌、结肠癌和黑色素瘤组织中bFGF蛋白的表达情况,并进一步阐明bFGF蛋白表达率与肿瘤临床病理特征之间的关系,为bFGF单抗在临床肿瘤分子靶向治疗中的应用提供依据。
材 料 和 方 法
1 材料
1.1 标本收集 所用非小细胞肺癌、乳腺癌、结肠癌和黑色素瘤组织标本来源于2010年9月~2014年4月暨南大学附属第一医院外科手术病例,均经暨南大学附属第一医院病理科确诊,术前均未接受放化疗。非小细胞肺癌中男性42例,女性26例;鳞状细胞癌38例,腺癌30例,其中中高分化29例,低分化39例;根据2002年国际抗癌联盟TNM分期: Ⅰ~Ⅱ期32例,Ⅲ~Ⅳ期36例;无淋巴结转移者17例,有淋巴结转移者51例。乳腺癌患者共80例,男性42例,女性38例;导管癌51例,其它29例,其中Ⅰ~Ⅱ期48例,Ⅲ~Ⅳ期32例;无淋巴结转移者33例,有淋巴结转移者47例。结肠癌患者共41例,男性25例,女性16例;TNM分期Ⅰ期11例,Ⅱ期19例,Ⅲ~Ⅳ期11例;低分化患者21例,中高分化患者20例;无淋巴结转移11例,有淋巴结转移30例。黑色素瘤患者共19例,男性8例,女性11例;其中TNM 分期Ⅰ期8例,Ⅱ期6例,Ⅲ~Ⅳ期5例;无淋巴结转移者8例,有淋巴结转移者11例。所有病人术前均未经放射治疗及化学药物治疗。组织常规取材石蜡包埋,用于免疫组化染色。
1.2 主要试剂 兔抗人bFGF 多克隆抗体(Santa Cruz);SP免疫组化染色试剂盒(南京凯基生物科技发展有限公司)。
2 方法
2.1 免疫组织化学链菌素生物素-过氧化酶法(SP法) 以PBS代替Ⅰ抗为阴性对照,具体方法按产品说明书进行。每一病例蜡块连续切片2张,厚5μm。其中1张切片用于HE染色,进行组织形态学观察,另一张切片用于SP免疫组化bFGF染色,以检测bFGF蛋白在组织中的表达。
2.2 结果判定标准 bFGF在肿瘤组织中的表达以见到肿瘤细胞或间质细胞胞浆黄色→棕色染色为阳性。采用Greenspan半定量法对细胞染色强度和阳性细胞百分率得分之和进行评分:根据细胞染色强度:细胞内不着色为0分;浅黄色为1分;棕黄色为2分;棕褐色为3分。按阳性染色细胞数占全部肿瘤细胞百分比 (随机取10个高倍镜视野的平均数):无着色细胞为0分, <10%为1分, 10%~50%为2分, >50%为3分。按上述2项指标的分数乘积高低进行半定量判断: 0分为阴性(-), 1~2分为弱阳性(+),3~4分为中度阳性(++),大于4分为强阳性(+++)。记每个视野下每100个细胞中bFGF染色阳性的数目,共5个视野,取记数平均值,阳性表达率用百分数表示。
3 统计学处理
运用SPSS 17.0软件对相关数据进行统计学处理,计量资料采用均数±标准差(mean±SD)表示,两组间计量资料比较采用t检验,率的比较采用χ2检验,以P<0.05为差异有统计学意义。
结 果
1 bFGF蛋白在非小细胞肺癌的表达情况
68例非小细胞肺癌中bFGF蛋白的阳性率为55.88%(38/68),bFGF蛋白阳性表达为肿瘤细胞浆出现黄色或棕黄色颗粒,低分化癌中的颗粒数量明显多于高分化癌中的颗粒数量,见图1。

Figure 1.bFGF protein expression in NSCLC tissue (IHC,×100). A: high differentiated adenocarcinoma; B: poorly differentiated adenocarcinoma; C: high differentiated squamous cell cancer; D: low differentiated squamous cell cancer.
图1 bFGF蛋白在NSCLC组织的表达
在68例患者中bFGF阳性表达率在鱗癌中为55.26%(21/38),在腺癌患者中为56.67%(17/30),2组差异无统计学意义。低分化癌的阳性表达率高于中高分化癌,差异有统计学意义(P<0.01)。Ⅲ~Ⅳ期患者bFGF表达率高于 Ⅰ~Ⅱ 期患者,差异有统计学意义。伴有淋巴结转移患者的阳性表达率明显高于无淋巴结转移患者,两者差异有统计学意义,见表1。另外,bFGF阳性患者5年生存率为11%,中位生存期为17个月,bFGF阴性5年生存率为13%,中位生存期为19个月。生存曲线见图2。
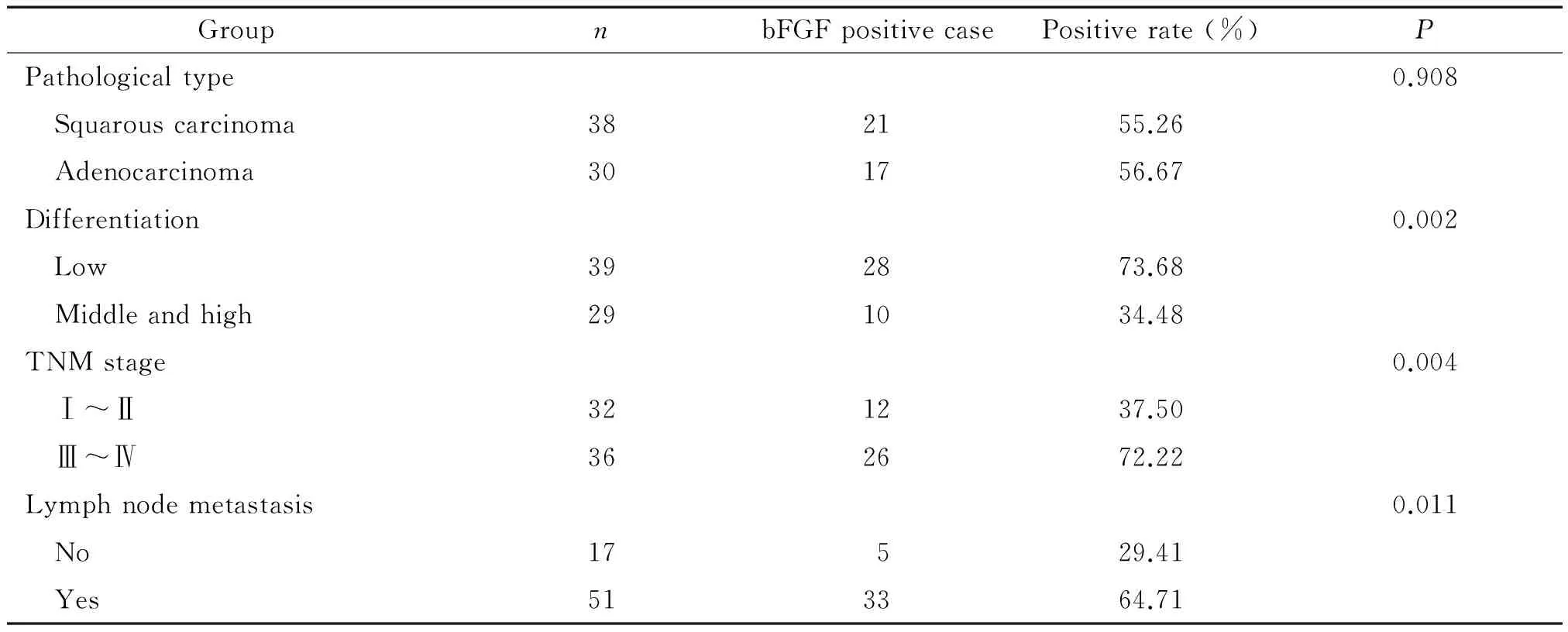
表1 bFGF在非小细胞肺癌中的表达与相关临床病理特征的关系

Figure 2.Correlation of the bFGF protein expression with median survival period of NSCLC.
图2 bFGF阳性表达和非小细胞肺癌中位生存期的关系
2 bFGF蛋白在乳腺癌的表达情况
80例乳腺癌中bFGF蛋白的阳性率为48.75%(39/80),bFGF蛋白阳性表达为肿瘤细胞浆出现棕黄色颗粒,Ⅲ~Ⅳ期乳腺癌组和淋巴结组织中棕黄色颗粒明显多于Ⅰ~Ⅱ期乳腺癌组织。另外在腑窝淋巴结中bFGF也有较高表达,见图3。bFGF阳性表达率在在乳腺导管癌中表达率高于其它类型癌,另外在Ⅲ~Ⅳ期高于Ⅰ~Ⅱ期,2组差异有统计学意义(P<0.05)。伴有淋巴结转移患者bFGF阳性表达率高于不伴有淋巴结转移患者,且差异有统计学意义(P<0.01),见表2。

Figure 3.bFGF protein expression in breast cancer tissue (IHC,×100). A: ductal carcinoma of the breast (stage I); B: ductal carcinoma of the breast (stage II); C: ductal carcinoma of the breast (stage III); D: lymph node metastasis of breast cancer.
图3 bFGF在乳腺癌组织的表达
3 bFGF蛋白在结肠癌的表达情况
41例结肠癌中,bFGF蛋白的阳性率为48.72%(22/41),bFGF蛋白阳性表达为肿瘤细胞浆出现棕黄色颗粒,在结肠高、中、低分化腺癌中黄色或棕黄色颗粒数逐渐增多,另外腺癌转移淋巴结中黄色或棕黄色颗粒数明显增多,见图4。在结肠癌患者中低分化腺癌bFGF阳性表达率低于在中高分化腺癌,2者之间比较差异有统计学意义(P<0.05);Ⅰ期结肠癌bFGF阳性表达为27.27%(3/11),Ⅱ期为63.15%(12/19),Ⅲ~Ⅳ期为63.63%(7/11),3者之间比较差异无统计学意义。bFGF阳性表达有淋巴结转移高于无淋巴结转移(P<0.05),见表3。
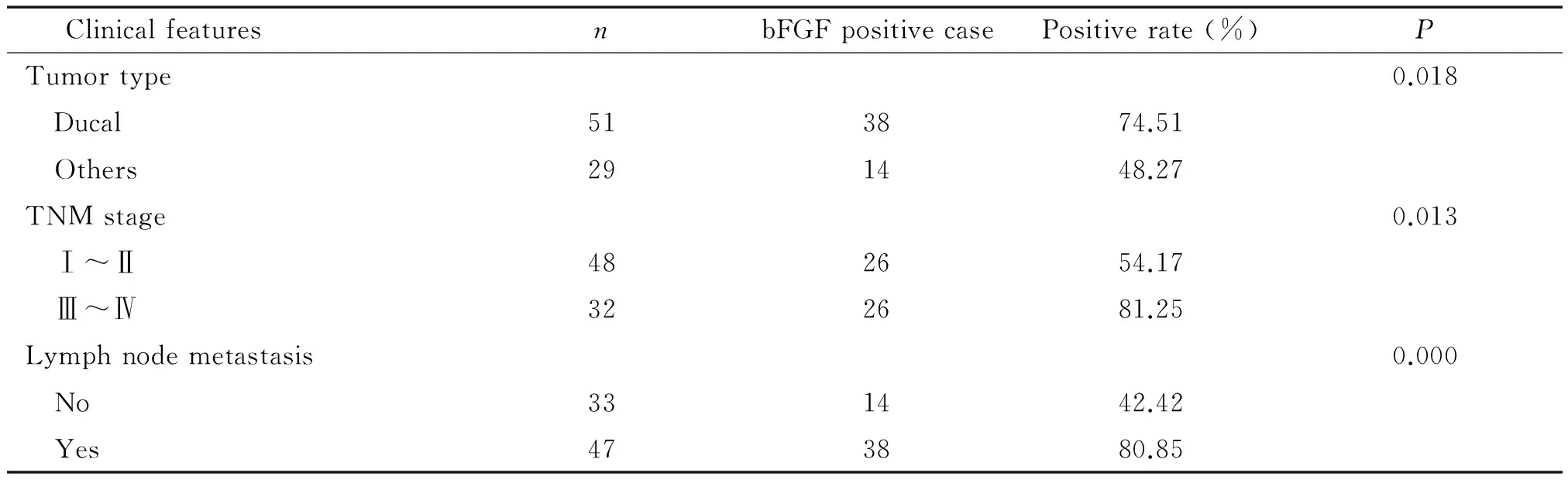
表2 bFGF在乳腺癌中的表达与相关临床病理特征的关系
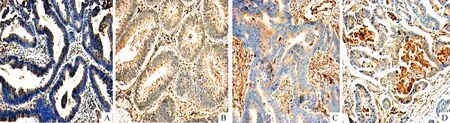
Figure 4.bFGF protein expression in melanoma tissue (IHC,×100). A: high differentiated adenocarcinoma of colon; B: moderately differentiated colon adenocarcinoma; C: low differentiated colon adenocarcinoma; D: lymph node metastasis of colon cancer.
图4 bFGF蛋白在结肠癌组织的表达

表3 bFGF在结肠癌中的表达与相关临床病理特征的关系
4 bFGF蛋白在黑色素瘤的表达情况
19例黑色素瘤患者中,bFGF蛋白的阳性率为52.63%(10/19),bFGF蛋白阳性表达为肿瘤细胞浆出现棕黄色颗粒,Ⅲ~Ⅳ期黑色素瘤组织中棕黄色颗粒明显多于Ⅰ、Ⅱ期黑色素瘤组织,棕黄色颗粒在转移淋巴结中也明显增多,见图5。在黒色素瘤中,bFGF阳性表达率在Ⅰ期黑色素瘤中为25.00%(2/8),Ⅱ期为66.67%(4/6),Ⅲ~Ⅳ期为80.00%(4/5),三者之间比较差异有统计学意义(P<0.05)。bFGF阳性表达率在黑色素瘤有淋巴结转移中为72.73%(8/11),无淋巴结转移中为25.00%(2/8),2组之间比较差异有统计学意义(P<0.05),见表4。
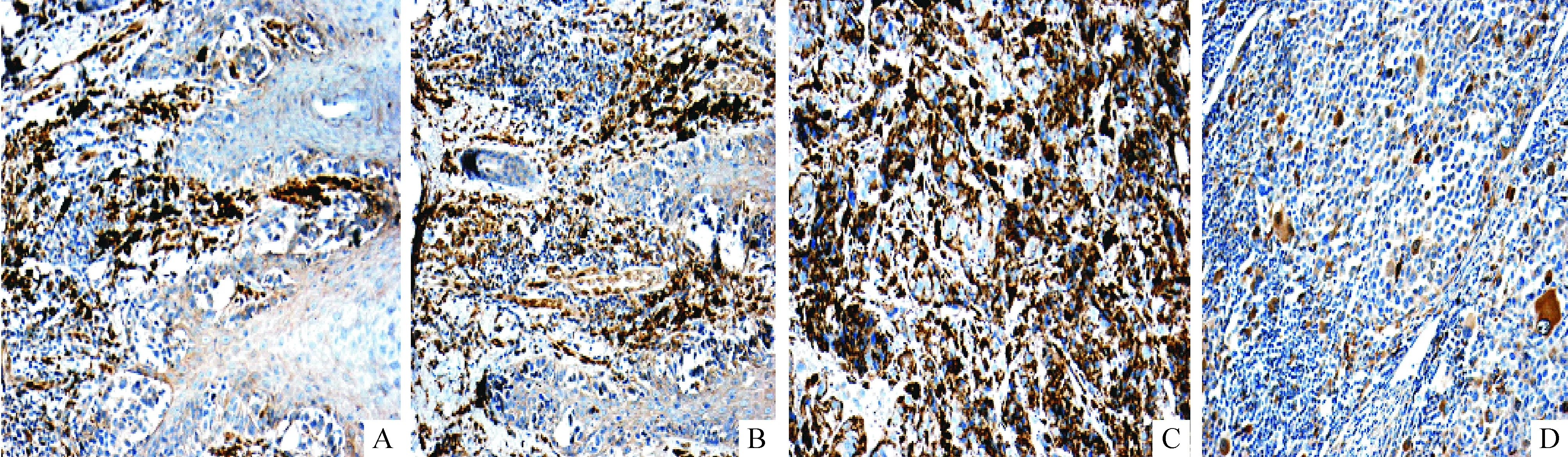
Figure 5.bFGF protein expression in melanoma tissue (IHC,×100). A: stage I; B: stage II; C: stage III; D: lymph node metastasis.
图5 bFGF在黑色素瘤组织的表达
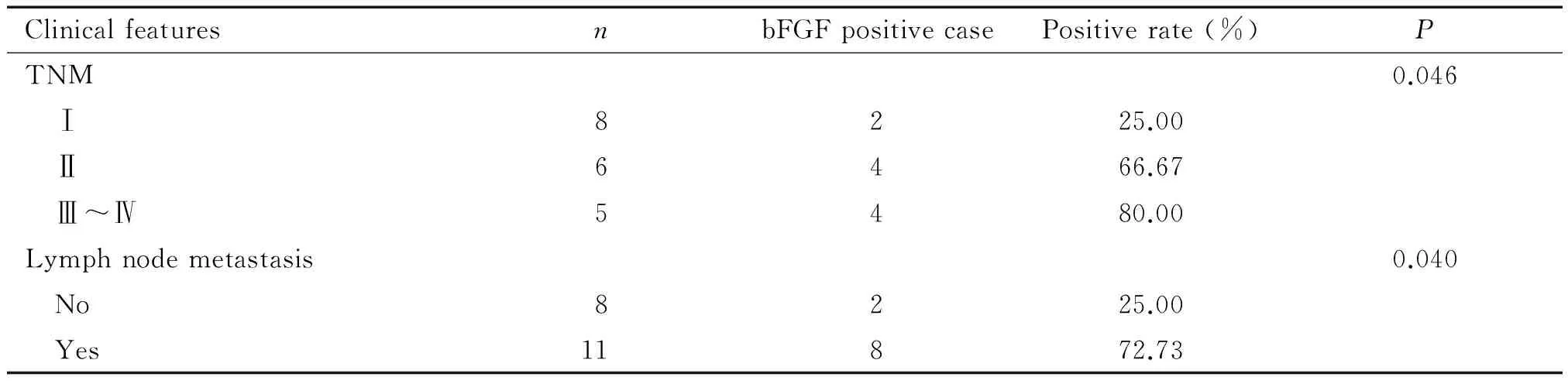
表4 bFGF在黒色素瘤中的表达与相关临床病理特征的关系
讨 论
侵袭和转移是恶性肿瘤最本质的生物学特征,也是导致肿瘤患者死亡的根本原因,而相应血管新生和淋巴结转移是恶性肿瘤侵袭转移的先决条件,因此抑制肿瘤淋巴结转移和血管内皮细胞增殖成为抗肿瘤治疗的关键。 bFGF作为一种细胞有丝分裂原和促血管生成因子,是成纤维生长因子家族中的成员之一,可通过分泌各种蛋白分解酶和胶原酶,从而促进恶性肿瘤转移和侵袭[4]。
本实验研究通过免疫组化方法结果显示,bFGF在肺癌细胞有明显的高表达,并进一步检测bFGF表达水平与肺癌临床病理特征之间的关系,结果发现肿瘤分化程度愈低,临床TNM分期愈晚,bFGF阳性表达愈多,且bFGF阳性表达在有淋巴结转移组中明显高于无淋巴结转移组,提示恶性肿瘤细胞分化程度及恶性肿瘤的临床分期对bFGF阳性表达产生影响。这与Joensuu等[5]的报道相符,可能因为与bFGF具有促进细胞有丝分裂和诱导新血管生成的作用及与肺癌的分化、侵袭、生长、转移和肿瘤新血管的生成有密切关系。先前的文献[6-7]也报道了在晚期非小细胞肺癌细胞株中bFGF和FGFR的表达有明显的上升。因此针对bFGF及其受体将成为治疗非小细胞肺癌的新靶点。同时我们发现,在进一步探索bFGF表达和中位生存期之间的相关趋势,bFGF阳性组与bFGF阴性组比较无明显差异。这可能是因为我们的样本量较小,且不同个体所使用的治疗方案、药物治疗疗程个体的综合体质不同所引起。但是先前在Volm等[8]的实验结果中也得出了相似的结论,他指出bFGF表达升高与患者生存时间无明显相关性。Farhat等[9]也指出在NSCLC组织中bFGF的表达对患者生存时间的影响仍有争议。我们还发现bFGF在乳腺癌高表达,其阳性表达率为65.00%,与先前 Faridi等[10]的研究报道相符。这表明bFGF阳性表达与乳腺癌有着密切的关系。本实验研究结果显示,临床分期Ⅲ~Ⅳ期乳腺癌bFGF的阳性表达率明显高于Ⅰ~Ⅱ期,且在乳腺癌中bFGF在伴有淋巴结转移组明显高于不伴有淋巴结转移组的表达,故可认为乳腺癌组织中bFGF的高表达与肿瘤高侵袭性相关,bFGF的高表达可增加乳腺癌细胞的侵袭性,先前的研究也发现不伴有淋巴结转移的患者和bFGF表达阴性的患者相比其中位生存期明显延长[10]。 bFGF在乳腺癌中的过度表达提示乳腺癌患者的恶性程度高、易转移、预后差,与Faridi等[10]的报道一致。本研究还通过对41例结肠癌组织bFGF表达率进行测定,结果发现bFGF在结肠癌中呈高表达,有淋巴结转移组、临床分期较晚组的bFGF阳性表达率较无淋巴结转移组、临床分期较早组显著增高,提示bFGF对结肠癌发生、发展和转移起到促进作用。另外,我们发现在与中高分化结肠癌相比较,低分化的结肠癌bFGF阳性表达率较高,可以认为bFGF是促进低分化结肠癌血管生成和肿瘤细胞增殖的作用因子,而Landriscina等[11]的实验也发现了相同的结果。所以可以说明bFGF因子是诊断和预后结肠癌的客观指标之一。最后,在黑色瘤组织中,bFGF的阳性表达率为52.61%,符合先前的研究结果(30%~90%)[12-13]。Straume等[12]报道bFGF在黑色素瘤组织的表达率高可能与黑色素瘤细胞中微小血管的密度高有关。另外我们还发现在临床分期晚和伴有淋巴结转移的bFGF的表达率高于临床分期早无淋巴结转移的患者相关,可能是因为随着黑色素瘤的恶性程度增高,bFGF的表达量也增多。例如在Giehl 等[14]的研究中发现在黑色素瘤中的bFGF的表达量与其癌前病变黑痣相比增加了36%,这进一步说明了bFGF是促进黑色素瘤发生和发展的重要影响因子。
bFGF是多种细胞的有丝分裂原,它的过表达与细胞的增殖密切相关[15-16],在多种临床常见恶性肿瘤细胞增殖发挥重要作用,Erdem等[17]指出当抑制bFGF因子在肿瘤细胞中的表达可有效抑制肿瘤的发生发展,另外大量的前期研究表明bFGF还可在多种恶性肿瘤细胞的侵袭和淋巴结转移中起到重要作用[18]。Takeda等[19]的研究结果提示在伴有淋巴结转移的肺癌、乳腺癌和结肠癌中,bFGF蛋白因子的表达较高,指出bFGF提高了恶性肿瘤的侵袭能力。另外Elagoz等[20]表明在结直肠癌组织中bFGF的高表达与直肠癌的淋巴结转移密切相关,所以随着肿瘤分期增加和伴有淋巴结的转移,bFGF的表达越高。Chidazawa 等[21]指出在膀胱尿路上皮细胞癌早期下调bFGF蛋白的表达,对抑制淋巴结转移有着重要的作用,因此表明bFGF表达和癌细胞发生淋巴结转移有着重要的关系。进一步探讨bFGF促进恶性肿瘤增殖转移的机制,先前的研究发现bFGF与细胞膜受体结合后,受体构象的改变激活酪氨酸激酶活性,使受体自身酪氨酸磷酸化,引起细胞内通路级联反应,降解原有基膜、激活内皮细胞增殖和迁移,有利于肿瘤发生和淋巴结转移。另外,研究证明,bFGF可促进VEGF、PDGF等多种生长因子分泌,并与VEGF、PDGF等具有协同作用,共同促进肿瘤发生增殖和转移[22]。Rykala等[23]的研究指出由bFGF通过旁分泌途径促进了VEGF的分泌增多,而VEGF表达水平的升高进一步促进了肿瘤细胞的淋巴结转移。
总之,bFGF表达是肿瘤细胞进展和转移的重要环节,与其分化程度,临床分期、淋巴结转移和不良预后有关。bFGF蛋白检测可能成为判断恶性肿瘤是否发生转移的有效参考指标之一。因此根据恶性肿瘤的上述特点可为靶向抗bFGF抗体、FGFR拮抗剂的临床应用打下了临床基础。但本研究样本量相对较少,需要前瞻性的临床研究进一步验证。
[1] Attoub S, Arafat K, Gelaude A, et al. Frondoside a suppressive effects on lung cancer survival, tumor growth, angiogenesis, invasion, and metastasis[J]. PLoS One, 2013, 8(1):e53087.
[2] Montero A, Okada Y, Tomita M, et al. Disruption of the fibroblast growth factor-2 gene results in decreased bone mass and bone formation[J]. J Clin invest, 2000, 105(8):1085-1093.
[3] Presta M, Dell’ Era P, Mitola S, et al. Fibroblast growth factor/fibroblast growth factor receptor system in angiogenesis[J]. Cytokine Growth Factor Rev, 2005, 16(2):159-178.
[4] Song S, Wientjes MG, Gan Y, et al. Fibroblast growth factors: an epigenetic mechanism of broad spectrum resistance to anticancer drugs[J]. Proc Natl Acad Sci U S A, 2000, 97(15):8658-8663.
[5] Joensuu H, Anttonen A, Eriksson M, et al. Soluble syndecan-1 and serum basic fibroblast growth factor are new prognostic factors in lung cancer[J]. Cancer Res, 2002, 62(18):5210-5217.
[6] Coldren CD, Helfrich BA, Witta SE, et al. Baseline gene expression predicts sensitivity to gefitinib in non-small cell lung cancer cell lines[J]. Mol Cancer Res, 2006, 4(8):521-528.
[7] Marek L, Ware KE, Fritzsche A, et al. Fibroblast growth factor (FGF) and FGF receptor-mediated autocrine signaling in non-small-cell lung cancer cells[J]. Mol Pharmacol, 2009, 75(1):196-207.
[8] Volm M, Koomagi R, Mattern J, et al. Prognostic value of basic fibroblast growth factor and its receptor (FGFR-1) in patients with non-small cell lung carcinomas[J]. Eur J Cancer, 1997, 33(4):691-693.
[9] Farhat FS, Tfayli A, Fakhruddin N, et al. Expression, prognostic and predictive impact of VEGF and bFGF in non-small cell lung cancer[J]. Crit Rev Oncol Hematol, 2012, 84(2):149-160.
[10]Faridi A, Rudlowski C, Biesterfeld S, et al. Long-term follow-up and prognostic significance of angiogenic basic fibroblast growth factor (bFGF) expression in patients with breast cancer[J]. Pathol Res Pract, 2002, 198(1):1-5.
[11]Landriscina M , Cassano A, Ratto C, et al. Quantitative analysis of basic fibroblast growth factor and vascular endothelial growth factor in human colorectal cancer[J]. Br J Cancer, 1998, 78(6):765-770 .
[12]Straume O, Akslen LA. Importance of vascular phenotype by basic fibroblast growth factor, and influence of the angiogenetic factors basic fibroblast growth factor/fibroblast growth factor receptor-1 and ephrin-A1/EphA2 on melanoma progression[J]. Am J Pathol, 2002, 160(3):1009-1019.
[13]Birck A, Kirkin AF, Zeuthen J, et al. Expression of basic fibroblast growth factor and vascular endothelial factor in primary and metastatic melanoma from the same patients[J]. Melanoma Res, 1999, 9(4):375-381.
[14]Giehl KA, Nagele U, Volkenandt M, et al. Protein expression of melanocyte growth factors( bFGF,SCF) and their receptors( FGFR-1, c-kit) in nevi and melanoma[J]. J Cutan Pathol, 2007: 34(1):7-14.
[15]叶丽平, 温有锋, 聂海祺,等. 碱性成纤维细胞生长因子对卵巢癌CAOV3细胞cyclinD1及GADD153表达的影响[J]. 中国病理生理杂志, 2008, 24(10):1885-1888.
[16]黎 佼, 董 珺, 张振辉, 等. MicroRNA-196a通过HOXB7调控人骨髓间充质干细胞的增殖功能[J]. 中国病理生理杂志, 2014, 30(2):278-285.
[17]Erdem H, Yildirim U, Uzunlar AK, et al. Relationship among expression of basic-fibroblast growth factor, MTDH/astrocyte elevated gene-1, adenomatous polyposis coli, matrix metalloproteinase 9,and COX-2 markers with prognostic factors in prostate carcinomas[J]. Niqer J Clin Pract, 2013, 16(4):418-423.
[18]Villegas SN, Canham M, Brickman JM. FGF signaling as a mediator of lineage transitions-evidence from embryonic stem cell differentiation[J]. J Cell Biochem, 2010, 110(1):10-20.
[19]Takeda M, Mikami T, Numata Y, et al. Papillary thyroid carcinoma with heterotopic ossification is a special subtype with extensive progression[J]. Am J Clin Pathol, 2013, 139(5):587-598.
[20]Elagoz S, Egilmez R, Koyuncu A, et al. The intratumoral microvessel density and expression of bFGF and nm23-H1 in colorectal cancer[J]. Pathol Oncol Res, 2006, 12(1):21-27.
[21]Chikazawa M, Lnoue K, Fudata S, et al. Expression of angiogenesis-related genes regulates different steps in the process of tumor growth and metastasis in human urothelial cell carcinoma of the urinary bladder[J]. Pathobiology, 2008, 75(6):335-345.
[22]张志华, 刘 鹏, 王丽红, 等. bFGF表达对裸鼠白血病移植血管新生影响的研究[J].中国肿瘤临床, 2013, 40(14):821-823.
[23]Rykala J, Przbylowska K, Majsterek I, et al. Angiogenesis markers quantification in breast cancer and their correlation with clinicopathological prognostic variables[J]. Pathol Oncol Res, 2011, 17(4):809-817.
Expression of bFGF in malignant tumor and its clinical pathological significance
ZHAO Jian-fu1, XU Meng1, ZHAO Feng-zhi1, HU Peng-hui1, QUAN Qiang1, XIANG Jun-jian2, WANG Hong2
(1DepartmentofOncology,TheFirstAffiliatedHospital,2LaboratoryofAntibodyEngineering,CollegeofLifeScienceandTechnology,JinanUniversity,Guangzhou510632,China.E-mail:xumengjinan@yahoo.com)
AIM: To detect basic fibroblast growth factor (bFGF) expression in clinical common malignant tumor (non-small-cell lung cancer,breast cancer, colon cancer and melanoma), and to identify relationship between the expression and tumor clinicopathological characteristics. METHODS: Immunohistochemical SP method was used to detect the expression of bFGF at protein level in 208 cases of paraffin-embedded tissue of primary malignant tumor patients (68 cases of lung cancer, 80 cases of breast carcinoma, 41 cases of colon cancer and 19 cases of melanoma). RESULTS: The bFGF protein expression levels were significantly higher in low differentiated non-small-cell lung cancer with lymph node metastasis, and were positively correlated with TNM. In addition, no significant influence of the bFGF protein expression on the patients with median survival period was observed. The protein expression of bFGF was higher in advanced breast cancer with lymph node metastasis and was commonly found in the middle/higher differentiated colon cancer with regional lymph node metastasis. Meanwhile, bFGF protein was highly expressed in advanced melanoma patients with lymph node metastasis. CONCLUSION: bFGF may participate in the process of occurrence and progression of malignant tumor. Expression of bFGF protein may be an effective parameter for evaluating metastasis and prognosis of malignant tumor.
Malignant tumor; Basic fibroblast growth factor; Clinical pathological characteristics
1000- 4718(2015)04- 0590- 07
2015- 01- 15
2015- 03- 04
国家自然科学基金资助项目(No.81273814); 广东省重大新药创制重大科技专项资助项目(No.2013A022100031)
R730.23
A
10.3969/j.issn.1000- 4718.2015.04.003
△通讯作者 Tel: 020-38688909; E-mail: xumengjinan@yahoo.com
