重组蛋白PTD-HSP27的制备及其穿细胞膜和角膜组织的功能研究*
2015-04-17余榕捷曾智星郭晓令季青山钟敬祥
刘 莲, 余榕捷, 戴 云, 曾智星, 郭晓令, 季青山, 钟敬祥△
(暨南大学 1附属第一医院眼科, 2生物工程研究所,广东 广州 510632)
重组蛋白PTD-HSP27的制备及其穿细胞膜和角膜组织的功能研究*
刘 莲1, 余榕捷2, 戴 云2, 曾智星2, 郭晓令2, 季青山1, 钟敬祥1△
(暨南大学1附属第一医院眼科,2生物工程研究所,广东 广州 510632)
目的: 制备PTD-HSP27蛋白并研究其能否穿过人晶状体上皮细胞SRA01/04细胞膜及新西兰大白兔的角膜组织进入眼前房。方法: 利用重叠延伸PCR法获得重组目的基因片段PTD-HSPB1-6His,构建重组质粒pKYB-PTD-HSP27-6His,原核诱导PTD-HSP27蛋白表达及纯化重组蛋白后对其进行Western blotting鉴定;用异硫氰酸荧光素(FITC)标记重组蛋白PTD-HSP27并检测其穿透SRA01/04细胞膜的能力及兔眼角膜组织的能力。结果: 成功构建并纯化制备目的蛋白PTD-HSP27,在PTD-HSP27孵育后的SRA01/04细胞及结膜囊滴注PTD-HSP27兔眼前房内均可检测出重组蛋白PTD-HSP27。结论: 通过重叠延伸PCR法及镍柱层析纯化法可以获得较纯的重组蛋白PTD-HSP27;重组蛋白PTD-HSP27能够穿透SRA01/04细胞膜及穿越兔眼角膜进入房水。
蛋白转导域; 热休克蛋白27; 反式转录激活因子; 晶状体上皮细胞
热休克蛋白27(heat shock protein 27, HSP27)的低分子量使其隶属于小分子热休克蛋白家族,是由生物体(或离体培养细胞)在不良环境因素刺激下产生的一组应激蛋白,它在结构上具有高度的保守性,对于细胞的结构维持、更新和修复等方面起到十分重要的保护细胞作用。反式转录激活因子(trans-activator of transcription, TAT)是一种带有正电荷的短肽结构,TAT功能中最具吸引力的部分就是它可以帮助多种类型的大分子物质穿过细胞膜进入细胞内部[1-3]。蛋白转导域(protein transduction domain,PTD)是既往研究中已经证实的TAT穿膜功能的关键序列,PTD具备有强大的穿膜活性,可以将与之连接的基因、多肽或蛋白质高效快速地导入到细胞内部,而被导入细胞的正常结构和功能均不受其影响[4]。本实验研究主要是通过基因工程的原理和相关技术实现重组目的基因PTD-HSPB1-6His,表达并纯化制备重组蛋白PTD-HSP27,并检测PTD是否具备将HSP27带入细胞内甚至穿透动物角膜的能力,为后续研究重组蛋白PTD-HSP27的生物学功能提供前期基础。
材 料 和 方 法
1 材料
1.1 质粒、细胞和动物 编码人HSP27的HSPB1基因模版质粒购自长沙赢润生物技术有限公司; pKYB质粒、工程菌DH5和E.colistrain ER2566由暨南大学生物工程研究所保存; 人晶状体上皮细胞(SRA01/04)由中山眼科中心惠赠; 新西兰大白兔购自广东省实验动物中心。
1.2 主要试剂 质粒提取试剂盒、PCR产物回收试剂盒、PCR产物纯化试剂盒、限制酶NdeI和XhoI以及PCR酶和T4连接酶均购自TaKaRa; 6His I抗购自Santa Cruz;Ni2+柱购自QIAGEN;FITC标记试剂盒购自上海喜润生化试剂公司;其余常规试剂均为国产或进口分析纯产品。
2 方法
2.1 重组质粒pKYB-PTD-HSP27-6His的构建 根据HSPB1基因序列设计引物,上游引物为5’-XXX XXX CAT ATG TAT GGC CGT AAA AAA CGT CGT CAG CGT CGTCGT ACC GAG CGC CGC GTC CCC TTC TCG CTC-3’,下游引物为5’-XXX XXX CTC GAG TTA TCA ATG ATG ATG ATG ATG ATG CTT GGC GGC AGT CTC ATC GGA TT-3’,划线部位分别为NdeI和XhoI的酶切位点,引物由Invitrogen合成。以HSPB1基因为模版进行PCR扩增,在HSP27蛋白的N端引入PTD短肽YGRKKRRQRRR,C端引入6个组氨酸的标签。
2.2 重组蛋白PTD-HSP27-6His的诱导表达、纯化制备及Western blotting鉴定 将上步阳性克隆的质粒转化至表达菌株E.colistrain ER2566中,得到原核表达菌株pKYB-PTD-HSP27-6His-ER2566后,将isopropyl β-D-1-thiogalactopyranoside (IPTG)终浓度分别调整至0.2、0.4、0.6、0.8 mmol/L诱导表达菌E.colistrain ER2566表达目的蛋白。用SDS-PAGE(12%)检测菌体超声破碎后PTD-HSP27融合蛋白的诱导表达情况,选择可溶性PTD-HSP27融合蛋白含量最高者为最佳IPTG诱导浓度。Western blotting鉴定目的蛋白。将表达菌体上清缓慢滴入平衡后的Ni2+柱;用不同浓度(20、40、60、80、120、200 mmol/L)的咪唑缓冲液分步进行洗脱,12% SDS-PAGE检测,选择杂蛋白明显洗脱而无目的蛋白条带的浓度为杂蛋白的咪唑洗脱浓度;选择可见明显目的蛋白条带的洗脱浓度为目的蛋白最佳咪唑洗脱浓度。将融合蛋白用最佳的IPTG诱导浓度诱导表达并用最佳咪唑洗脱浓度进行洗脱,将得到蛋白透析后置于真空冷冻干燥机制备重组蛋白PTD-HSP27的蛋白粉末,冻存备用。
2.3 PTD-HSP27穿膜功能的验证 利用FITC标记试剂盒分别对PTD-HSP27和野生型HSP27进行荧光标记。待生长在6孔板上的SRA01/04细胞融合至80%左右时,分别加入含FITC-PTD-HSP27和FITC-HSP27的无血清培养基,37℃孵育2 h;用PBS液轻柔冲洗细胞片4次,每次10 min(避光操作),在倒置荧光显微镜下对细胞进行观察并拍照。将RIPA裂解液加入到用FITC标记后的重组蛋白PTD-HSP27孵育完成后的SRA01/04中,收集细胞裂解液。用荧光检测仪检测RIPA裂解后的细胞A495值,RIPA为作为空白对照,应用公式计算进入细胞内的标记蛋白量(进入细胞蛋白量=A495/蛋白标记效率)。按以下公式计算蛋白穿膜效率:蛋白穿膜效率=进入细胞的标记蛋白量/每孔标记蛋白总含量。将新西兰大白兔按体重随机分为2组: HPS27组和PTD-HSP27组,每组5只。PBS液冲洗兔眼结膜囊3次,在兔眼结膜囊滴入表面麻醉剂后进入暗室,将FITC标记的PTD-HSP27和野生型HSP27实验样品约200μL滴入兔眼结膜囊内,使样品充分浸润整个眼球;1 h后,PBS液冲洗结膜囊3次,将1 mL注射器针头自兔眼的角巩缘部位穿刺进入前房,缓慢吸取房水;将上述步骤吸取的房水装入避光的EP管中,冷冻离心机1 500 r/min离心5 min,取上清200 μL加入96孔板中,用荧光分光光度计检测各个样品在520 nm的荧光值,激发光495 nm;计算重组蛋白PTD-HSP27穿兔角膜效率(%)=(样品荧光值-空白对照荧光值)/(标记效率W ×蛋白上样量)。
3 统计学处理
采用SPSS 16.0软件对所有实验数据进行统计学分析,数据采用均数±标准差(mean±SD) 表示,多组间比较采用单因素方差分析(one-way ANOVA)。以P<0.05为差异有统计学意义。
结 果
1 质粒pKYB-PTD-HSP27的构建和鉴定
利用引物对模板质粒进行PCR扩增,在已有的HSPB1基因N端连接穿膜片段PTD,C端连接用于蛋白纯化标记的6His基因片段,设计出的PTD-HSPB1-6His大小为669 bp,与图中位置一致,说明扩增出了目的基因(图1A);用NdeI和XhoI双酶切对阳性克隆4进行鉴定,切出预期大小的基因条带,说明目的基因已连接在pKYB载体中(图1B);经菌落PCR鉴定得到阳性克隆为3、4、5号克隆(图1C);对阳性克隆进行测序检测,BLAST序列比对显示pKYB载体中含有序列正确的目的基因。
2 重组蛋白PTD-HSP27的诱导表达及其Western blotting鉴定
2.1 IPTG最佳诱导浓度筛选 加入IPTG至终浓度分别为0.2、0.4、0.6和0.8 mmol/L,37 ℃、180 r/min诱导3 h后,12% SDS-PAGE 检测目的蛋白的表达结果,显示IPTG浓度为0.6 mmol/L时最有利于PTD-HSP27的可溶性表达,蛋白分子量约为27 kD,见图2。

Figure 1.Identification of expression plasmid pKYB-PTD-HSP27-6His. A: PCR amplification of recombinant PTD-HSP27-6His gene; B: identification of positive expression vector PTD-HSP27-6His digested by Nde I and Xho I; C: identification of the positive expression vector PTD- HSP27-6His by PCR.
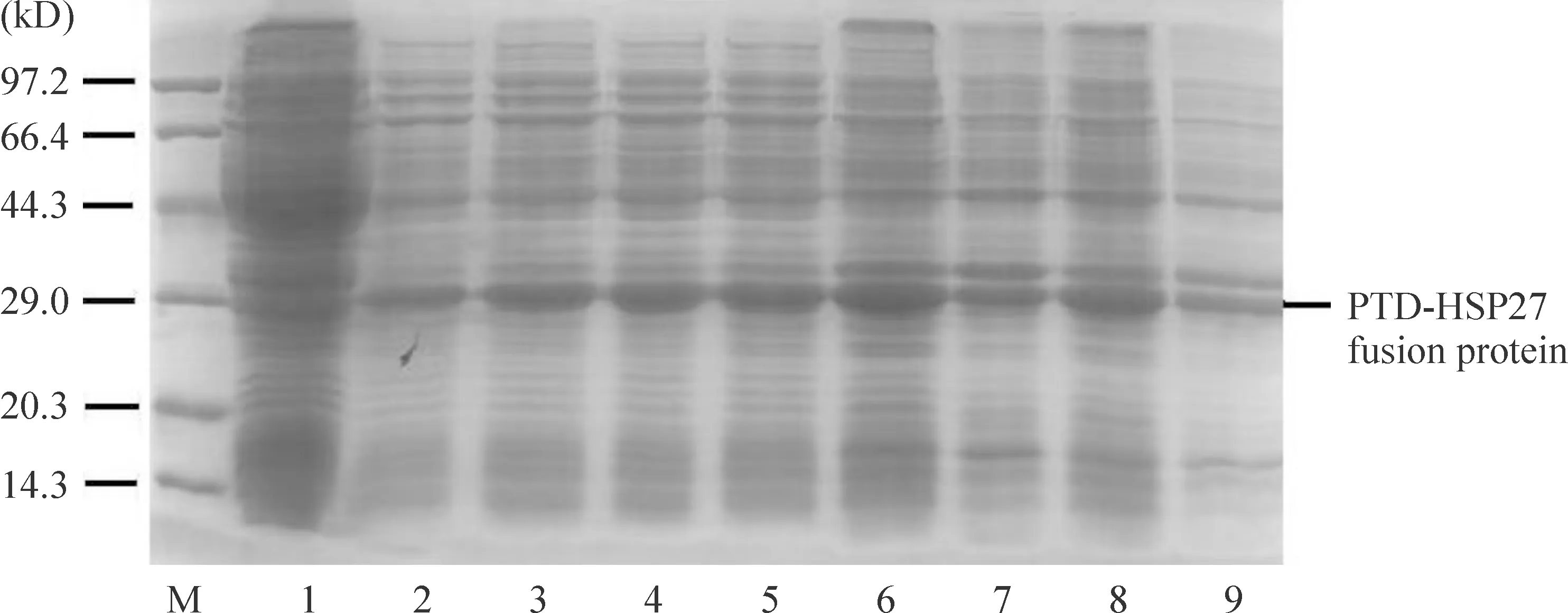
Figure 2.Concentration screening of IPTG. M: protein marker; 1: uninduced bacteria; 2~5: supernatant of bacteria induced with 0.2, 0.4, 0.6 and 0.8 mmol/L IPTG; 6~9: deposit of bacteria induced with 0.2, 0.4, 0.6 and 0.8 mmol/L IPTG.
2.2 咪唑洗脱浓度筛选 采用Ni2+Trap Chelating HP 亲合层析柱对目的蛋白PTD-HSP27进行层析纯化,通过对不同咪唑浓度梯度进行筛选,得出目的蛋白的最佳咪唑洗脱浓度为200 mmol/L,可得到较纯的重组蛋白PTD-HSP27(图3)。由图中所见,破碎后的菌体沉淀中仍有多量的PTD-HSP27存在,提示破碎不完全,可以进一步改善细胞破碎条件以提高蛋白纯化率。

Figure 3.Concentration screening of imidazole. 1: 200 mmol/L imidazole wash; M: protein marker; 2: uninduced bacteria; 3: bacteria induced with 0.6 mmol/L IPTG; 4: supernatant of bacteria induced with 0.6 mmol/L IPTG; 5: flow through nickel affinity column; 6: 20 mmol/L imidazole wash; 7: 40 mmol/L imidazole wash; 8: 60 mmol/L imidazole wash; 9: 80 mmol/L imidazole wash.
2.3 重组蛋白PTD-HSP27-6His的制备及Western blotting鉴定 依照上述筛选后的优化IPTG诱导浓度及蛋白纯化条件,用500 mL摇瓶的液体LB培养基对工程菌pKYB-PTD-HSP27-ER2566进行扩大培养,Ni2+柱层析纯化蛋白PTD-HSP27,经过透析和真空冷冻干燥后制备成PTD-HSP27蛋白干粉。用6His抗体对重组蛋白干粉进行Western blotting检测,结果显示制备出正确的带有6His标签的重组蛋白PTD-HSP27,见图4。
3 重组蛋白PTD-HSP27的穿膜能力检测
3.1 重组蛋白PTD-HSP27的穿细胞膜的能力和效率检测 将重组蛋白PTD-HSP27和野生型HSP27分别进行FITC标记后与SRA01/04细胞孵育,用倒置荧光显微镜观察拍摄,可见PTD-HSP27组在细胞内有大量荧光,但HSP27组中的细胞内没有显著的荧光信号,此实验结果表明重组PTD-HSP27能够顺利通过细胞膜进入细胞。结果显示:重组PTD-HSP27进入细胞效率为(46.32±2.74)%;没有带入膜信号的HSP27进入细胞效率约为(6.10±1.12)%,2组有显著的统计学差异(P<0.01),见图5。

Figure 4.SDS-PAGE (12%) analysis and Western blotting identification of preparation and purification of PTD-HSP27. M: protein marker; 1: uninduced bacteria; 2: supernatant of bacteria induced by IPTG; 3: precipitation of bacteria induced by IPTG; 4: flow through nickel affinity column; 5: 40 mmol/L imidazole wash; 6: 80 mmol/L imidazole wash; 7: 120 mmol/L imidazole wash; 8: the target protein PTD-HSP27 eluted with 200 mmol/L imidazole; 9: purified recombinant PTD-HSP27 dialysed with distilled water; 10: Western blotting identification of the purified recombinant PTD-HSP27.

Figure 5.Penetrating ability and efficiency of the fusion protein PTD-HSP27. Mean±SD. n=3. **P<0.01 vs HSP27.
3.2 重组蛋白PTD-HSP27的穿兔角膜能力和效率检测 按实验方法所述标记重组蛋白PTD-HSP27和野生型HSP27,在新西兰大白兔结膜囊中分别滴入FITC标记的HSP27和PTD-HSP27,取房水检测各个样品在520 nm的荧光值。可见:PTD-HSP27组和HSP27组在兔眼前房的房水荧光值分别为88 978.35±5 069.04和13 368.34±1 025.32。PTD-HSP27组房水荧光值明显高于HSP27组,组间比较有显著的统计学差异(P<0.01)。PTD-HSP27穿兔角膜的效率为(27.31±1.94)%,HSP27穿兔角膜的效率为(4.37±1.07)%,两组之间比较有显著差异(P<0.01),说明天然HSP27的通过角膜进入眼内的能力并不高,而PTD可有效介导HSP27穿过兔眼角膜进入眼内,见图6。
讨 论
细胞膜的主要功能是将细胞的内部环境和外部环境隔开,这一功能可以保持细胞内环境的稳定从而维持细胞的正常形态和功能。除了一些可以自由穿梭于细胞内外的小分子物质外,细胞外的各种成分进入细胞都需要通过受体、离子通道、胞吞等方法。由于细胞膜对细胞内外物质的这种选择透过性,使得很多具备特定生物学活性作用的蛋白质和多肽等物质难以穿过细胞膜进入细胞内或到达组织的靶点位置,细胞膜的选择透过性在很大程度上限制了这些蛋白质和多肽发挥作用。
1988年,Green等[1]和Frankel等[2]首次发现TAT能主动穿过细胞膜进入细胞核。1997年,Vivès等[4]发现氨基酸YGRKKRRQRRR片段与蛋白转导功能密切相关,是穿膜能力的关键功能区,也是蛋白转导功能的最小单位,将之称为PTD。 1994年,Fawell等[3]发现,通过与TAT以共价方式结合,异源蛋白可以被TAT转移到细胞内, 这一结果意味着TAT具有蛋白转导的活性。1999年Schwarze等[5]首次在体内证实了PTD的蛋白转导作用。此后的研究证实,与PTD结合的多肽、蛋白质及DNA可以被高效快速地导入细胞,这种方式具有浓度依赖性,被导入细胞的正常结构以及功能并未受到影响[[6]。2007年,Delom等[7]首次发现外源蛋白可以通过PTD的转导作用进入秀丽隐杆线虫(Caenorhabditiselegans)的肠上皮细胞,这意味着PTD的跨膜功能不具有物种特异性。

Figure 6.Fluorescence intensity of rabbit aqueous humor and penetrating efficiency of the fusion protein PTD-HSP27. Mean±SD. n=3. **P<0.01 vs HSP27.
随着对TAT蛋白转导功能的深入研究,研究者们开始以共价键或融合蛋白的形式利用PTD携带各种目的蛋白进行研究,结果证实PTD介导的重组蛋白均能被有效地导入到哺乳动物细胞内[8-10]。由于能够介导作为多肽和蛋白质等大分子药物进入细胞内并且穿过血脑屏障,PTD开始更多地被应用于携带治疗某些疾病的药物进入细胞和组织,从而达到治疗疾病的目的,已有研究人员构建了融合蛋白PTD-caspase-3, 用来治疗艾滋病[11]。
后基因组时代的主要研究方向和重点是利用基因组编码形成的蛋白质的生物学功能,PTD在这一领域可以起到重要的作用。由于PTD能够将基因的编码产物蛋白质直接转导入细胞内,绕过核酸的参与,从而可以更直接地表现出蛋白质的生物学功能。因此,TAT-PTD融合蛋白系统被认为是一种非常具有前途的物质运载工具,在基础医学的研究以及生物制药的临床治疗等方面都有着非常广泛的应用前景[12]。
关于重组蛋白PTD-HSP27的构建及作用研究,国际上报道中提出在HSP27的C端加入PTD短肽的重组蛋白PTD-HSP27具有穿膜的活性[13-14],本实验研究中首次将PTD短肽加入到HSP27的N端,借以构建含有穿膜肽的HSP27,结果也证实了利用重叠延伸PCR 技术,可以成功地在已有的编码人HSP27的HSPB1基因N端和C端分别加入PTD基因和6个组氨酸的蛋白纯化标签,经过蛋白的诱导表达和纯化等相关实验步骤,成功获得了纯化的重组蛋白PTD-HSP27,并用Western blotting及测序等方法鉴定其表达正确。研究中利用重叠延伸PCR技术等基因工程的原理和技术,根据己知的编码人HSP27蛋白与PTD的基因序列,设计出重组蛋白PTD-HSP27的编码基因,采用重叠延伸PCR法将PTD与6个组氨酸的蛋白纯化标签连接在编码HSP27的基因上,构建出蛋白的原核表达系统来表达目的蛋白;用蛋白层析法对目的蛋白进行纯化制备并检测其生物学活性,结合镍柱蛋白纯化技术要点,形成具有自主知识产权的PTD-HSP27蛋白的制备思路,为重组蛋白PTD-HSP27的生物制药研发与临床药物应用提供前期的实验室基础。本实验结果显示重组蛋白PTD-HSP27 可以顺利进入细胞内,同时也证实其具备天然HSP27蛋白所不具备的可以顺利穿越角膜进入兔眼房水内的能力,这一结果也进一步证实了本实验中首次成功重组并纯化制备的N端连接PTD的重组蛋白PTD-HSP27具有穿膜的生物学活性,且蛋白穿膜活性好,可以穿过HLECs细胞膜进入细胞并穿过兔角膜组织进入眼前房,为后期入膜后的重组蛋白对细胞及眼部组织的作用研究以及相关应用奠定基础。
[1] Green M, Loewenstein PM. Autonomous functional domains of chemically synthesized human immunodeficiency virus tattrans-activator protein [J]. Cell, 1988, 55(6): 1179-1188.
[2] Frankel AD, Pabo Co. Cellular uptake of the tat protein from human immunodeficiency virus [J]. Cell, 1988, 55(6): 1189-1193.
[3] Fawell S, Seery J, Daikh Y, et al. Tat-mediated delivery of heterologous proteins into cells [J]. Proc Natl Acad Sci U S A, 1994, 91(2): 664-668.
[4] Vivès E, Brodin P, Lebieu B. A truncated HIV-1 Tat protein basic domain rapidly translocates through the plasma membrane and accumulates in the cell nucleus [J]. J Biol Chem, 1997, 272(25): 16010-16017.
[5] Schwarze SR, Ho A, Vocero-Akbani A, et al.Invivoprotein transduction: delivery of a biologically active protein into the mouse [J]. Science, 1999, 285(5433): 1569-1572.
[6] Lindgren ME. Passage of cell-penetrating peptides across a human epithelial cell layerinvitro[J].Biochem J, 2004, 377(l):69-76.
[7] Delom F, Fessart D, Caruso ME, et al. Tat-mediated protein delivery in livingCaenorhabditiselegans[J].Biochem Biophys Res Commun, 2007, 352 (3): 587-591.
[8] Trehin R, Merkle HP. Chances and pitfalls of cell penetrating peptides for cellular drug delivery [J]. Eur J Pharm Biopharm, 2004, 58(2):209-223.
[9] Brooks H, Lebleu B, Vives E. Tat peptide-mediated cellular delivery: back to basics [J]. Adv Drug Deliv, 2005, 57(4):559-577.
[10]Shen H, Mai JC, Qiu L, et al. Evaluation of peptide-mediated transduction in human CD34 cell [J]. Hum Gene Ther, 2004, 15(4):415-419.
[11]Vocero-Akbani AM, Heyden NV, Lissy NA, et al. Killing HIV-infected cells by transduction with an HIV protease-activated caspase-3 protein [J]. Nat Med, 1999, 5(1): 29-33.
[12]熊 符,张 成,于美娟.蛋白转导在基因治疗中的应用[J].国际生物医学工程杂志,2006,29(4):250-254.
[13]Kwon JH, Kim JB, Lee KH, et al. Protective effect of heat shock protein 27 using protein transduction domain-mediated delivery on ischemia/reperfusion heart injury [J]. Biochem Biophys Res Commun, 2007, 363(2):399-404.
[14]Park JH, Yoon JH, Lim YS,et al. TAT-Hsp27 promotes adhesion and migration of murine dental papilla-derived MDPC-23 cells through beta1 integrin-mediated signaling [J]. Int J Mol Med, 2010, 26(3):373-378.
Preparation of recombinant PTD-HSP27 and verification of its ability to penetrate the cell membrane of human lens epithelial cells and rabbit cornea
LIU Lian1, YU Rong-jie2, DAI Yun2, ZENG Zhi-xing2, GUO Xiao-ling2, JI Qing-shan1, ZHONG Jing-xiang1
(1DepartmentofOphthalmology,TheFirstAffiliatedHospital,2InstituteofBiomedicalEngineering,JinanUniversity,Guangzhou510632,China.E-mail:zjx85221206@126.com)
AIM: To construct the prokaryotic expression system containing protein transduction domain (PTD) with heat shock protein 27 (HSP27) in order to prepare and purify the recombinant protein, and to verify whether the recombinant protein PTD-HSP27 has the ability to penetrate the human lens epithelial cell (HLEC) membrane and the rabbit cornea. METHODS: The plasmid pKYB-PTD-HSPB1-6His was constructed by the technique of overlap extension PCR. The plasmid was transformed and PTD-HSP27 was purified through nickel affinity chromatography column and identified by Western blotting. PTD-HSP27-6His was labeled with the fluorescein isothiocyanate (FITC). The penetrating ability of PTD-HSP27 into HLECs and rabbit cornea was tested. RESULTS: The recombinant PTD-HSP27 plasmid was successfully cloned and effectively expressed. The correctness of the recombinant protein PTD-HSP27 was demonstrated. Fluorescence microscopic examination showed that PTD-HSP27-FITC was internalized by HLECs. Fluorescent labeled PTD-HSP27 was then observed in the rabbit aqueous humor. CONCLUSION: The recombined genePTD-HSPB1 was constructed by overlap extension PCR technique and the PTD-HSP27 fusion protein was prepared and purified by nickel affinity chromatography column. Using the technique of PTD-fusion protein, HSP27 was transduced into HLECs and passed through the cornea.
Protein transduction domain; Heat shock protein 27;Trans-activators of transcription; Lens epithelial cells
1000- 4718(2015)01- 0135- 06
2014- 05- 06
2014- 11- 08
国家重点基础研究发展计划(973计划)(No. 2011CB707501); 广东省自然科学基金资助项目(No. S2013010016037)
△通讯作者 Tel: 020-38688005; E-mail: zjx85221206@126.com
R363; R77
A
10.3969/j.issn.1000- 4718.2015.01.026
