SSAO介导的氧化脱氨反应对3T3-L1脂肪细胞的氧化应激作用*
2015-04-17张琼丽罗红军林哲绚罗文鸿
张琼丽, 罗红军, 李 慧, 林哲绚, 罗文鸿
(汕头大学医学院生物分析实验室, 广东 汕头 515041)
SSAO介导的氧化脱氨反应对3T3-L1脂肪细胞的氧化应激作用*
张琼丽, 罗红军, 李 慧, 林哲绚, 罗文鸿△
(汕头大学医学院生物分析实验室, 广东 汕头 515041)
目的: 观察氨基脲敏感型胺氧化酶(SSAO)催化其底物甲胺(MA)和苯甲胺(BZA)的氧化脱氨反应对成熟3T3-L1脂肪细胞的氧化应激作用。方法: 3T3-L1前脂肪细胞诱导分化为成熟脂肪细胞;高效液相色谱法检测不同分化天数下细胞SSAO活性的变化;MTT法检测不同浓度的MA或BZA对细胞活力的影响;荧光探针方法检测细胞在药物作用下产生的活性氧;以0.5 mmol/L MA或BZA处理成熟脂肪细胞或未经诱导分化的前脂肪细胞4 h,观察细胞产生的甲醛(FA)、苯甲醛(BZ)、脂质过氧化指标丙二醛(MDA)、总超氧化物歧化酶(T-SOD)和谷胱甘肽(GSH)的变化。结果: SSAO活性随细胞分化天数的增加而增加,并于第8天达到高峰;不同浓度MA或BZA作用细胞4 h对细胞活力无显著影响(P>0.05);0.5 mmol/L MA或BZA孵育后,细胞产生的活性氧增高,约为阴性对照组的3~4倍,差异有统计学意义(P<0.05);在成熟脂肪细胞中,MDA的含量增加,而T-SOD和GSH的活性和含量减少,与阴性对照组相比,差别有统计学意义(P<0.05);MA和BZA作用未经诱导分化的前脂肪细胞,其MDA和SOD和GSH的变化不明显,差别无统计学意义(P>0.05)。结论: SSAO可能通过其介导的氧化脱氨反应引起3T3-L1成熟脂肪细胞产生氧化应激。
氨基脲敏感型胺氧化酶; 脂肪细胞; 甲胺; 苯甲胺; 氧化应激
大量的研究发现肥胖是糖尿病、胰岛素抵抗、动脉粥样硬化等疾病发生发展的危险因素之一[1-4],这可能与肥胖者体内氧化应激水平增高有关。研究表明氧化应激可以干扰胰岛素诱导的3T3-L1脂肪细胞内的胰岛素受体基质-1和磷脂酰肌醇3-激酶 (phosphatidylinositol 3-kinase,PI3K)的重分布,降低细胞膜上胰岛素受体的敏感性,并使细胞葡萄糖转运蛋白4(glucose transporter 4,GLUT-4)表达减少,这些都与胰岛素抵抗的发生有直接关系[5-6]。因此,探讨脂肪细胞氧化应激的产生因素具有科学意义。
氨基脲敏感型胺氧化酶(semicarbazide-sensitive amine oxidase, SSAO)是一类催化胺类化合物氧化脱氨,含Cu2+,并以6-羟基多巴醌为辅酶,对氨基脲敏感的胺氧化酶的统称。其反应底物主要是伯胺类化合物,催化产生相应的醛、过氧化氢及氨。有报道体内存在的甲胺,经SSAO催化生成的甲醛(formaldehyde,FA)、过氧化氢可通过协同增强氧化应激,造成血管内皮细胞损伤[7]。SSAO在成熟脂肪细胞中大量存在,且与细胞的分化程度有关。目前研究认为,SSAO在脂肪细胞中可参与葡萄糖的转运,具有类胰岛素的作用[8-10]。但其在脂肪细胞中的确切病理生理功能仍不甚清楚。由于成熟脂肪细胞高表达SSAO,而体内同时存在内源性底物(甲胺,氨基丙酮等),因此,我们猜测SSAO可能参与了脂肪细胞的氧化应激。本文以3T3-L1脂肪细胞为模型,以甲胺、苯甲胺为底物探讨SSAO在脂肪细胞中的病理生理意义。
材 料 和 方 法
1 材料和试剂
高糖DMEM培养基、胎牛血清( Hyclone);青霉素-链霉素双抗、BCA蛋白定量试剂盒(中国碧云天生物技术研究所);胰岛素、地塞米松、3-异丁基-1-甲基黄嘌呤(3-isobutyl-1-methylxanthine,IBMX)、四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)、2’,7’-二氯荧光素二乙酸酯(2’,7’-dichlorofluorescein 3’,6’-diacetate,DCFH-DA)、氯吉灵、帕吉林、苯甲胺(benzylamine,BZA)、甲胺(methylamine,MA)、2,4-二硝基苯肼(dinitrophenyl hydrazine,DNPH; Sigma);油红O、Triton X-100、胰蛋白酶(1∶250)(Amresco);丙二醛(malondialdehyde,MDA)、总超氧化物歧化酶(total superoxide dismutase, T-SOD)、谷胱甘肽(glutathione,GSH)检测试剂盒(南京建成生物工程研究所);3T3-L1前脂肪细胞株购于中国科学院上海生命科学研究院。
2 方法
2.1 3T3-L1脂肪细胞的培养、诱导分化和鉴定 在37 ℃、饱和湿度、体积分数为5%的CO2条件下,3T3-L1前脂肪细胞培养于含10% 胎牛血清、1×105U/L青霉素-1×105U/L链霉素的高糖DMEM培养基中(基础培养基),每2~3 d换液,直到细胞生长到对数生长期时用0.25%的胰蛋白酶消化细胞,进行细胞传代或接种。
将细胞接种于细胞培养板中,大约2~3 d细胞长满板底后,细胞接触抑制开始,换新鲜的基础培养基继续培养48 h后,换以含有0.5 mmol/L IBMX、0.25 μmol/L地塞米松和10 mg/ L胰岛素的基础培养液(诱导分化液Ⅰ,此时为分化第0天),60 h后更换仅含有10 mg/L胰岛素的基础培养液(诱导分化液Ⅱ)继续培养60 h,之后每2 d更换1次基础培养液,直到细胞诱导分化为成熟脂肪细胞。
油红O染色法鉴定细胞:先吸弃培养基,用PBS漂洗细胞3次,4%多聚甲醛室温下固定30 min,PBS漂洗3次,等细胞自然风干之后加入油红O工作液,室温下染色1 h,弃去染液,PBS漂洗,倒置荧光显微镜(OLYMPUS IX70-S1F2)下观察,并拍照纪录。
2.2 高效液相色谱法(HPLC)检测3T3-L1脂肪细胞SSAO活性 将细胞接种于6孔培养板中,从细胞诱导分化开始,分别在第0、1、3、5、7、8、9、10天收集细胞,超声破碎细胞,根据文献方法[11]进行酶活性的检测:取200 μL的细胞悬液于1.5 mL的EP管中,加入20 μL单胺氧化酶抑制剂,混匀,室温下孵育30 min;加入180 μL的苯甲胺,混匀,37 ℃ 水浴1 h, 之后加入100 μL三氯乙酸(trichloracetic acid,TCA)(20%W/V)终止反应,12 000 r/min 离心8 min,取300 μL上清液于5 mL的玻璃离心管中,加入50 μL的DNPH(3 g/L)混匀1 min,40 ℃ 水浴15 min,之后用乙酸乙酯萃取2次,每次1 mL, 混匀后离心5 min, 取上层液于45 ℃ 下氮气(N2)吹干,之后用500 μL乙腈-0.1%甲酸水溶液溶解,上样分析检测。
2.3 MTT检测细胞活性 将3T3-L1前脂肪细胞按1×104细胞每孔接种于96孔细胞培养板中,按上述细胞诱导分化方法将细胞诱导分化为成熟脂肪细胞,含0.5% 牛血清白蛋白(bovine serum albumin,BSA)的DMEM(无血清)培养基孵育细胞6 h,之后换以含0.1 mmol/L、0.25 mmol/L、0.5 mmol/L、1 mmol/L、3 mmol/L的MA或BZA的无血清培养基分别孵育细胞4 h、12 h、24 h,以等体积溶剂作为阴性对照组,每组设5个复孔。孵育结束后,每孔加入20 μL MTT(5 g/L)溶液,继续孵育4 h,吸弃培养基,每孔加入200 μL的二甲基亚砜(DMSO)溶解结晶,低速摇匀10 min后,酶标仪(Thermo)490 nm处测定吸光值(A)。按以下公式计算细胞活力:处理组A/对照组A×100%。
2.4 DCFH-DA检测细胞的活性氧簇(reactive oxygen species, ROS)的水平 将3T3-L1前脂肪细胞接种于24孔细胞培养板中,按上述方法诱导细胞分化为成熟脂肪细胞后,预孵含0.5% BSA的DMEM(无血清)培养基6 h,之后用不同浓度MA或BZA(0、0.1、0.25、0.5 mmol/L)与20 μmol/L DCFH-DA荧光染料共同孵育细胞1 h,PBS洗3次后,各孔加入500 μL 0.1% Triton X-100,摇床裂解10 min,收集裂解液,离心取上清。用荧光分光光度计(RF-5000,SHIMADZU)在485 nm激发波长和530 nm发射波长下检测荧光强度。同时与未诱导分化的前脂肪细胞做对比。
2.5 甲醛或苯甲醛和脂质过氧化指标的检测 将3T3-L1前脂肪细胞接种于6孔培养板中,按上述方法将细胞诱导分化为成熟脂肪细胞后,预孵含0.5% BSA的DMEM(无血清)培养基6 h,之后用含0.5 mmol/L MA或BZA的无血清培养基孵育细胞4 h,孵育结束后,在冰上,PBS洗3次,用细胞刮铲收集细胞于1.5 mL的EP管中,3 500 r/min离心5 min,弃上清,PBS重悬细胞,超声破碎细胞,制成细胞悬液。
将细胞悬液按照参考文献[11-12]的方法检测细胞内甲醛(FA)或苯甲醛(benzaidehyde,BZ)的含量。取200 μL细胞悬液于带盖螺口玻璃瓶,加入800 μL双蒸水,100 μL氨苄西林水溶液(2.5 g/L)和250 μL TCA,旋紧瓶盖后振荡30 s,90 ℃水浴1 h后;冰浴30 min,将瓶内物质完全转移到离心管中,加入约0.5 g NaCl,振荡1 min,2 000 r/min离心5 min,取上层液,用乙醚再萃取1次,合并2次萃取液于40 ℃下N2吹干,之后用500 μL乙腈-0.01%甲酸水溶液(50∶50,V/V)溶解,上样分析检测甲醛含量。取200 μL细胞悬液于1.5 mL的EP管中,加入200 μL PBS混匀后,加入100 μL TCA漩涡混匀30 s,12 000 r/min离心8 min,取300 μL上清液于离心管中,加入50 μL DNPH混匀1 min,40 ℃水浴15 min,之后用乙酸乙酯萃取2次,混匀后离心,取上层液于45 ℃下N2吹干,之后用乙腈-0.1%甲酸水溶液溶解,上样分析检测苯甲醛含量。
将上述处理的细胞按MDA、T-SOD、GSH检测试剂盒(南京建成生物科技有限公司)上说明书的方法对样本进行脂质过氧化指标的检测和分析,不加药的为阴性对照组,每组设3个复孔。同时与未诱导分化的前脂肪细胞做对比。
3 统计学处理
实验数据以均数±标准差(mean±SD)表示,组间比较采用SPSS 13.0软件进行单因素方差分析(one-way ANOVA)。以P<0.05为差异有统计学意义。
结 果
1 3T3-L1细胞诱导分化及鉴定
未诱导分化的前脂肪细胞呈现纤维型,胞质中不含脂滴(图1A);经诱导分化8 d左右,有95%以上的细胞呈现成熟脂肪细胞表型,细胞内有大量脂滴,并环绕于胞膜内,呈指环状(图1B);经油红O染色可见脂肪细胞内大量柚红色颗粒(图1C)。
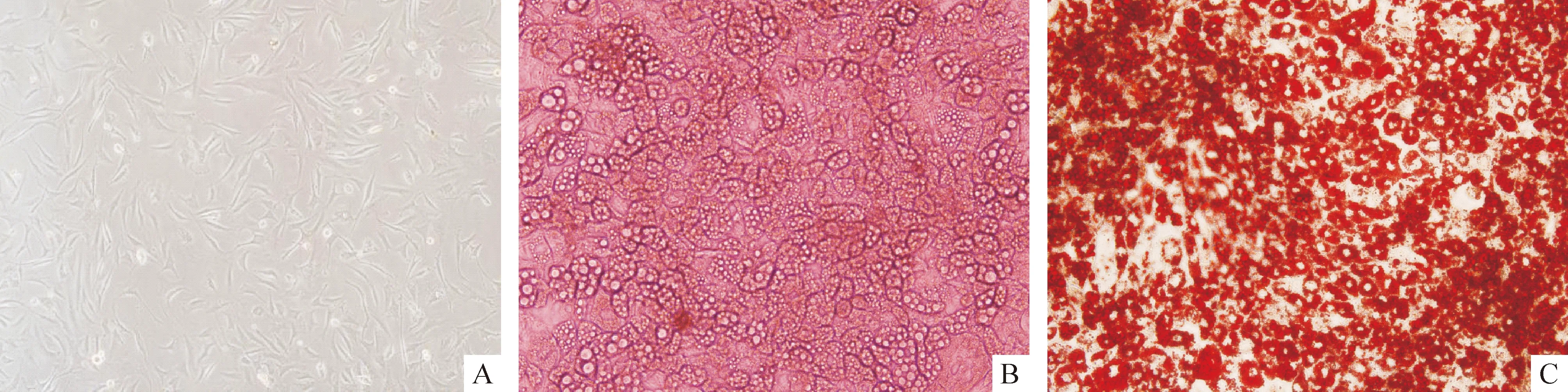
Figure 1.Morphologies of 3T3-L1 cells. A: 3T3-L1 cells before differentiation; B: adipocyte of 8th d after differentiation; C: adipocytes stained with oil red O.
2 3T3-L1 细胞诱导分化过程中SSAO活性的变化
诱导分化的前3 d,酶活性无明显变化,第5天开始,细胞的SSAO活性显著升高,第8~9天,酶活性达到最高,之后又呈下降的趋势,第8天和第9天差别无统计学意义,第3天之后的每一组均显著高于未诱导分化组(第0天)(P<0.01)。本实验细胞选择诱导分化到第8天的细胞进行实验,此时SSAO活性较高,见图2。
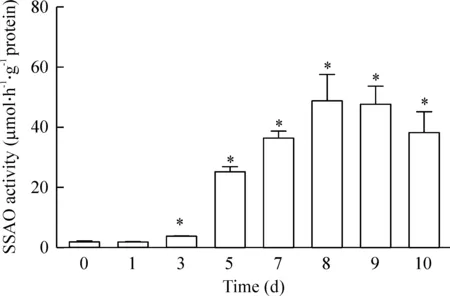
Figure 2.The alteration of SSAO activity during 3T3-L1 cells differentiation. Mean±SD. n=3. *P<0.05 vs 0 d.
3 SSAO底物MA和BZA对成熟脂肪细胞活力的影响
3 mmol/L MA孵育12 h和0.5、1及3 mmol/L MA孵育24 h均显著降低细胞活力(P<0.05);3 mmol/L BZA孵育4 h和12 h与0.1 mmol/L~3 mmol/L BZA孵育24 h也显著降低细胞活力(P<0.05)。其余各浓度和时点的MA、BZA作用均对细胞活力无显著影响(P>0.05),见表1。
4 MA和BZA对3T3-L1细胞ROS产生的影响
和阴性对照组相比,0.1~0.5 mmol/L MA和BZA引起成熟脂肪细胞ROS显著增加(P<0.05),并呈剂量依赖性,0.5 mmol/L MA和BZA活性氧为阴性对照组的3倍左右。但和阴性对照组比较,0.5 mmol/L MA和BZA对未诱导分化的前脂肪细胞活性氧产生无显著差异(P>0.05)。后续实验选用无明显细胞毒性的0.5 mmol/L的底物作用细胞4 h,见图3。
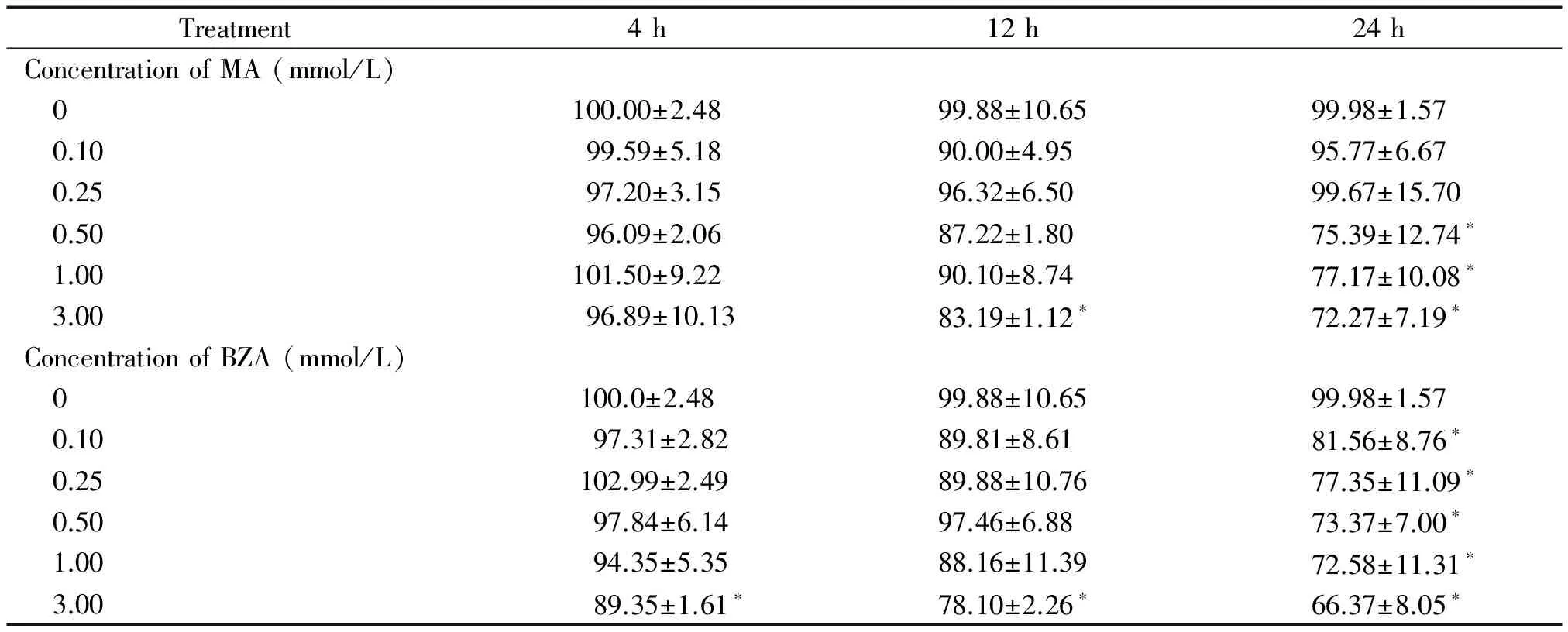
表1 SSAO底物MA或BZA 作用4、12、24 h对脂肪细胞活力的影响
*P<0.05vs0 mmol/L group.
5 SSAO介导MA和BZA分别产生FA和BZ
0.5 mmol/L MA作用4 h细胞后,与阴性对照组相比,细胞产生的FA含量增加,差别有统计学意义(P<0.05)。0.5 mmol/L BZA作用4 h细胞后,细胞及培养基中BZ含量均增加,与对照组比较,差别有统计学意义(P<0.05),见表2、3。
6 SSAO底物对成熟脂肪细胞和未诱导分化的前脂肪细胞MDA和T-SOD、GSH的影响
在成熟脂肪细胞中,与对照组相比,MA或BZA组对细胞MDA的产生、T-SOD活力和GSH含量变化都有显著差异(P<0.05),0.5 mmol/L MA和BZA显著增加细胞MDA含量(P<0.05),并降低T-SOD活力(P<0.05)。MA组MDA含量比对照组增加约3倍,BZA组约增加4倍;T-SOD活力均减少30%左右;MA处理过的细胞GSH含量比对照组减少约30%,BZA组减少一半左右。在未诱导分化的前脂肪细胞中,与对照组相比,MA和BZA组细胞MDA的产生、T-SOD活力和GSH含量均无显著差异(P>0.05),见图4。
讨 论
SSAO主要以2种方式存在于人和动物的体内,一种是以游离形式存在于血液中,另一种是以膜结合型形式存在于组织中,尤以脂肪细胞、平滑肌细胞、血管内皮细胞的SSAO含量丰富[13-15]。本实验表明,3T3-L1小鼠胚胎成纤维细胞在诱导分化为成熟脂肪细胞过程中,细胞表达SSAO增高从而表现出逐渐升高的酶活性,该实验结果与以往报道相符[16]。SSAO的反应底物主要是伯胺类化合物,目前发现内源性底物有甲胺和氨基丙酮等。甲胺主要来源于体内肌酸、胆碱、肾上腺素代谢,也可从饮食或吸烟中摄入;而氨基丙酮则由苏氨酸和甘氨酸代谢产生。甲胺在体内组织和尿液均有存在[17]。体内胺类物质并无明显毒性,但胺在SSAO存在的情况下可产生活性氧及醛类[18]。甲醛可增强体内蛋白糖基化,引起DNA蛋白交联,具有较强的细胞毒性,被认为与一些重大疾病相关。此外,它可以与过氧化氢发生协同作用造成血管内皮细胞损伤[7]。有研究证明SSAO及其代谢产物与内分泌或心血管疾病的发生密切相关,如糖尿病、胰岛素抵抗、动脉粥样硬化等[19-21]。
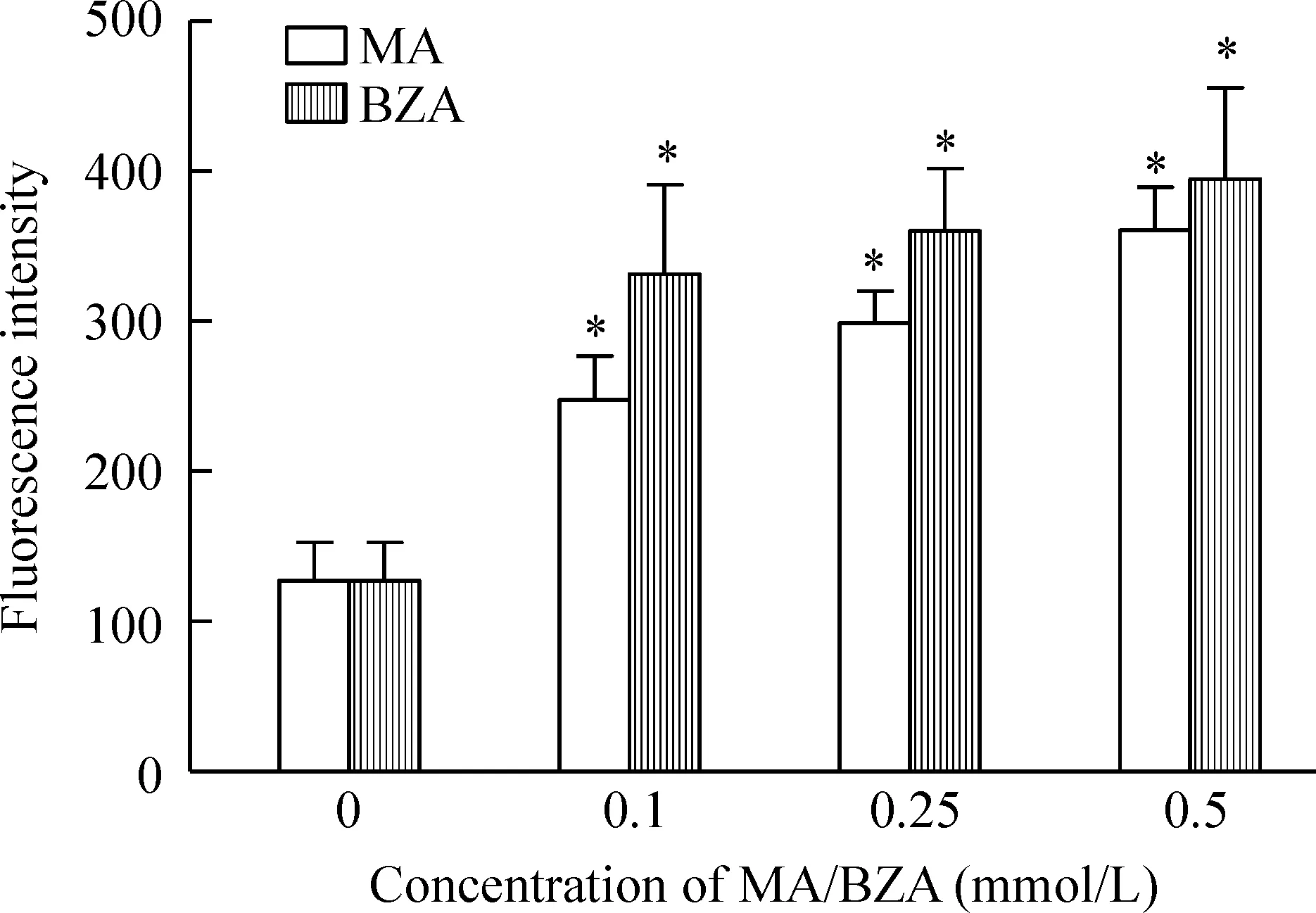
Figure 3.Production of ROS after exposure of 3T3-L1 mature adipocytes to MA or BZA. Mean±SD. n=3. *P <0.05 vs 0 mmol/L group.
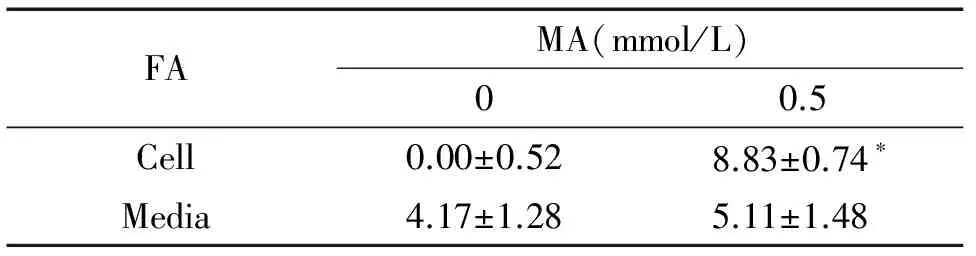
表2 SSAO介导其底物甲胺产生甲醛
*P<0.05vs0 mmol/L group.
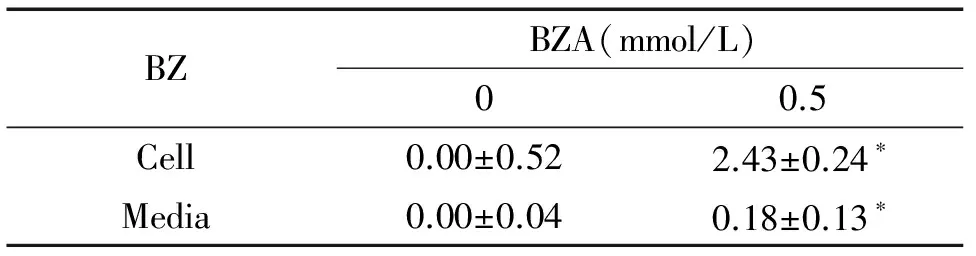
表3 SSAO介导其底物苯甲胺产生苯甲醛
*P<0.05vs0 mmol/L group.
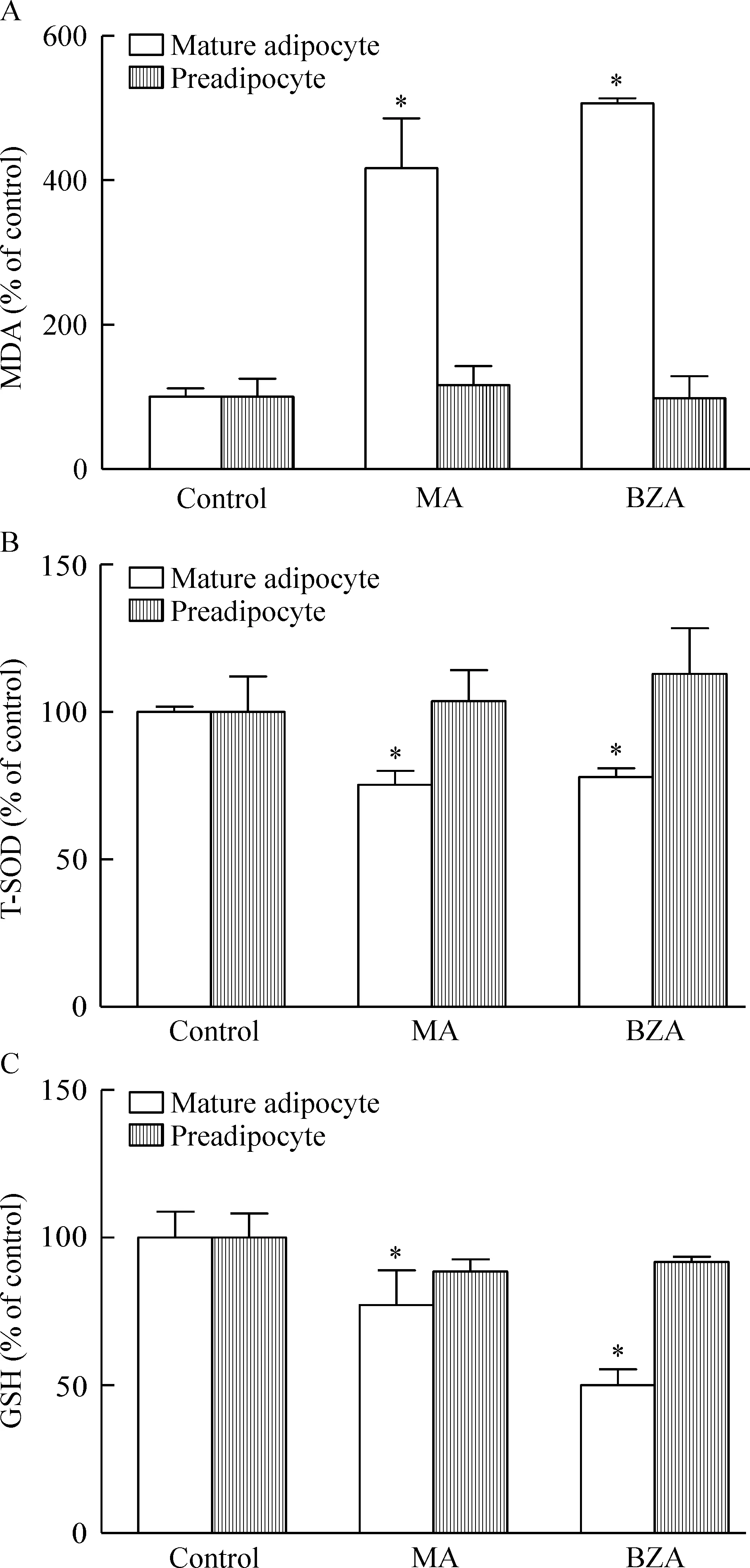
Figure 4.Effects of SSAO substrates MA,BZA on oxidative stress in the preadipocytes and adipocytes. After exposure to 0.5 mmol/L MA or BZA for 4 h, MDA(A), T-SOD(B) and GSH(C) in the adipocytes or preadipocytes were measured. Mean±SD. n=3. *P<0.05 vs control group.
机体代谢过程中可不断地通过酶促反应或非酶促反应产生活性氧,在生理条件下,活性氧的生成和清除处于一个动态平衡的状态。当体内受内源性或外源性刺激,可发生代谢异常,导致大量活性氧自由基产生或抗氧化物质不足,使生理条件下氧化与抗氧化系统间的动态平衡被打破,进而使机体处于氧化应激状态,氧化损伤生物分子,进一步引起细胞死亡和组织损伤,这与很多病理过程相关,如肥胖、糖尿病、动脉粥样硬化等[22]。肥胖相关的一些病症是一个长期慢性的过程,而内源性胺类物质体内浓度不高,因此研究胺类物质的短期急性细胞毒性并无太大的临床意义。本文通过MTT实验确定一个在不显著影响细胞活力的情况下[在较低的底物浓度(0.5 mmol/L)和较短的培养时间(4 h)],研究药物对细胞氧化应激的影响,看细胞内氧化应激系统的变化,包括氧化应激代谢产物中的脂质过氧化产物——丙二醛,抗氧化防御系统中的抗氧化酶——超氧化物歧化酶和非酶抗氧化剂——谷胱甘肽,这3个指标可从不同角度反映机体脂质过氧化程度和抗氧化能力的变化。细胞在处于氧化应激压力下并不一定会快速出现活力下降或凋亡坏死,但氧化应激长期存在可能会通过改变细胞正常功能、影响细胞代谢等,从而影响机体健康。
本研究发现0.5 mmol/L MA或BZA可引起高表达SSAO的成熟脂肪细胞产生活性氧并可检测到甲醛、苯甲醛代谢产物的生成,说明该过程中与SSAO的氧化脱氨反应有关。不同浓度BZA产生的细胞活性氧的量都比相应浓度的MA要稍微高些,这可能与BZA对SSAO的亲和力比MA强有关。本研究通过进一步实验发现0.5 mmol/L MA或BZA作用细胞4 h可引起MDA含量增高,说明细胞存在脂质过氧化;而T-SOD和GSH活性降低,表明脂肪细胞抗氧化能力下降。但这种现象在不表达SSAO酶活性的前脂肪细胞中并未出现。
本实验中,在细胞活力还没有显著下降时,药物可增强成熟脂肪细胞氧化应激,并通过高表达SSAO的成熟脂肪细胞和不表达SSAO的前脂肪细胞的氧化应激指标的对比,推断SSAO介导的胺类底物氧化脱氨参与了脂肪细胞的氧化应激,从而有可能参与了脂肪细胞氧化损伤相关疾病的发生。
本实验结果提示SSAO可介导其底物发生的氧化脱氨反应产生活性代谢物,从而引起细胞氧化应激损伤。该研究提示SSAO可能作为对抗脂肪细胞氧化应激损伤的靶点,可通过应用特异性SSAO抑制剂减缓与肥胖相关的代谢综合症的发生发展。
[1] Hubert HB, Feinleib M, McNamara PM, et al. Obesity as an independent risk factor for cardiovascular disease: a 26-year follow-up of participants in the Framingham Heart Study[J]. Circulation,1983, 67(5):968-977.
[2] Stevens J, Cai J, Pamuk ER, et al. The effect of age on the association between body-mass index and mortality[J]. N Engl Med, 1998, 338(1):1-7.
[3] Rao SV, Donahue M, Pi-Sunyer FX, et al. Results of expert meetings: obesity and cardiovascular disease. Obesity as a risk factor in coronary artery disease[J]. Am Heart, 2001, 142(6):1102-1107.
[4] Kamigaki M, Sakaue S, Tsujino I, et al. Oxidative stress provokes atherogenic changes in adipokine gene expression in 3T3-L1 adipocytes[J]. Biochem Biophys Res Commun, 2006, 339(2):624-632.
[5] Rudich A, Kozlovsky N, Potashnik R, et al. Oxidant stress reduces insulin responsiveness in 3T3-L1 adipocytes[J]. Am J Physiol Endocrinol Metab, 1997, 35(5): E935-E940.
[6] Tirosh A, Potashnik R, Bashan N, et al. Oxidative stress disrupts insulin-induced cellular redistribution of insulin receptor substrate-1 and phosphatidylinositol 3-kinase in 3T3-L1 adipocytes[J]. J Biol Chem, 1999, 274(15):10595-10602.
[7] Lin Z, Luo WH, Li H, et al. The effect of endogenous formaldehyde on the rat aorta endothelial cells[J]. Toxicol Lett, 2005, 159( 2):134-143.
[8] Enrique-Tarancón G, Castan I, Morin N, et al. Substrates of semicarbazide-sensitive amine oxidase co-operate with vanadate to stimulate tyrosine phosphorylation of insulin-receptor-substrate proteins, phosphoinositide 3-kinase activity and GLUT4 translocation in adipose cells[J]. Biochem, 2000, 350(1):171-180.
[9] El Hadri K, Moldes M, Mercier N, et al. Semicarbazide-sensitive amine oxidase in vascular smooth muscle cells: differentiation-dependent expression and role in glucose uptake[J]. Arterioscler Thromb Vasc Biol, 2002, 22(1):89-94.
[10]Smith DJ, Salmi M, Bono P, et al. Cloning of vascular adhesion protein 1 reveals a novel multifunctional adhesion molecule[J]. J Exp Med, 1998, 188(1):17-27.
[11]Li H, Luo W, Lin J, et al. Assay of plasma semicarbazide-sensitive amine oxidase and determination of its endogenous substrate methylamine by liquid chromatography[J]. Chromatogr B Analyt Technol Biomed Life Sci, 2004, 810(2):277-282.
[12]Luo W, Li H, Zhnag Y, et al. Determination of formaldehyde in blood plasma by high-performance liquid chromatography with fluorescence detection[J]. Chromatogr B, 2001, 753(2):253-257.
[13]Lizcano JM, de Arriba AF, Tipton KF, et al. Inhibition of bovine lung semicarbazide-sensitive amine oxidase (SSAO) by some hydrazine derivatives[J]. Biochem Pharmacol, 1996, 52(2):187-195.
[14]Holt A, Alton G, Scaman CH, et al. Identification of the quinone cofactor in mammalian semicarbazide-sensitive amine oxidase[J]. Biochemistry, 1998, 37(14):4946-4957.
[15]Peter HY, Shannon W, Ellen H, et al. Physiological and pathological implications of semicarbazide-sensitive amine oxidase[J]. Biochim Biophys Acta, 2003,1647(1-2):193 -199.
[16]Zhu S, Li QR, Du Y, et al .Toxicity of derivatives from semicarbazide-sensitive amine oxidase-mediated deamination of methylamine against Toxoplasma gondii after infection of differentiated 3T3-L1 cells[J]. Toxicology In Vitro, 2010, 24(3): 809-814.
[17]Yu PH, Davis BA, Deng Y. 2-Bromoethylamine as a potent selective suicide inhibitor for semicarbazide-sensitive amine oxidase[J]. Biochem Pharmacol, 2001, 61( 6):741-748.
[18]Valente T, Gella A, Sole M, et al. Immunohistochemical study of semicarbazide-sensitive amine oxidase/vascular adhesion protein-1 in the hippocampal vasculature: pathological synergy of Alzheimer’s disease and diabetes mellitus[J]. J Neurosci Res, 2012, 90(10):1989-1996.
[19]Iffiú-Soltész Z, Mercader J, Daviaud D, et al. Increased primary amine oxidase expression and activity in white adipose tissue of obese and diabeticdb-/-mice[J]. J Neural Transm, 2011, 118(7):1071-1077.
[20]Nunes SF, Figueiredo IV, Pereira JS, et al. Monoamine oxidase and semicarbazide-sensitive amine oxidase kinetic analysis in mesenteric arteries of patients with type 2 diabetes[J]. Physiol Res, 2011, 60(2):309-315.
[21]Lyles GA. Mammalian plasma and tissue-bound semicarbazide-sensitive amine oxidases: biochemical, pharmacological and toxicological aspects[J]. Int J Biochem Cell Biol, 1996, 28(3):259-274.
[22]王秋林, 王浩毅, 王树人. 氧化应激状态的评价[J]. 中国病理生理杂志, 2005, 21(10):2069-2074.
NOD2通过IRF4抑制RICK和TRAF6的K63多聚泛素化而减轻结肠炎症
现已证实,半胱氨酸天冬氨酸酶(caspase)活化和募集结构域15(recruitment domain 15, CARD15)基因(克罗恩病的主要危险因素)的多态性可导致核苷酸结合寡聚化结构域2(nucleotide-binding oligomerization domain 2, NOD2)功能丧失。然而,这种功能丧失是如何导致克罗恩病的易感性增加,其分子机制尚不清楚。已知人类树突状细胞中活化的NOD2可通过其配体胞壁酰二肽(muramyl dipeptide, MDP)减轻Toll样受体(Toll-like receptor, TLR)介导的炎症反应。Watanabe等发现,NOD2活化可使干扰素调节因子4(interferon regulatory factor 4, IRF4)表达增加,并与肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor associated factor 6, TRAF6)和受体相互作用丝氨酸-苏氨酸激酶(receptor interacting serine-threonine kinase, RICK)结合。这种结合导致TRAF6和RICK的第63位赖氨酸(K63)相关多聚泛素化(polyubiquitination)被抑制,该抑制作用由IRF4介导,从而下调NF-κB的活化。该研究还证实,通过给予MDP或IRF4可以阻止小鼠实验性结肠炎的进展,这种保护作用与小鼠结肠固有层单个核细胞中IRF4介导的TRAF6和RICK多聚泛素化的抑制有关。因此,这些发现可以解释NOD2介导的针对肠道菌群的固有免疫应答的调节机制,并由此阐明CARD15多态性与所导致的NOD2功能紊乱在克罗恩病中的关系。
Mucosal Immunol, 2014, 7(6):1312-1325(周 晗)
Effect of deamination reaction mediated by semicarbazide-sensitive amine oxidase on 3T3-L1 adipocytes
ZHANG Qiong-li, LUO Hong-jun, LI Hui, LIN Zhe-xuan, LUO Wen-hong
(BioanalyticalLaboratory,ShantouUniversityMedicalCollege,Shantou515041,China.E-mail:whluo@stu.edu.cn)
AIM: To observe the effect of the metabolites generated from oxidative deamination of methylamine (MA) or benzylamine (BZA) catalyzed by semicarbazide-sensitive amine oxidase (SSAO) on 3T3-L1 adipocytes. METHODS: 3T3-L1 preadipocytes were induced to differentiation. SSAO activity was determined by high performance liquid chromatography (HPLC) at different differentiation time points. MTT assay was applied to detect cell vitality after exposure to different concentrations of MA or BZA. Fluorescence probe DCFH-DA was used to determine the production of reactive oxygen species after incubation of 3T3-L1 adipocytes with MA or BZA. After exposure to 0.5 mmol/L MA or BZA for 4 h, malondialdehyde (MDA), total superoxide dismutase (T-SOD) and glutathione (GSH) in the adipocytes or preadipocytes were measured. RESULTS: SSAO activity increased with the increase in the differentiation days, and reached a maximum at the 8th day. Incubation of the cells with different concentrations of MA or BZA for 4 h did not significantly decreased the cell vitality (P>0.05). After exposure to 0.5 mmol/L MA or BZA, the reactive oxygen species in adipocytes significantly increased, and were about 3 to 4 times as compared with control group (P<0.05). After treatment with 0.5 mmol/L MA or BZA for 4 h, MDA content significantly increased, while the activity of SOD and the expression of GSH decreased in mature adipocytes compared with control group (P<0.05). However, MDA, T-SOD and GSH did not change significantly after treatment with equal molar of MA or BZA in the preadipocytes (P>0.05). CONCLUSION: MA or BZA induces oxidative stress in the mature adipocytes, which might result from the deamination products catalyzed by SSAO.
Semicarbazide-sensitive amine oxidase; Adipocytes; Methylamine; Benzene methylamine; Oxidative stress
1000- 4718(2015)03- 0468- 07
2014- 10- 16
2014- 11- 14
国家自然科学基金资助项目(No. 81170315); 广东省自然科学基金团队资助项目(No. 9351507102000-001)
△通讯作者 Tel:0754-8900532; E-mail: whluo@stu.edu.cn
R363
A
10.3969/j.issn.1000- 4718.2015.03.015
