嗜热脂肪芽孢杆菌热失活模型的初步建立
2015-04-14韩孔艳赵改名高晓平李苗云柳艳霞张秋会赵莉君孙灵霞黄现青
韩孔艳,赵改名,高晓平,李苗云,柳艳霞,张秋会,赵莉君,孙灵霞,黄现青
(河南农业大学食品科学技术学院,河南省肉制品加工与质量安全控制重点试验室,河南郑州450002)
微生物是影响肉品货架期的主要因素[1-2]。传统食品工业采用的杀菌方法主要是热杀菌,随着食品工业的发展,国内外诸多学者研究了一系列新的杀菌技术,如微波杀菌、辐照杀菌、超高压处理等[3-6],而热杀菌因其成本低、安全系数高等优点,依然是国内肉制品企业最普遍应用的杀菌方法[7]。大多数肉制品在生产过程中会受到一些非致病性芽孢杆菌、嗜热菌和耐高温微生物的污染[8],即使经过热杀菌,一些嗜热菌及强耐热性芽孢仍会残存于产品中[9-10],典型的如嗜热脂肪芽孢杆菌(Geobacillus stearothermophilus)及其芽孢。嗜热脂肪芽孢杆菌是引起低酸性食品酸败的主要菌种[11],被作为验证湿热灭菌程序的生物指示剂[12],热刺激等不利环境条件易诱导其芽孢萌发,芽孢在食品中萌发、生长、繁殖的过程也会导致食品的腐败[13]。为了彻底杀灭此类嗜热菌及芽孢,理论上需要高强度的热处理[14-15],但这样容易导致产品色泽、质构劣化,营养成分破坏[16],目前国内肉制品企业多采用巴氏杀菌及100℃以下的高温杀菌。目前,国内外关于100℃以下嗜热菌热失活情况的研究报道较少,因此探究嗜热菌在100℃以下的热失活规律具有重要意义。为此,本研究对嗜热脂肪芽孢杆菌(Geobacillus stearothermophilus)在70、80、90℃热处理中心温度下的失活规律进行了研究,初步建立了各温度的热失活模型,旨在为企业选择恰当的热杀菌条件提供更好的理论依据。
1 材料与方法
1.1 试验材料
嗜热脂肪芽孢杆菌ATCC 7953,购自Mecconti菌株MrcroSwabs系列;营养肉汤(NB)、营养琼脂(NA)培养基,购自青岛海博生物技术有限公司。
1.2 试验器材
蒸汽压力灭菌锅HVE-50,日本HIRAYAMA公司;台式恒温震荡器THZ-C,太仓市华美生化仪器厂;洁净工作台SW-CJ-2F,苏州安泰空气技术有限公司;涡旋振荡器VORTEX-2GENIE,美国Scientific Industries公司;水浴锅THZ-82,金坛市杰瑞尔电器有限公司;中心温度计,美国Delta TRAK公司;生化培养箱SPX-1505H-Ⅱ,上海新苗医疗器械公司。
1.3 试验方法
1.3.1 热处理菌液的准备 将嗜热脂肪芽孢杆菌扩增培养18 h,达到稳定期,此时细菌的体积个数为108CFU·mL-1,取10 mL该增菌液加入90 mL蒸馏水中,震荡均匀即得到体积个数为107CFU·mL-1的菌液。取1 mL此菌液于1.5 mL离心管中,热处理备用。
1.3.2 热处理 将离心管置于水浴锅中,利用中心温度计将菌液中心温度分别控制在70、80、90℃,菌液达到设定的中心温度后开始计时,到达设定的热处理时间后结束计时取出离心管,热处理后将离心管放在冰水中冷却5 min。每个时间点取3个平行样。
1.3.3 活细胞计数 参考6×6点样法[17],取100 μL菌液于1.5 mL灭菌的离心管(内装有900 μL灭菌蒸馏水)中,按1∶10进行倍比稀释,选取4个合适的稀释度,取10 μL点在倒有培养基的平板上进行微生物测定,每个稀释度4个平行,每个样品做3个平行。平板置于56℃培养箱中培养18 h~24 h,然后计数。
1.3.4 致死率计算

1.4 数据分析
采用Excel分别计算每个样品微生物取对数值后的平均值[平均log()],每个样品微生物取平均值后的对数值(n),微生物平均值的估计值(logA).

S.D:标准差
采用Origin 8.0软件作图并拟合生长曲线、热失活曲线和升温曲线。
2 结果与分析
2.1 不同中心温度热处理0~60 min
在70、80、90℃3个中心温度下,初步设定热处理时间为0~60 min,每5 min为1个梯度,共12个梯度。菌液热处理后的残存菌数量及致死率如图1、图2所示。
由图1、图2可知,在70、80、90℃ 3个不同的中心温度条件下,嗜热脂肪芽孢杆菌的热失活规律一致:在热处理时间为5 min时,菌液浓度大幅降低,分别从初始的 7.53、7.68、7.45 个数量级下降到5.01、4.11、3.85 个数量级,相应地,5 min 时致死率较高,分别为 33.42%、46.43%、48.33%;之后随着热处理时间的延长,细菌体积个数在很小范围内上下波动,到60 min时残存菌数量分别为4.89、3.96、3.62 个数量级,致死率分别为35.02%、48.43%、51.38%,变化幅度不大。该规律与 JAN等[18]关于110、115、121 ℃ 3个温度条件下嗜热脂肪芽孢杆菌(ATCC10149)孢子的热失活规律相一致。出现这一结果的原因,可能是细菌在进入高温环境的最初阶段对环境的不适应性导致其较多地死亡,但由于嗜热脂肪芽孢杆菌本身是耐热菌,适应环境所需时间短,且在这短暂的阈值时间内高温诱导芽孢萌发,残存的菌体也会转变成芽孢,以上过程完成后菌液浓度基本不再变化。本试验结果表明阈值时间在5 min之内,故后续采用逐渐缩小热处理时间范围的方法,探究阈值时间的具体时间并初步建立这一时间的热失活模型。
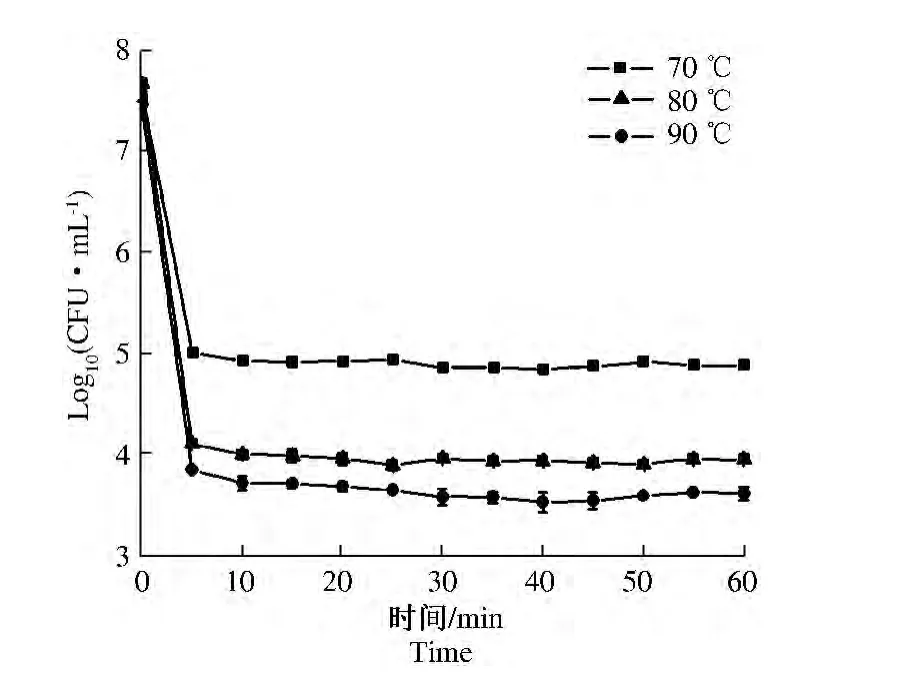
图1 70、80、90℃热处理0~60 min后的残存菌数量Fig.1 The residual amount of 0 ~60 min at 70,80,90 ℃

图2 70、80、90℃热处理0~60 min后的致死率Fig.2 The death rate of 0~60 min at 70,80,90 ℃
2.2 不同中心温度热处理0~5 min
鉴于2.1的研究,将热处理时间设定为0~5 min,梯度为1 min,试验结果如图3、图4所示。

图3 70、80、90℃热处理0~5 min后的残存菌数量Fig.3 The residual amount of 0 ~5 min at 70,80,90 ℃

图4 70、80、90℃热处理0~5 min后的致死率Fig.4 The death rate of 0~5 min at 70,80,90 ℃
从图3、图4可以看出,热处理时间为1 min时,70、80、90℃3个热处理温度下的菌液体积个数均已大幅降低,从初始的7.56个数量级分别下降到5.04、4.11、3.99 个数量级,相应的致死率分别为 33.38%、45.68%、47.19%,之后菌液浓度基本稳定不变。因此阈值时间仅在达到中心温度后的1 min内,为了得到更准确的时间范围,热处理时间被缩短至1 min以内。
2.3 不同中心温度热处理0~1 min
将热处理时间设定为0~1 min,梯度为10 s,试验结果见图5、图6。
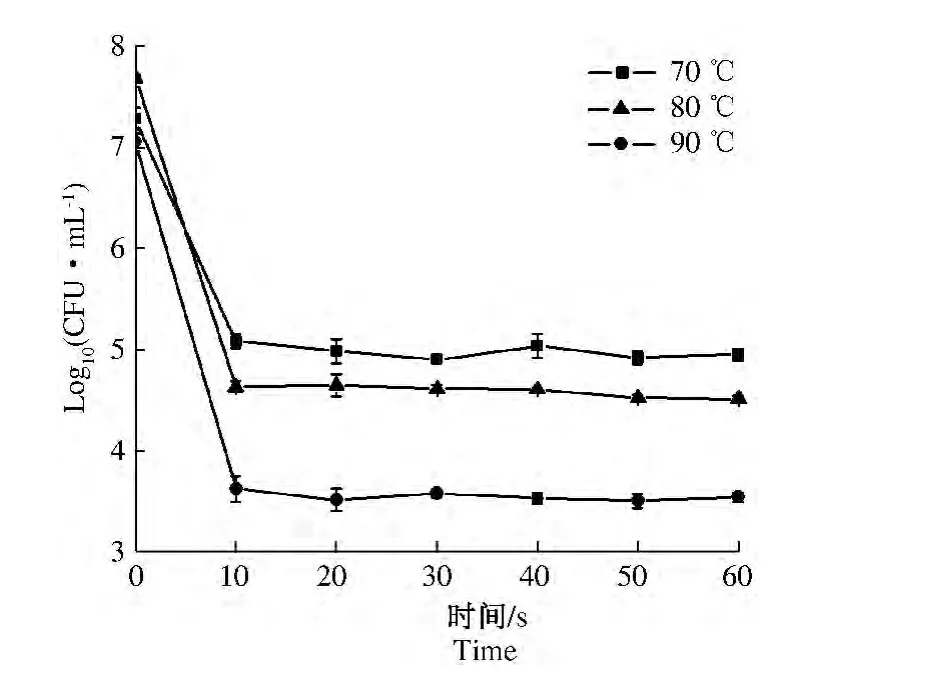
图5 70、80、90℃热处理0~1 min后的残存菌数量Fig.5 The residual amount of 0 ~1 min at 70,80,90 ℃
由图5、图6可知,热处理时间为10 s时,70、80、90℃ 3个热处理温度下的菌液浓度分别从初始的7.29、7.70、7.06 个数量级下降到5.09、4.64、3.62个数量级,相应地致死率分别为30.15%、39.76%、48.91%,之后菌液浓度基本稳定不变。由此推断菌体失活及芽孢萌发等过程在菌液达到中心温度之前已经完成。

图6 70、80、90℃热处理0~1 min后的致死率Fig.6 The death rate of 0~1 min at 70,80,90 ℃
2.4 达到中心温度前的热处理结果
从离心管置入水浴锅瞬间开始计时,首先测定了菌液达到不同中心温度前的温度变化,并利用Origin 8.0软件中的Hill1模型拟合绘制了升温曲线,如图 7所示。拟合方程为 T=START+(START-END)×tn/(kn+tn),各升温曲线的具体拟合方程及拟合参数见图7,70、80、90℃的判定系数 R2分别为0.999 2、0.998 1、0.994 0。由图7 可得,各温度均能在150 s之内完成升温,菌液中心温度达到70、80、90℃之前的0 ~40 s升温非常迅速,40 s时分别达到 56.0、64.5、75.0 ℃,但不同温度的升温速率不同,90℃最高,80℃其次,70℃最低;之后各菌液中心温度持续缓慢上升,升温速率依然是90℃ >80℃ >70℃,最后完成升温过程的时间顺序恰好相反,70℃为90 s,80℃为110 s,而90℃为140 s。
根据达到中心温度前各时间点的菌液残存菌数量绘制出的失活曲线如图8所示,各失活曲线均可用Origin 8.0软件中的Exponential模型拟合,拟合方程为y=y0+A×exp(R0×t),各模型具体拟合方程及拟合参数见图8,70、80、90℃的判定系数R2分别为 0.982 9、0.952 9、0.994 4。由图 8 可知,各温度下的菌液浓度在0~40 s下降迅速,这与升温曲线0~40 s升温最迅速一致,40~90 s各温度的菌液浓度仍持续下降,但下降速度较前40 s明显降低,90 s之后,70℃的菌液浓度基本达到稳定,80、90℃条件下的菌液浓度仍以较低的速率下降,到150 s时也都基本恒定。由此确定各菌液在达到中心温度之前均已完成菌体失活、芽孢萌发、残存菌体转变成芽孢等变化,但对于各变化的发生机制仍有待进一步研究。
菌液达到各中心温度前各时间点对应的致死率见图9,因变化幅度相对较大而无法拟合模型,但仍可看出其与升温曲线具有基本相同的趋势。0~80 s,升温速率越快,相同时间点的温度就越高,致死率也越高,因此企业要想提高杀菌效率,除了传统的升高杀菌温度方法外,加快升温速率也是关键。残存菌数量达到稳定值时,70、80、90℃的致死率分别为31.73%、40.07%、51.07%,温度越高致死率越高。
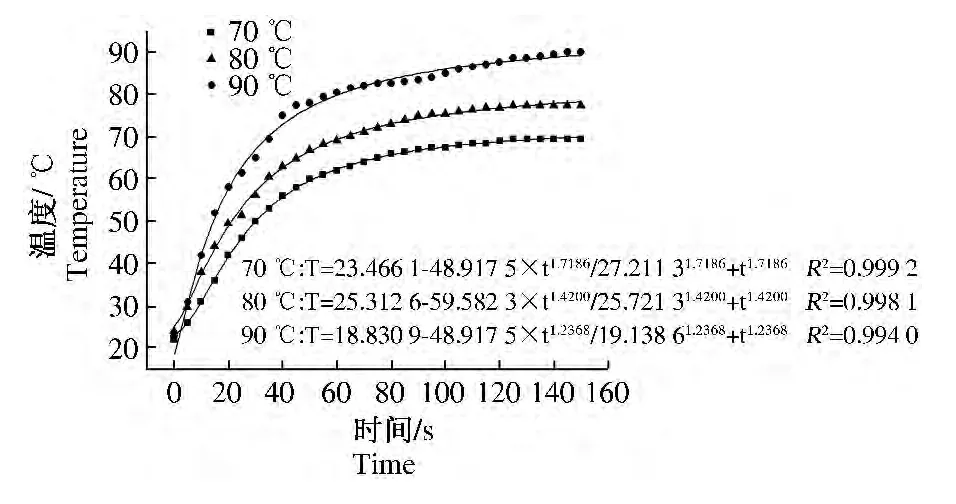
图7 达到各中心温度前的升温曲线Fig.7 The heating curves of 70,80,90 ℃ before reaching the center temperature

图8 达到各中心温度前的失活曲线Fig.8 The inactivation curves of 70,80,90 ℃ before reaching the center temperature

图9 达到各中心温度前的致死率Fig.9 The death rate of 70,80,90 ℃ before reaching the center temperature
综上表明,嗜热脂肪芽孢杆菌菌液在进行不同温度热处理时,达到中心温度之前的短暂时间(150 s)内即会形成一定数量的芽孢。肉制品经过巴氏杀菌及100℃以下高温杀菌之后仍有嗜热脂肪芽孢杆菌芽孢残存,且残存菌数量不会随着杀菌时间的延长而降低。该结果与传统观念上的热杀菌时间越长,杀菌效果越好不符。这可能是由于高温恶劣条件诱导了芽孢快速萌发,但萌发机制仍有待深入研究。
3 结论
嗜热脂肪芽孢杆菌 ATCC7953在70、80、90℃不同热处理中心温度下,具有相同的失活规律:菌液在达到中心温度之前,浓度即降低至一个稳定值,此时致死率分别为 31.73%、40.07%、51.07%,之后随着加热时间的延长至60 min,菌液浓度基本保持不变;各温度升温过程中细菌的热失活模型均可用 Exponential模型拟合,70、80、90℃的判定系数 R2分别为 0.982 9、0.952 9、0.994 4。该研究结果可为企业优化热杀菌条件、提高热杀菌效率及保障食品安全提供理论支持。
[1] AGAPI I,DOULGERAKI D E,FRANCESCO V,et al.Spoilage microbiota associated to the storage of raw meat in different conditions[J].International Journal of Food Microbiology,2012,157:130-141.
[2] BLIXT Y,BORCH E.Comparison of shelf life of vacuum-packed pork and beef[J].Meat Science,2002,60:371-378.
[3] GOULD G W.New methods of food preservation[M].London:Blackie Academic and Professional,1995.
[4] 徐怀德,王云阳.食品杀菌新技术[M].北京:科学技术文献出版社,2004.
[5] CHIRALT A,FITO P,BARAT J M,et al.Use of vacuum impregnation in food salting process[J].Journal of Food Engineering,2001,49:141-151.
[6] VEGA-MERCADO H, GO'NGORA-NIETOMM,BARBOSA-CA'NOVAS G V.Advances in dehydration of foods[J].Journal of Food Engineering,2001,49:271-289.
[7] 李汴生.热杀菌与非热杀菌特性与方法[J].粮油加工与食品机械,2001,7:14-15.
[8] 陈 晓.腐败肉制品中致腐微生物来源PCR分析方法研究[D].郑州:河南农业大学,2013.
[9] BURGESS S A,LINDSAY D,FLINT S H.Thermophilic bacilli and their importance in dairy processing[J].Food Microbiology,2010,144:215-225.
[10] PREVOST S,ANDRE S,REMIZE F.PCR detection of thermophilic spore-forming bacteria involved in canned food spoilage[J].Curr.Microbiology,2010,61:525-533.
[11] CLEMENCE R,STEPHANE A,ISABELLE A,et al.Quantitative assessment of the risk of microbial spoilage in foods:Prediction of non-stability at 55℃ caused by Geobacillus stearothermophilus in canned green beans[J].Journal of Food Microbiology,2014,171:119-128.
[12] SANG-WOOK L,SIM S J.Increased heat resistance of Geobacillus stearothermophilus spores heat shocked during sporulation[J].Journal of Microbiology and Biotechnology,2006,16(4):633-636.
[13] 于新华.罐头食品的历史现状及发展对策[J].食品与发酵工业,2001,27(2):58~614.
[14] ALEXANDER M,VOLKER H,FRIEDEL H S,et al.Impact of agglomeration on the quantitative assessment of Bacillus stearothermophilus heat inactivation[J].Journal of Food Engineering,2007,81:380-387.
[15] ZEYNEP D,KONRAD W,MAREILE M M,et al.Inactivation kinetics of Bacillus stearothermophilus spores in batch-and continuous-heating systems[J].LWTFood Science and Technology,2009,42:81-86.
[16] ANANTHESWARAN R C,SASTRY S K,BEELMAN R B,et al.Effect of processing on yield,colour and texture of canned mushrooms[J].Journal of Food Science,1986,51(5):1197~1200.
[17] CHIN-YI C,GARY W N,PETER L I.A 6 × 6 drop plate method for simultaneous colony counting and MPN enumeration of Campylobacter jejuni,Listeria monocytogenes,and Escherichia coli[J].Journal of Microbiological Methods,2003,55:475-479.
[18] JAN I,AGNIESZKA P,MAGDALENA M.Inactivation of Bacillus stearothermophilus spores during thermal processing[J].Journal of Food Engineering,2006,77:406-410.
