Ⅰ型鸭甲型肝炎病毒VP0基因的原核表达与多抗的制备
2015-04-14王安平朱善元王永娟左伟勇洪伟鸣
王安平,朱善元,王永娟,吴 双,左伟勇,洪伟鸣
(江苏农牧科技职业学院江苏省兽用生物制药高技术研究重点实验室,江苏泰州225300)
鸭甲型肝炎病毒(Duck Hepatitis A Virus,DHAV)属于小RNA病毒科禽肝炎病毒属鸭甲型肝炎病毒种,临床上主要引起21日龄以下的雏鸭发生急性肝炎,病死率高达100%,是一种急性高度致死性传染病,是严重危害养鸭业的疫病之一[1-2]。DHAV包括经典型(即中国原Ⅰ型鸭肝炎病毒)、台湾新型、韩国新型3种亚型,名称分别为DHAV-1,DHAV-2 和 DHAV-3[3-5],3 个型之间存在明显的差异,无交叉抗原性,其中DHAV-1呈世界性分布,也是中国 DHAV流行的主要血清型[6-7]。DHAV呈二十面体对称,直径为20~40 nm,无囊膜,核心为单股正链RNA,整个基因组约有7 690个核苷酸组成,不含5’帽子结构,3’端有poly(A)尾巴,只有一个较大的开放读码框,病毒的RNA指导合成一条完整蛋白,称为多聚蛋白。多聚蛋白在翻译过程中不断被自身编码的蛋白酶水解,分解成小片段蛋白,分别为结构蛋白(VP0,VP3,VP1)和非结构蛋白(2A1,2A2,2A3,2B,2C,3A,3B,3C,3D)[8-9]。与其他小 RNA 病毒不同,DHAV VP0末端缺少GxxxS/T基序,因此其N端可能未被十二烷基化,VP0不能被切割为VP2和VP4[2]。目前,关于DHAV结构蛋白的研究多集中于抗原优势蛋白VP1和VP3,对于VP0的研究相对较少。VP0结构蛋白主要位于病毒粒子的表面,具有较强的抗原性和宿主保护位点,而且与VP1和VP3不同的是,VP0在不同毒株间相对保守[9]。因此,本研究利用大肠杆菌表达系统表达DHAV-1 SH株的VP0基因,制备其多抗血清,为DHAV-1的基础研究和检测试剂盒的研发奠定基础。
1 材料与方法
1.1 毒株、菌株和载体
DHAV-1 SH毒株由中国上海兽医研究所惠赠;10日龄SPF鸡胚购于江苏农牧科技职业技术学院国家水禽基因库;pET-32a载体、大肠杆菌BL21(DE3)和DH5α均由江苏省兽用生物制药高技术研究重点实验室保存。
1.2 酶和相关试剂
Trizol试剂盒购自TaKaRa公司;M-MLV反转录酶购自Invitrogen公司;T4 DNA连接酶、BamHⅠ和XhoⅠ购于Fermentas公司;His标签单抗、HRP-羊抗鼠IgG、质粒小提试剂盒、DAB显色试剂盒购于康为世纪公司;DNA胶回收试剂盒购于爱思进公司。
1.3 引物设计与合成
根据GenBank中发表的DHAV-ⅠSH株病毒基因组序列,设计了针对VP0基因序列的一对引物,为了便于基因的克隆及表达载体构建等后继工作,上游引入BamHⅠ酶切位点,下游引入XhoⅠ酶切位点,由上海英潍捷基生物技术有限公司合成。引物序列为:VP0-F/R:GATACTCTTACTAAAAAC-3’(下划线为 BamHⅠ酶切位点)GTCGGGG-3’(下划线为XhoⅠ酶切位点)。
1.4 DHAV-1的增殖与病毒RNA的提取
取10倍稀释的原代病毒0.2 mL接种于10日龄SPF鸡胚尿囊腔,于37℃孵化箱孵化。选择48~72 h之内死亡的鸡胚,置于4℃过夜,收集尿囊液。按Trizol法抽提尿囊液总RNA,操作参照说明书。
1.5 DHAV-1VP0扩增和测序
根据Invitrogen公司的RT-PCR试剂盒操作说明进行操作,反应程序设定为:25℃,10 min;42℃,90 min;70℃,10 min。PCR反应条件为:95℃预变性3 min;然后95℃ 30 s,52℃,30 s;72℃,1 min,30个循环;再72℃,10 min。PCR产物经0.8%琼脂糖凝胶电泳分析。
1.6 重组质粒载体pET-VP0的构建
PCR产物经0.8%琼脂糖凝胶电泳分离回收纯化,然后经BamHⅠ,XhoⅠ酶切后,与经同样酶切的pET-32a连接,转化大肠杆菌DH5α感受态细胞,在含100 mg·L-1氨苄青霉素的LB琼脂平板上37℃培养过夜后,挑取单菌落,提取质粒电泳筛选,并进行酶切鉴定。酶切鉴定正确后送由上海英潍捷基生物技术有限公司测序,测序正确的克隆命名为pET-VP0。
1.7 重组菌的诱导表达
将重组质粒 pET-VP0转化至 E.coli BL21(DE3),挑取单菌落接种于5 mL含氨苄青霉素(Amp)抗性的LB液体培养基中,37℃ 振荡培养过夜,次日按1% 接种量转接至含Amp的5 mL LB液体培养基中,37℃,200 r·min-1振荡培养,当菌液 OD600值达 0.4~0.6之间时,加入 IPTG至终浓度在0.2 ~1.0 mmol·L-1,37 ℃ 诱导3 ~5 h,离心收集菌体,溶于适量PBS中,超声波裂解菌体,离心后分别收集上清液及沉淀,于-20℃保存备用。在相同条件下诱导含表达质粒 pET-32a的空载体及未加诱导剂的受体菌作为空白和阴性对照。
1.8 表达产物的检测
诱导后,取200 μL的菌液与50 μL的5×SDS上样缓冲液混匀后,沸水煮沸3 min,进行SDSPAGE凝胶电泳分析。将诱导样品和非诱导样品进行SDS-PAGE电泳后转印至PVDF膜上,用5%的脱脂奶粉4℃封闭过夜,以鼠抗His单抗作为一抗,辣根过氧化物酶(HRP)标记的羊抗鼠为二抗,DAB显色试剂盒进行显色。
1.9 重组蛋白抗血清的制备
将重组蛋白经SDS-PAGE电泳后,经1 mol·L-1KCl染色,切出目的条带,加入少量PBS研磨匀浆化,以皮下两点注射法免疫6周龄ICR小鼠,每隔2周免疫1次,4次免疫后第14天采血,分离血清,至-80℃保存备用。
1.10 多抗血清的Western-blotting鉴定
将DHAV-1 SH毒株鸡胚尿囊液进行SDSPAGE,然后转印至PVDF膜,用5%的脱脂奶粉4℃封闭过夜,以制备的鼠多抗血清作为一抗,辣根过氧化物酶(HRP)标记的羊抗鼠为二抗,DAB显色试剂盒进行显色。同时以未接种DHV鸡胚尿囊液作为阴性对照。
2 结果与分析
2.1 VP0基因的克隆
以提取的尿囊液总RNA为模板,RT-PCR扩增出约800 bp的目的条带,与预期相符。回收后用BamHⅠ,XhoⅠ酶切,与经同样酶切的pET-32a连接,获得的阳性克隆命名为pET-VP0,经BamHⅠ、XhoⅠ双酶切后获得约800 bp和5 900 bp 2个条带(图1),与预期结果一致,且进一步的测序结果表明,克隆的VP0基因序列及阅读框完全正确。

图1 重组质粒pET-VP0的酶切鉴定Fig.1 Identification of pET-VP0 by restriction endonucleases digestion
2.2 重组蛋白的诱导表达与检测
将pET-VP0重组菌用IPTG进行诱导表达,并用pET-32a载体质粒转化E.coli BL21(DE3)宿主菌同时诱导作为对照。结果表明,IPTG浓度为1.0 mmol·L-1,37℃诱导4~5 h,重组蛋白可以得到较高水平的表达,并均以包涵体形式存在。重组蛋白的相对分子质量约为48 kD(图2),与理论值相符。以抗His标签单抗对重组蛋白进行鉴定,结果在目的位置出现1条特异条带(图3)。
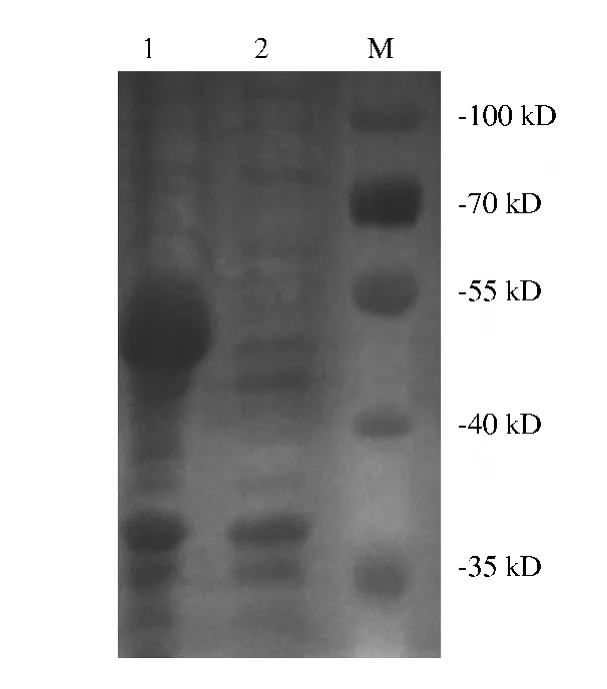
图2 VP0重组蛋白的SDS-PAGE分析Fig.2 SDS-PAGE analysis of VP0 recombinant protein

图3 VP0重组蛋白的Western blotting鉴定Fig.3 Western blotting identification of VP0 recombinant protein
2.3 多抗血清的Western-blotting鉴定
以纯化的融合蛋白原核表达产物免疫ICR小鼠,制备VP0蛋白的多抗血清,获得的血清能与DHAV-1 SH毒株鸡胚尿囊液反应,条带大小约为28 kD(图4),为VP0蛋白大小。
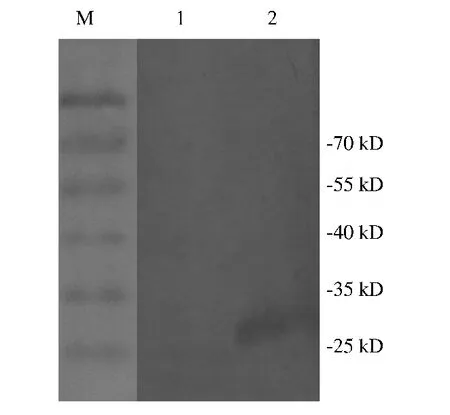
图4 VP0多抗血清的Western-blotting鉴定Fig.4 Western-blotting identification of VP0 antiserum
3 讨论
DHAV属于小RNA病毒,其衣壳由3个结构蛋白VP0,VP3和VP1组成,其中VP0、VP1大部分暴露在病毒粒子表面,具有很强的抗原性和宿主保护位点。不同DHAV血清型之间VP1基因变化较大,而VP0则相对保守[10]。根据亲缘关系最近的人双埃柯病毒的研究,推测DHAV-1结构蛋白VP0上可能存在保守的B细胞表位[6],所以,利用结构蛋白VP0为包被抗原建立DHAV的ELISA检测方法,可以广泛的识别各株DHAV-1产生的血清抗体,将具有广发的应用前景。
相对于病毒纯化来说,利用成熟的原核表达系统,更容易得到相对简单的结构蛋白。pET表达系统是目前使用较为广泛的一种原核表达系统,在诱导状态下宿主菌内几乎所有的资源都可以转向目的基因的表达,外源基因的表达量一般可以达到菌体总蛋白的30%以上。表达的融合蛋白带有组氨酸标签,方便目的蛋白的纯化,其肠激酶酶切位点可切除去融合部分,利用目的蛋白的研究。本试验用pET-32a表达系统成功表达了DHAV-1 VP0蛋白,采用RT-PCR技术扩增出完整的VP0基因,序列分析表达克隆的 VP0基因长为 768 bp,与DHAV-ⅠSH株序列同源性达100%,SDS-PAGE电泳和Western-blotting分析证明表达的融合蛋白相对分子质量约为48kD。
尽管pET原核系统表达的外源蛋白缺少翻译后加工功能,但表达产物依旧保持了良好的免疫原性。本试验利用表达的融合蛋白免疫小鼠制备了针对重组蛋白的多抗血清,Western-blotting分析说明制备的多抗血清可与DHAV尿囊液中的VP0蛋白发生特异性反应,充分说明制备的多抗血清具有很好的特异性,可以作为检测用抗体进一步用于DHAV VP0抗原的检测及功能研究。
[1] WANG L,PAN M,FU Y,et al.Classification of duck hepatitis virus into three genotypes based on molecular evolutionary analysis[J].Virus Genes,2008,37(1):52-59.
[2] TSENG C H,KNOWLES N J,TSAI H J.Molecular analysis of duck hepatitis virus type I indicates that it should be assigned to a new genus[J].Virus Research,2007,123(2):190-203.
[3] TSENG C H,TSAI H J.Sequence analysis of a duck picornavirus isolate indicates that it together with porcine enterovirus type 8 and simian picornavirus type 2 should be assigned to a new picornavirus genus[J].Virus Research,2007,104(2):104-114.
[4] KIM M C,KWON Y K,JOH S J,et al.Molecular analysis of duck hepatitis virus type I reveals a novel lineage close to the genus Parechovirus in the family Picornaviridae[J].Journal of General Virology,2006,87(11):3307-3316.
[5] KIM M C,KWON Y K,JOH S J,et al.Recent Korean isolates of duck hepatitis virus reveal the presence of a new geno-and serotype when compared to duck hepatitis virus type I type strains[J].Archives of Virology,2007,152(11):2059-2072.
[6] DING C Y,ZHANG D B.Molecular analysis of duck hepatitis virus type I[J].Virology,2007,361(1):9-17.
[7] 张艳芳,罗 薇,刘内生,等.鸭肝炎病毒的研究进展[J].中国畜牧兽医,2011,38(7):171-174.
[8] TSENG C H,TSAI H J.Molecular characterization of a new serotype of duck hepatitis virus.Virus Research,2007,126(1):19-31.
[9] JIN X,ZHANG W,HU X,et al.Identification and molecular analysis of the highly pathogenic duck hepatitis virus type I in Hubei province of China[J].Research in Veterinary Science,2008,85(3):595-598.
[10] LIU G,WANG F,NI Z,et al.Genetic diversity of the VP1 gene of duck hepatitis virus type I(DHV-1)isolates from southeast China is related to isolate attenuation[J].Virus Research,2008,137(1):137-141.
