钯/石墨烯/离子液体纳米复合物的过氧化氢电化学传感器
2015-04-14冯晓娟石彦龙金小青冯雷
冯晓娟,石彦龙,金小青,冯雷
(河西学院 化学化工学院 甘肃省高校河西走廊特色资源利用省级重点实验室,甘肃 张掖 734000)
近年来人们对过氧化氢(H2O2)的检测做了大量的研究工作,由于过氧化氢在环保、食品卫生、临床诊断和化工等领域具有广泛的用途[1]。过氧化氢是一种重要的化工产品,但也是一种非常危险的物质,若过量使用会对环境产生很多的不利影响。另外,对水池、食品或饮料包装等消毒常使用过氧化氢。另一方面,过氧化氢在临床医学上作为一种氧化性应激对许多疾病是最有价值的标志。因此,过氧化氢对人们的生活、环境污染、健康、社会进步等有很重要的影响,其快速准确有效的检测势在必行。目前,有许多的方法用于对过氧化氢的检测,如化学发光法、色谱法、分光光度法及电化学法等[2-4]。其中电化学方法因操作简单、灵敏度高、线性范围宽、快速而稳定的响应信号等优点而受到人们的青睐[5]。但多数基于血红蛋白、过氧化物酶的生物传感器[6-7],它具有酶自身的稳定性不好,易失去活性等缺点,在一定程度上限制其传感器的应用。因此,很有必要寻求新的一种无酶传感器去检测H2O2,具有非常重要的意义。
目前,各种电极材料已应用于检测,如碳基材料、导电聚合物等,在碳基材料中,石墨烯是由碳原子紧密堆积成单层二维蜂窝状晶格结构的一种新型碳材料,具有大的比表面积、优异的电子传导能力和小的电荷传递电阻等优良性能[8],其已成为电化学传感器的理想电极材料。而石墨烯具有独特的结构,负载金属纳米粒子构建电化学传感器已激发起人们的巨大热情。目前,负载的金属纳米粒子主要有贵金属Pt、Au、Pd 等,由于钯与铂结构相似[9],且是一种具有较高催化活性、价格又相对便宜的贵金属,因此利用钯作原料实现对H2O2的快速催化还原及检测具有重要意义。有文献报道[10],Pb 对H2O2的氧化和还原具有很好催化活性,可以有效降低H2O2的氧化还原过电位,可用于高灵敏检测。另外,石墨烯表面存在大量类似于断层的结构缺陷[11],能提供较多的反应活性位点,同时由于其优良的导电性能,又能促进活性粒子与电极间的电子转移过程。离子液体(IL)在室温下呈现液态的新型材料,具有溶解性好、电化学窗口宽、高导电性、生物活性好等优点,使IL 在生物电化学领域有着广阔的应用前景。因此本文首次将纳米钯与石墨烯和离子液体相结合制备的复合材料,既具有石墨烯大的比表面积,纳米钯的优良电催化性能,又有离子液体良好的生物活性,有望作为H2O2电化学检测的理想传感器,该方法制备简便、响应快速、电极使用寿命长,具有很好的实用价值。
1 实验部分
1.1 试剂与仪器
石墨、H2O2(30%)、PbCl2、H2SO4(98%)、KCl均为分析纯;实验用水为二次蒸馏水。
CHI660E 型电化学工作站;KQ-250B 型超声波清洗器;BS124S 型天平;采用三电极体系,玻碳电极为工作电极,铂丝电极为辅助电极,饱和甘汞电极(SCE)为参比电极。
1.2 修饰电极的制备
氧化石墨烯是利用改进的Hummers 法制备[12]。取一定量的氧化石墨烯(GO)粉末加入50 mL 水中超声1 h,然后加入0.3 mL 85%水合肼进行还原反应,用水浴控制温度在95 ℃下反应,获得黑色的石墨烯,先用去离子水洗涤干净,然后再用真空干燥器干燥,密封保存待用。
1.3 传感器的制备
将玻碳电极先后用0.3 μm 和0.05 μm Al2O3在麂皮上打磨,每次打磨后用超纯水洗净,电极表面抛光至镜面后,先后在无水乙醇和二次蒸馏水中各超声清洗5 min 后晾干。将20 mg 石墨烯和0.2 mL IL 的混合物在研钵中研磨约20 min,得到黑色粘性的GN-IL 复合物。将适量的GN-IL 复合物涂于工作电极表面,得到GN-IL/GC 电极,晾干24 h,然后用超纯水冲洗干净,待其完全干后,将其浸入PdCl2盐酸溶液中,以50 mV/s 的扫描速率于-0.2 ~0.8 V的电位范围内循环扫描15 圈,使纳米钯沉积于玻碳电极表面,再用超纯水洗净,晾干后即得到Pb/GNIL/GC 修饰电极。电极制备示意图如下。

2 结果与讨论
2.1 Pb/GN-IL/GC 修饰电极对H2O2 的电催化
为了考察Pb/GN-IL/GC 修饰电极对H2O2的电催化性能,并且明确实验是单一组分起作用,还是离子液体、钯纳米粒子和石墨烯的协同作用,将不同的修饰电极对H2O2的电化学还原性能进行了比较。图1 是将石墨烯修饰的电极GN/GC、离子液体修饰的电极IL/GC 和三者修饰的Pb/IR-GN/GC 电极置于含H2O2浓度为5 mmol/L 的PBS 溶液中,以50 mV/s 的扫速进行循环伏安扫描。

图1 H2O2 在不同修饰电极上的循环伏安图Fig.1 Cyclic voltammograms of H2O2 at different electrodes a.IL/GC 电极;b.GN/GC 电极;c.Pb/GN-IL/GC 电极
由图1 可知,IL/GC 电极的循环伏安图上没有明显的还原峰,并且背景电流非常小。而在GN/GC电极上,峰电流有明显增加,但还是观察不到还原峰的存在。对于Pb/GN-IR/GC 电极可观察到,此修饰电极有明显的还原峰,峰电位在-150 mV,且峰电流是IL/GC 和GN/GC 两个电极的5 倍多,表明该Pb/IR-GN/GC 修饰电极对H2O2有很强的电催化活性,这也表明了此修饰电极是由于石墨烯、离子液体和纳米钯离子的协同作用所引起的。此修饰电极有以下特征:第一,石墨烯表面有大量类似于断层的结构缺陷,能提供很多的活性位点;第二,离子液体的引入能够提高石墨烯的导电能力,增强其电化学活性;第三,被吸附的钯纳米粒子能够进一步有效提供电子传递路径,并在电极与检测物之间加速电子传递时起到纳米电极的作用,从而使得Pb/GN-IR/GC修饰电极对H2O2的电催化还原能力比石墨烯和离子液体本身显著增大。
2.2 测量条件的选择
2.2.1 不同H2O2浓度的影响 首先考察了浓度对传感器电催化性能的影响,图2 为Pb/GN-IR/GC修饰电极在浓度为1,5,7,10,25 mmol/L 对H2O2电催化的循环伏安图。
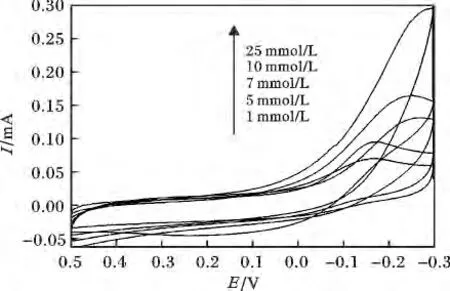
图2 不同浓度的H2O2 对Pb/GN-IR/GC 电极的循环伏安图Fig.2 Cyclic voltammograms of different H2O2 concentrations at Pb/GN-IR/GC electrode
由图2 可知,对H2O2还原的峰电位在-0.15 V左右,随着浓度的变化,峰电位发生了负移,并且峰电流值逐渐增大,在25 mmol/L 时峰电流达到了最大值,为0.295 mA。
2.2.2 扫描速率的影响 为了进一步考察扫速对H2O2的电催化还原性能的影响,在10 ~90 mV/s 的扫速下,Pb/GN-IR/GC 电极对5 mmol/L H2O2进行循环伏安扫描,结果见图3。
由图3 可知,随着扫描速度的增加,还原峰电流的响应值增大,并且还原峰电位发生了负移。这说明在复合电极上过氧化氢的还原反应是受动力学限制 的。根 据 Randles-Sevcik 公 式:Ip= 2. 69 ×105AD1/2cn3/2v1/2(其中A 表示玻碳电极的几何面积,c 表示溶液的浓度,n 为参与电化学反应的电子数,D 表示扩散系数),在室温条件下,经计算H2O2在PBS 溶液中的扩散系数D =1.43 ×10-6cm2/s。另外,从还原电流与扫描速度的平方根图可知,I 与v1/2呈现良好的线性关系:Ipc(mA)= 0. 030 8v1/2(mV/s)-0.025 8(R =0.993 6),说明在不同的扫描速度范围内,电极表面的还原是典型的扩散步骤控制。这是因为复合物电极具有大的比表面积和良好的导电性,使得电极表面的H2O2能够较快地发生电极反应,即电子传递速率大于物质由本体溶液到达电极表面的扩散速率。即电极的反应从吸附控制过程变为扩散控制过程。

图3 Pb/GN-IR/GC 电极在5 mmol/L H2O2 溶液中不同扫速的循环伏安图和还原电流与扫描速度的平方根的图Fig.3 CVs of 5 mmol/L H2O2 at the Pb/GN-IR/GC electrode at different scan rates and reduction current and the square root of scanning speed charta→e 扫描速率分别为10,30,50,70,90 mV/s
2.2.3 pH 的影响 电解质溶液的pH 对H2O2的电催化也有很重要的影响,在不同的pH 条件下,测定Pb/GN-IR/GC 电极对H2O2的电化学响应,pH对还原峰电流值的影响见图4。

图4 pH 值与过氧化氢峰电流关系图Fig.4 pH and H2O2 peak current relationship chart
由图4 可知,pH 在5.1 ~7.0,还原峰电流随pH的增大而逐渐增大,而pH 在7.0 ~8.26,峰电流随pH 的升高而逐渐减小,可能的原因在于H2O2在碱性环境中不稳定,考虑到电极的最大响应值和实际应用价值,决定采用pH=7.0 为后面实验的支持电解质。
2.3 电流法测定H2O2
确定了最佳实验条件后,采用计时安培法考察了电流响应值与H2O2浓度之间的关系。在合适的搅拌速率下,在-0.4 V 的电位下不同修饰电极(a)Pb/GN-IR/GC、(b)GN/GC、(c)IR/GC 对连续加入H2O2的响应电流曲线见图5。

图5 Pb/GN-IR/GC 电极(a)、GN/GC 电极(b)和IR/GC 电极(c)对H2O2 的i-t 响应曲线Fig.5 Chronoamperometric responses for Pb/GN-IR/GC electrode(a)and GN/GC electrode(b)and IR/GC electrode(c)upon subsequent additions of H2O2
由图5 可知,Pb/GN-IR/GC 传感器对H2O2的电催化还原电流呈阶梯形增长,有快速灵敏的响应。当加入等量的H2O2时,Pb/GN-IR/GC 修饰电极对H2O2的响应电流比其它修饰电极产生的催化电流大。对Pb/GN-IR/GC 修饰电极来说,达到最大稳态电流的95%需要10 s,如此快的响应归属于快速的扩散过程和Pb/GN-IR/GC 的高电子导电率。该修饰电极在4.0×10-6~4.3×10-4mol/L 范围内,响应电流值与H2O2的浓度呈线性关系(R =0.997 8),H2O2的检出限为2.1 ×10-6mol/L。总之,Pb/GNIR/GC 复合修饰电极对H2O2的检测有良好的线性关系和高的灵敏度。
2.4 传感器的重现性及稳定性
重现性和稳定性是一个优良传感器的重要指标,通过循环伏安法考察了相同条件下制备的6 支电极对H2O2的电化学行为,发现其电流响应值的RSD 为3.6%。同时电极的稳定性也进行了检测,将电极贮存于冰箱内,每隔7 d 作一次检测,储存14 d 后的电流值为初始值的90%。表明此类传感器具有好的重现性和稳定性。
2.5 干扰实验及回收率
在最佳实验条件下保持H2O2溶液的浓度为4.0 ×10-4mol/L,加入10 倍的尿酸、2 倍抗坏血酸、40 倍的葡萄糖、10 倍甘氨酸、10 倍色氨酸时、20 倍苏氨酸测定其对H2O2生物传感器响应信号的干扰,图6 结果表明,这些物质对其干扰电流信号均<5%。

图6 干扰实验的测定Fig.6 Effect from the possible interferents in H2O2 biosensors a.0.4 mmol/L H2O2;b.0.8 mmol/L 抗坏血酸;c.0.4 mmol/L 色氨酸;d.0.8 mmol/L 苏氨酸;e.4 mmol/L 尿酸;f.1.6 mmol/L 葡萄糖;g.0.4 mmol/L 甘氨酸
采用本传感器对3 份含过氧化氢的实际样品进行分析,见表1。

表1 回收实验(n=3)Table 1 Results of test for recovery
由表1 可知,此传感器有较好的回收率,此方法为检测实际样品中的H2O2提供了一种新的、良好的方法。
3 结论
本文用石墨烯与离子液体形成的混合物修饰玻碳电极并采用电沉积法制备了纳米钯/石墨烯/离子液体复合材料,研制了一种能够直接测定过氧化氢的无酶电化学传感器。此修饰电极对过氧化氢的还原具有良好的电催化性能,显示出了很高的灵敏度和稳定性以及对过氧化氢的快速响应性,这种复合物结合了石墨烯、离子液体和纳米钯的优越条件,提高了检测的灵敏度,降低了检出限。此外,该传感器制备简单、成本低廉、检测方便、稳定性好、可长期使用。
[1] 杨云慧,罗文超,冯亚娟,等. 基于石墨烯铂纳米颗粒复合材料的过氧化氢无酶传感器的研制[J]. 云南大学学报:自然科学版,2010,31(4):12-15.
[2] Yang Xiushang,Chen Xu,Zhang Xiong,et al.Intercalation of methylene blue into layered manganese oxide andapplication of the resulting material in a reagentless hydrogen peroxide biosensor[J]. Sensors and Actuators B,2008,129:784-789.
[3] 范华锋,张忠义,刘振林,等.分光光度法测定食品中过氧化氢[J]. 中国卫生检验杂志,2006,16(9):1079-1080.
[4] 赵红叶,魏俊平,乔丽云.基于两种复合纳米材料的电化学生物传感器研究[J].分析化学,2013,6(41):835-840.
[5] 李理,卢红梅,邓留.基于石墨烯和金纳米棒复合物的过氧化氢电化学传感器[J]. 分析化学,2013,5(41):719-724.
[6] 马生华,王雪靖,韩晓军.基于卵磷脂膜中铁卟啉直接电化学的过氧化氢传感器[J]. 分析化学,2013,11(41):1719-1723.
[7] 刘敏敏,魏文涛,逯一中,等.石墨烯负载的空心银钯纳米粒子的制备及在过氧化氢检测中的应用[J].分析化学,2012,10(40):1477-1481.
[8] 郑龙珍,李引弟,熊乐艳,等.石墨烯-聚多巴胺纳米复合材料制备过氧化氢生物传感器[J].分析化学研究报告,2012,1(40):72-76.
[9] 冯晓娟,张维娜,安红钢.载钯聚基胺聚砜复合膜修饰电极对甲酸的电催化氧化[J]. 应用化学,2014,31(3):336-341.
[10] Chao X,Wang X,Zhu J. Graphene/metal partical nanocompositrs[J].Journal of Physical Chemistry C,2008,112(50):19841-19845.
[11] Zhou X,Zhang J,Wu H,et al. Reducing graphene oxide via hydroxylamine:A simple and efficient route to graphene[J].The Journal of Physical Chemistry C,2011,115(24):11957-11961.
[12]Hummers W S,Offerman R E.Preparation of graphitic oxide[J].J Am Chem Soc,1959,80(11):1339-1342.
