医用臭氧对神经病理性疼痛大鼠的镇痛作用及初步机制探讨
2015-04-13肖智李尤艳孙梦婕
肖智,李尤艳,孙梦婕
(1.遵义医学院医学与生物学研究中心;2.遵义医学院研究生学院;3.遵义市第一人民医院眼科,贵州遵义 563003)
臭氧(ozone,OZ)是一种不稳定的气体。医用臭氧是氧和臭氧的混合物,具有强氧化性,具有消毒、灭菌和抗病毒等作用。近年来,医用臭氧用于临床腰椎间盘突出等疾病的镇痛治疗[1]。中脑导水管周围灰质(midbrain periaqueductal gray,PAG)是机体内源性镇痛系统的关键部位,其中PAG的外侧区(lateral periaqueductal gray,lPAG)与疼痛调制的关系最为密切。lPAG中多种神经递质和受体参与机体的下行性镇痛或下行性疼痛易化机制。三磷酸腺苷(adenosine 5’-triphosphate,ATP)不仅是机体储能和供能的物质,也是一种重要的神经递质。ATP受体中对胞外腺苷敏感的受体称P1受体,属G蛋白偶联受体家族,包括A1、A2A、A2B、A3四类;对胞外腺嘌呤核苷酸敏感的受体称P2受体,其亚型又可分为P2X(离子通道型受体)和P2Y(G蛋白偶联型受体),已经明确的P2X受体家族有7个亚型(P2X1-7),P2Y 受体家族有8 个亚型(P2Y1,2,4,6,11,12,13,14,)。ATP 及其受体参与机体疼痛调制,其中P2X3受体在疼痛调制中的作用研究最为深入。本课题组前期研究中发现,神经病理性疼痛大鼠lPAG中P2X3受体的活化将促进机体的内源性镇痛作用[2]。那么,明确医用臭氧的镇痛作用是否有lPAG中P2X3受体的介入是本研究的目的。本实验将通过建立慢性神经压迫性损伤(chronic constriction injury,CCI)的神经病理性疼痛大鼠模型,在坐骨神经旁注射不同剂量的医用臭氧,观察医用臭氧是否对神经病理性疼痛具有镇痛作用并探讨其镇痛机制是否有lPAG中P2X3受体的参与。
1 材料与方法
1.1 动物及分组
清洁级成年雄性Sprague-Dawley(SD)大鼠共108只购于重庆第三军医大学,体重210~220 g,实验期间分笼饲养,3~4只大鼠一笼;大鼠置于安静,温度(24±1)℃,湿度(60±5)%,人工光照,明暗各12 h/d(8AM-8PM)周期的环境中饲养,自由进食及饮水。本实验严格按照国际疼痛研究协会(International Association for the Study of Pain,IASP)关于应用动物进行疼痛研究的伦理纲要进行操作,实验过程中尽量减少动物的不适和动物的使用量。
按照随机数字表法将84只大鼠随机分为7组(n=12):正常组(normal)、假手术组(sham-CCI)、CCI组(CCI)、CCI加空气注射组(CCI+Air)、低剂量臭氧组(CCI加low OZ)、中剂量臭氧组 (CCI加middle OZ)、高剂量臭氧组(CCI加high OZ)。其中CCI组、CCI加 Air组、CCI加 low OZ 组、CCI加 middle OZ组和CCI加high OZ组大鼠建立CCI神经病理性疼痛大鼠模型。在CCI手术后14 d每组取6只用于免疫组化检测,剩余6只观察MWT值直到CCI手术后21 d。正常组不做任何处理,仅做对照。
另取SD大鼠24只建立CCI神经病理性疼痛模型大鼠,按照随机数字表法分为3组(n=8):CCI组(CCI)、CCI+OZ组和CCI+A-317491+OZ组。
1.2 主要实验仪器及试剂
电子Von Frey测痛仪(IITC Life science公司,2390系列,美国)、冰冻切片机(Leica CM1950,德国)、脑立体定位仪(Narishige公司,SR-6R,日本)。兔抗大鼠 P2X3多克隆抗体 (AB5896,美国Millipore公司)、兔超敏二步法检测试剂盒(PV-9001,北京中杉金桥生物技术有限公司)、牛血清蛋白(北京中杉金桥生物技术有限公司)、DAB显色试剂盒(ZLI-9032,北京中杉金桥生物有限公司)、A-317491(A-2979,Sigma Aldrich 公司,美国),溶于无菌生理盐水中,终浓度为5 nmol/μL,lPAG中微量注射量为(1.5 nmol/0.3 μL)。
1.3 动物模型建立
参照Bennett等[3]的方法制备大鼠 CCI模型。大鼠予4%水合氯醛10 mL/kg腹腔注射。待大鼠进入麻醉状态后于右后肢纵向切开皮肤,钝性分离,暴露坐骨神经主干,4.0丝线间断结扎,间距1 mm,松紧度以小腿肌肉出现轻微震颤为标准。生理盐水冲洗后逐层缝合。术后大鼠单笼饲养,麻醉清醒后自由饮食。假手术组大鼠仅暴露坐骨神经不予结扎,余同模型组。
1.4 坐骨神经旁注射
在CCI建模成功后8 d,CCI+low OZ组、CCI+middle OZ组和CCI+high OZ组大鼠每组取6只,分别抽取35 μg/mL 医用臭氧 0.125 mL、0.25 mL、0.5 mL注射于大鼠损伤坐骨神经旁,1次/2d,共注射4次。CCI+Air组大鼠在坐骨神经周围注入0.5 mL空气,其余操作同前3组。注射部位定位方法:在大鼠股骨大转子和坐骨结节间皮肤进针后向前内侧前进,沿着坐骨神经走行呈扇形注射药液[4]。
1.5 疼痛行为学观察及机械痛阈值检测
观察各组大鼠在各观察时间点步态和左右肢姿势、协调程度以及有无畸形等,大鼠是否存在过分嘶叫、舔舐患肢、自噬等自残现象。
1.6 机械痛阈值的检测
测定机械痛阈值(mechanical withdrawal threshold,MWT)时,室温维持在20~24℃,保持周围环境安静。先将大鼠置于底带孔的透明有机玻璃笼中30 min以上,使大鼠适应环境30 min,待大鼠停止行走、抓挠、直立、排便等活动处于安静状态后开始检测。通过网孔用电子von Frey纤维刺激大鼠后肢足底中部2 s,出现缩足反应时读数为MWT。检测时间点为 CCI术前(0 d)和术后1 d、2 d、8 d、10 d、12 d、14 d、18 d 和 21 d。
1.7 免疫组织化学染色
大鼠4%水合氯醛(20 mL/kg)腹腔内注射,深度麻醉后开胸暴露心脏,从左心室插管入主动脉升部,150 mL冷生理盐水快速灌注冲洗血液后予200 mL 4%多聚甲醛缓慢灌注,维持2 h。取出大鼠脑组织置于4%多聚甲醛溶液中,6 h后转移至30%蔗糖溶液中直至脑组织沉底。冰冻包埋剂(OCT)包埋后-20℃冰冻切片机中速冻40 min,沿大脑冠状位连续切片,厚25μm。每5~6张PAG切片取一张进行免疫组织化学染色分析,每只大鼠取10张。3%H2O2封闭40 min,3%正常牛血清封闭1 h,加入兔抗大鼠P2X3(1∶200),于37℃烤箱中孵育1 h后转移到4℃冰箱中过夜。按说明书加入超敏二步法检测试剂,用DAB进行显色,自然风干后梯度酒精脱水,二甲苯透明;中性树胶封片,封固后在光镜下观察并采集图像。在切片放大400倍条件下,用Image-Pro Plus 6.0图像分析软件对lPAG的阳性图片进行阳性细胞计数。lPAG中细胞有细胞核、一个完整的胞体和细胞边界算做一个细胞。计数每一个视野中的细胞数,每张计数5个不重叠的视野,取均值。
1.8 中脑导水管周围灰质植管及微量注射
CCI+A-317491+OZ组大鼠在CCI术后9 d给予4%水合氯醛麻醉(10 mL/kg,腹腔注射),麻醉成功后,大鼠俯卧位置于脑立体定位仪上,切开头皮,暴露颅骨,钻孔。lPAG的坐标为:前囟后7.80 mm,中线旁开0.60 mm,颅骨表面下4.5 mm。插入外直径0.8 mm的不锈钢插管,用牙科磷酸锌水门钉固定,单侧插管,在插管内放入一内芯,防止插管堵塞。植管后给予青霉素钠盐(溶于2 mL无菌盐水)腹腔注射预防感染和脱水。手术结束后放入笼中,保温直到麻醉苏醒。插管完成后,每日观察大鼠的一般情况,生命体征以及运动功能变化,如果出现神经系统功能障碍(瘫痪、呼吸异常、插管脑脊液漏)等,排除在实验组。lPAG插管后5 d给予lPAG微量注射A-317491,注射药物前轻度固定大鼠,用微量进样器连接注射针头后给予注射,注射针头长于导管1 mm。每次注射0.3μL,3 min内注射完毕,留针2 min,确保药物的完全扩散。整个实验结束时,通过微量进样器注入2% 伊文思蓝0.1μL,确定注射部位并与大鼠脑图谱[5]比对,只有注射部位位于lPAG的大鼠数据才纳入统计处理。
1.9 统计学分析
应用SPSS 16.0软件进行统计学分析,计量资料以均数±标准差(x-±s)表示,不同时间点组内比较采用重复测量方差分析;多组间数据比较采用两因素方差分析(Two-Way ANOVA),P<0.05表示差异有统计学意义。
2 结果
2.1 CCI大鼠疼痛行为学变化
大鼠CCI术后健康状况良好,体重无明显减轻,毛色有光泽,饮食正常。术侧足趾展开且轻度外翻,常抬起并贴于腹部;着地/离地时间增长;站立时以左后足持重;行走无力,呈跛行状态。常将右后肢迅速抬起,有时出现舔舐、抓挠等,无自噬现象。正常组和假手术组未出现肢体畸形及活动异常现象。
2.2 大鼠机械痛阈值变化
CCI术后大鼠建模侧后肢MWT值逐渐下降,在CCI手术后14 d达到最低值,与正常组比较,差异有统计学意义(P<0.001);其后MWT值有小幅上升,在CCI术后21 d,与正常组比较,差异仍有统计学意义(P<0.001);注射不同剂量的医用臭氧后,CCI大鼠MWT值提高,在注射医用臭氧后各观察时间点与CCI组大鼠比较,差异均有统计学意义(P<0.001),且MWT提高值与医用臭氧注射量成正相关。表明局部注射医用臭氧对CCI大鼠有镇痛作用。假手术组大鼠在各观察时间点MWT值与正常组比较,差异无统计学意义;CCI+Air组大鼠在各观察时间点其MWT值与CCI组比较,差异无统计学意义(图1)。
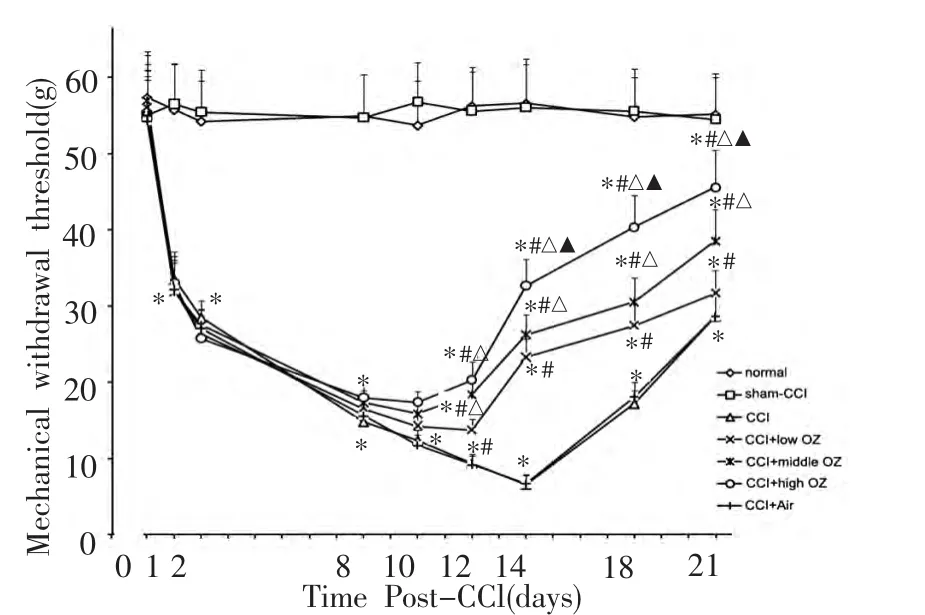
图1 各观察时间点大鼠机械痛阈变化曲线
*P<0.001,与同时间点正常组大鼠比较;#P <0.001,与同时间点CCI组大鼠比较;△P<0.001,与同时间点CCI+low OZ组大鼠比较;▲P<0.001,与同时间点CCI+middle OZ组大鼠比较。
图2 ACCI或医用臭氧治疗对大鼠lPAG中P2X3受体表达的影响
2.3 P2X3受体在PAG中的表达变化
取CCI手术后14 d各组大鼠(n=6),免疫组化染色提示:正常组和假手术组大鼠在PAG中仅有少量P2X3受体阳性细胞表达,差异无统计学意义。CCI组大鼠lPAG中P2X3受体表达增加,与正常组比较,差异有统计学意义(P<0.01);局部注射医用臭氧后P2X3受体表达进一步上调,与CCI组比较,差异有统计学意义(P<0.001),且随着臭氧注射量的增加,lPAG中P2X3受体的表达量增加;CCI+Air组大鼠lPAG中P2X3受体的表达与CCI组大鼠比较,差异无统计学意义。说明局部注射医用臭氧可促进CCI大鼠lPAG中P2X3受体表达上调(图2A,B)。
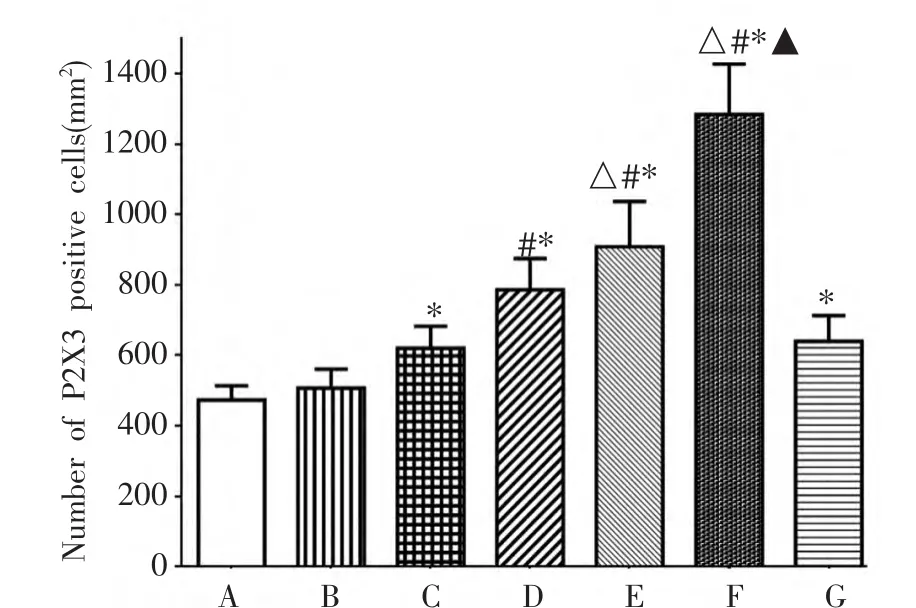
图2 BCCI或医用臭氧治疗后lPAG中P2X3阳性细胞数A.正常组;B.假手术组;C.CCI组;D.低剂量臭氧组;E.中剂量臭氧组;F.高剂量臭氧组;G.CCI+空气注射组。(Scale bars=20μm)。
2.4 A-317491对臭氧镇痛作用的拮抗效应
取CCI建模后14 d大鼠,分为CCI组、CCI+OZ组和CCI+A-317491+OZ组(n=8)。CCI+OZ组大鼠外周注射OZ后,MWT值在注射后10 min升高到最大值,此后在观察时间内(30 min),MWT值无显著变化;CCI+A-317491+OZ组大鼠给予lPAG中微量注射P2X3受体拮抗剂A-317491(1.5 nmol/0.3μL)5 min后,外周坐骨神经周围再给予35μg/mL(0.5 mL)医用臭氧注射。观察发现,在医用臭氧注射后10 min,MWT值上升达到最大值,与CCI组大鼠比较,差异有统计学意义(P<0.001),随后MWT值逐渐下降,在医用臭氧注射后30 min,其MWT值与CCI组大鼠比较,差异无统计学意义;与CCI+OZ组大鼠比较,CCI+A-317491+OZ组大鼠MWT值上升幅度减小,差异有统计学意义(P<0.001)(图3)。
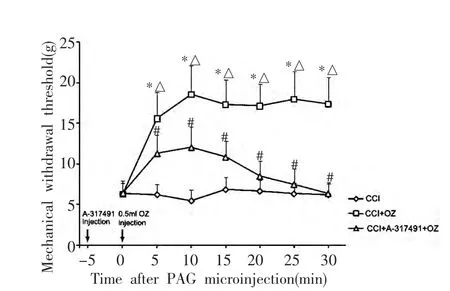
图3 A-317491预处理对医用臭氧镇痛作用的影响
3 讨论
根据国际疼痛研究协会(IASP)的定义,神经病理性疼痛指由于躯体感觉系统的损伤或疾病而直接引起的疼痛,表现为自发性疼痛、痛觉过敏、感觉缺失或异常痛敏等。各种原因(包括损伤、炎症因子、免疫因子等)引起的中枢和外周神经敏化在神经病理性疼痛的产生和维持中有重要作用[6]。医用臭氧广泛应用于临床神经病理性疼痛的镇痛治疗。目前研究认为医用臭氧的镇痛机制包括:(1)臭氧通过其抗炎作用,减少促炎症因子的释放,产生镇痛作用;(2)局部注射臭氧可以直接作用于外周神经末梢,促进脑腓肽等物质释放达到镇痛作用;(3)局部注射后刺激抗氧化酶的过度表达,通过清除氧自由基产生镇痛作用。另外有研究发现,局部注射臭氧后可刺激局部组织产生类似针灸样的疗效,使体内产生内源性镇痛物质,缓解疼痛[7]。
大量研究[8-9]表明ATP及其受体(P2X受体和P2Y受体)介入神经病理性疼痛的形成和维持过程,其中研究最多、最深入的是P2X3受体。外周神经损伤后,初级传入神经中枢端的P2X3受体激活,促进谷氨酸、P物质等疼痛相关递质和神经肽的释放,产生异常性疼痛或痛觉过敏现象[10]。研究发现,神经病理性疼痛和炎症性疼痛时,背根神经节P2X3受体蛋白的mRNA表达增加,感觉神经元P2X3受体介导 ATP激活电流明显增强[11]。通过局部注射或鞘内注射P2X3受体特异性拮抗剂A-317491可以对CCI、脊神经结扎等神经病理性疼痛大鼠具有良好的镇痛作用[12]。但在脊髓上结构,P2X3受体的活化产生镇痛作用。Fukui等[13]发现炎症性疼痛大鼠脑室内注射 ATP拟似物 αβmeATP,通过活化P2X3受体后产生镇痛作用,而预先给予A-317491或多次注射针对P2X3 mRNA的反义寡聚核苷酸,减少P2X3受体蛋白表达,可以翻转αβ-meATP的镇痛作用。
本课题组前期研究发现,lPAG中P2X3受体表达上调可促进机体的内源性镇痛系统功能,对CCI大鼠产生镇痛作用[2]。本实验发现:正常组大鼠lPAG中仅有少量P2X3受体阳性表达;大鼠CCI术后lPAG中P2X3受体阳性表达增加,此现象考虑为CCI手术引起的疼痛信息经上传后激活机体的内源性镇痛系统,引起PAG中P2X3受体表达的上调;给予医用臭氧局部注射后CCI大鼠机械痛阈值显著提高且P2X3受体在lPAG的阳性表达进一步增加,并与注射的医用臭氧剂量成正相关,说明外周局部注射医用臭氧可以促进CCI大鼠lPAG中P2X3受体的表达;本研究也发现,预先在lPAG中微量注射P2X3受体特异性拮抗剂A-317491后,可以部分翻转医用臭氧的镇痛作用。值得注意的是,在对正常大鼠注射医用臭氧后,大鼠机械痛阈及P2X3受体在lPAG中的表达与正常大鼠比较无明显差异,说明医用臭氧没有参与调节正常状态下P2X3受体在lPAG中的表达。以上研究说明:医用臭氧至少通过促进lPAG中P2X3受体表达的途径,促进机体的内源性镇痛系统,进而对CCI大鼠疼痛产生镇痛作用。Fuccio等[14]发现,外周皮下注射医用臭氧可以影响眶额叶皮层的促炎症因子和促凋亡因子mRNA的表达,最终对神经病理性疼痛小鼠产生镇痛作用,但具体机制不明。结合本研究,对于外周注射医用臭氧引起lPAG中P2X3受体表达增加的具体机制仍需进一步探索明确。
综上,可认为注射医用臭氧能有效缓解CCI大鼠的疼痛,为临床采用医用臭氧治疗神经病理性疼痛提供了新的理论依据。
[1] 胡鸿,游箭,魏欣,等.臭氧治疗腰椎间盘突出症术后复发的疗效分析[J].川北医学院学报,2012,27(4):335 -337.
[2] Xiao Z,Ou S,He WJ,et al.Role ofmidbrain periaqueductal gray P2X3 receptors in electroacupuncture-mediated endogenous pain modulatory systems[J].Brain Res,2010,1330:31 - 44.
[3] Bennett GJ,Xie YK.A peripheralmononeuropathy in rat that produces disorders of pain sensation like those seen inman[J].Pain,1988,33(1):87 -107.
[4] 刘永峰,杨承祥.坐骨神经周围注射可乐定对CCI大鼠促炎性细胞因子表达的影响[J].包头医学院学报,2009,25(5):19-22.
[5] Paxinos G,Watson C.The Rat Brain in Stereotaxic Coordinates[M].Sixth Edition,Amsterdam:Academic Press,2007:74 -76.
[6] Millan,MJ.The induction of pain:an integrative review[J].Prog Neurobiol,1999,57(1):1 -164.
[7] Bonetti M,Fontana A,Albertini F.CT-guided oxygen-ozone treatment for first degree spondylolisthesis and spondylolysis[J].Acta Neurochir Suppl,2005,92:87 -92.
[8] Hausmann R,Schmalzing G.P2X1 and P2X2 receptors in the central nervous system as possible drug targets[J].CNSNeurol Disord Drug Tatgets,2012,11(6):675 -686.
[9] Mo G,Peleshok JC,Cao CQ.Control of P2X3 channel function by metabotropic P2Y2 UTP receptors in primary sensory neurons[J].Mol Pharmacol,2013,83(3):640 -647.
[10] Nakatsuka T,Mena N,Ling J,et al.Depletion of substance P from rat primary sensory neurons by ATP,an implication of P2X receptor mediated release of substance P[J].Neuroscience,2001,107(2):293-300.
[11] Burnstock G.Purinergic P2 receptors as targets for novel analgesics[J].Pharmacol Ther,2006,110(3):433 - 454.
[12] Wu G,Whiteside GT,Lee G,et al.A-317491,a Selective P2X3/P2X2/3 receptor antagonist,reverses inflammatory mechanical hyperalgesia through action at peripheral receptors in rats[J].Eur J Pharmacol,2004,504(1 -2):45 -53.
[13] FukuiM,Nakagawa T,MinamiM,etal.Inhibitory role of supraspinal P2X3/P2X2/3 subtypes on nociception in rats[J].Mol Pain,2006,2:19.
[14] Fuccio C,Luongo C,Capodanno P,et al.A single subcutaneous injection of ozone prevents allodynia and decreases the over-expression of pro-inflammatory caspases in the orbito-frontal cortex of neuropathic mice[J].Eur J Pharmacol,2009,603(1 - 3):42 -49.
