米贝地尔对大鼠侧脑室下区神经干细胞体外增殖的影响
2015-04-12尉春艳
张 熙,尉春艳,古 茹,周 乐
西安交通大学第二附属医院,陕西西安 710004 1神经外科;2妇产科;3手术麻醉科
神经干细胞治疗中枢神经细胞损伤是目前的研究热点。神经干细胞具备以下几个优点:1)在不同微环境中可分化为不同功能的细胞,即多分化潜能;2)可在移植区域释放神经营养因子,优化损伤区域内神经功能恢复的内环境;3)可以免受大多数的继发性损伤分子的影响。我们的前期研究证明,脑外伤后侧脑室下区神经干细胞增殖能力明显增加[1],但是在修复过程中仍然面临着体内增殖、定向分化以及穿越胶质屏障重建突触连接等一系列困难。研究表明,T型钙通道与细胞的增殖密切相关[2-3],抑制T型钙通道的表达可抑制细胞周期蛋白,如Cyclin A、Cyclin D蛋白等,阻断细胞周期进程,抑制细胞的增殖。米贝地尔是特异性的T型钙通道阻滞剂。本实验通过研究体外条件下T型钙通道阻滞剂米贝地尔对神经干细胞增殖的影响,间接阐明T型钙通道在神经干细胞增殖中的作用。
材料和方法
1 主要材料与试剂 成年8周龄SD大鼠6只,清洁级,雄性,体质量200 ~ 250 g,由西安交通大学医学院动物中心提供。表皮生长因子(epidermal growth factor,EGF)(50μg),重组碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)(10μg)购自GIBICO公司,Nestin抗体(0.1 ml),GFAP抗体(0.1 ml),NSE抗体(0.1 ml)购自北京博奥森生物技术有限公司,米贝地尔(5 mg)购自Sigma公司。
2 脑损伤动物模型的建立 按文献[4]的方法,用液压损伤法建立脑损伤动物模型。用0.12 mol/L的苯巴比妥钠经腹腔麻醉(30 mg/kg),无菌条件下,沿头颅矢状缝做长约1 cm的正中切口,暴露颅骨外板,在头颅立体定位仪引导下,在冠状缝后2.3 mm,矢状缝旁开1.5 mm的右侧顶叶选取坐标点,用颅骨钻打开颅板,显示硬脑膜,将打击管埋置于硬脑膜外,并用牙托水泥固定。24 h后以0.2 MPa的压力冲击右侧顶叶皮质造成中度侧位液压冲击脑损伤。
3 神经干细胞的分离培养 将脑损伤术后7 d的成年大鼠,用0.12 mol/L的苯巴比妥钠经腹腔麻醉(30 mg/kg),无菌条件下暴露脑并剥离硬脑膜,以室下区为中心,迅速切除长1.0 ~ 1.5 cm脑组织,取出置入冷冻的D-hanks液中,沿侧脑室面切取室下区,修去损伤区附近的脑组织后,尽量剪成0 ~ 1 mm3的组织碎屑。将这些室下区碎屑移入含有0.1%的胰蛋白酶、0.67mg/ml的透明质酸酶和0.1 mg/ml DNA酶的混合酶液中,在培养箱(37℃,95% O2和5% CO2)中消化30 min后,移入预先已加有等体积的0.125%的大豆胰酶抑制剂的离心管内,反复吹打,尽可能地将残余的室下区组织小块机械性分离开来。铜网过滤。将滤过的液体收集入离心管内,800 r/min离心5 min,弃去上清液。然后再用基础培养基重悬细胞,800 r/min离心5 min。如此反复重复5 ~ 6次后,用神经干细胞完全培养基重悬细胞,经台盼蓝实验鉴定细胞活力后,调整细胞密度为50 000 ~ 100 000/ml,种入培养瓶内悬浮培养。接种24 h后换1次培养液,以后每隔7 d半量换液。以上过程均在无菌间内完成。
4 神经干细胞鉴定 单细胞悬液接种在事先用多聚赖氨酸包被的盖玻片上,37℃孵箱培养(95% O2和5% CO2)2 h后,行抗Nestin免疫染色。培养得到的神经干细胞克隆球用机械法传代以鉴定自我增殖能力。将培养获得的神经干细胞单细胞悬液/神经球接种在包被有多聚赖氨酸的盖玻片上,用含有10%胎牛血清的神经干细胞培养液进行诱导。24 h后随机分为两组:第一组行抗GFAP免疫染色,第二组行抗NSE免疫染色。
5 米贝地尔对神经干细胞球的影响 取第二代细胞,获取单细胞悬液,37℃孵箱培养(95% O2和5% CO2)培养24 h。培养基中分别加入米贝地尔0 μmol/L、1.25 μmol/L、2.5 μmol/L、5 μmol/L、10 μmol/L和20 μmol/L,37℃孵箱培养(95% O2和5% CO2)继续培养,4 d后检测各组神经干细胞球数。
6 MTT检测 取第二代细胞,获取单细胞悬液,以1 000 ~ 10 000/孔接种于96孔板,每孔200μl,37℃孵箱培养(95% O2和5% CO2)培养24 h。将米贝地尔以0 μmol/L、1.25 μmol/L、2.5 μmol/L、5 μmol/L、10 μmol/L和20 μmol/L的浓度分别加入接种有单细胞悬液的96孔板内,按米贝地尔浓度分6组,每组6孔,液体差异以完全培养基补足。37℃孵箱培养(95% O2和5% CO2)继续培养48 h。48 h后,每孔加5 mg/ml MTT液20μl,作用4 h后将96孔板置离心机内1 000 ~ 2 000 r/min离心5 min,使细胞球贴壁;小心吸弃培养基,加入DMSO 100μl/孔,室温下摇床震荡10 min,使结晶溶解,酶标仪检测各孔570 nm波长下OD值。并根据OD值计算细胞存活率、增值抑制率、半抑制浓度(half maximal inhibitory concentration,IC50)。细胞存活率=(实验组OD-空白组OD)/(对照组OD值-空白组OD值);增殖抑制率=1-(实验孔OD值-空白孔OD值)/(对照孔OD值-空白孔OD值)。
7 Western blot检测 将细胞分为实验组和对照组,实验组中根据IC50值加入相应浓度的米贝地尔,对照组中加入等量的PBS溶液,提取细胞总蛋白,经10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳,转移至聚偏氟乙烯膜。封闭2 h后与兔抗鼠Cyclin A抗体孵育过夜,二抗孵育1 h,化学发光显色,以β-actin为内参校正。
8 统计学分析 采用SPSS13.0统计软件处理,计量资料以-x±s表示,组间比较使用t检验,P<0.05为差异有统计学意义。
结 果
1 神经干细胞鉴定 细胞接种3 d后,在培养瓶中可发现有明显的干细胞克隆球形成,在显微镜可见这些干细胞克隆球由数十个细胞紧密聚集而成,克隆球大小不均等,细胞边缘光滑、中心膨隆有立体感,在形态上和简单的细胞聚集有显著差异(图1)。细胞传代后培养瓶中仍然可以长出类似的细胞球,且数目明显增多,细胞碎屑明显减少(图2)。免疫荧光标记显示这些细胞球表达神经干细胞的特征性标记物-Nestin,免疫染色呈强阳性(图4)。诱导分化后2 h即可见部分细胞自细胞球内向外迁移。2 d后大量细胞自细胞球内迁移出,并开始形成短小的突起,1周后镜下可见细胞形态成熟,可明确区分出各类神经细胞,视野下大部分为胶质细胞,尤以星形胶质细胞为主,神经元较少,散在分布,细胞突起相互间交织成网状(图3)。免疫荧光染色可见一部分细胞表达GFAP蛋白,一部分细胞表达NSE蛋白(图4)。
2 米贝地尔对神经干细胞球的影响 对照组细胞增殖快,镜下见大量细胞球,细胞球形态规则,边缘光滑,中心膨隆有立体感,未见皱缩细胞及细胞碎片。随着米贝地尔浓度增加,镜下细胞球数量逐渐减少,直径也随之减小,形态尚规则,并可见越来越多的皱缩细胞。至10μmol/L组镜下仅见数十个细胞组成的小细胞球,且细胞球数目极少,周围有大量细胞碎片。20μmol/L组镜下未见正常形态的神经干细胞及神经球,视野中全部为死亡细胞皱缩形成的细胞碎片(图5)。
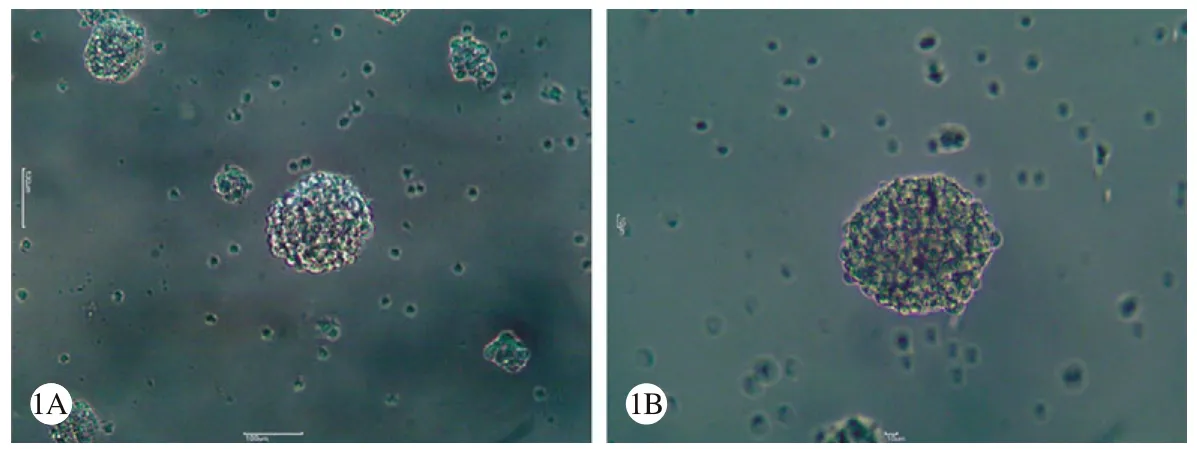
图1 原代培养神经干细胞形态(×40)A: 第3天; B:第6天Fig. 1 Neural stem cell morphology in primary culture (×40)A: The third day; B: The sixth day
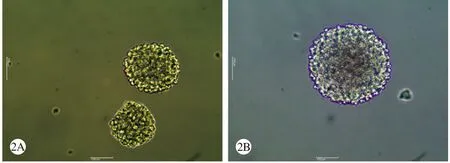
图2 第一次传代培养神经干细胞形态(×40)A: 第3天; B:第6天Fig. 2 Neural stem cell morphology after the f rst passage (×40)A: The third day; B: The sixth day

图3 诱导分化神经干细胞后的形态(×40)A: 第1天; B:第7天Fig. 3 Neural stem cell morphology after induction and differentiation (×40)A: The first day; B: The seventh day

图4 免疫荧光染色神经干细胞的形态(×40) A: Nestin; B: GFAP; C: NSEFig. 4 Immunof uorescence staining of neural stem cell (×40)A: Nestin staining of neural stem cell sphere; B: GFAP staining of neural stem cell after induction and differentiation; C: NSE staining of neural stem cell after induction and differentiation
3 MTT检测 与对照组相比较,1.25μmol/L组及2.5μmol/L组OD值稍降低,细胞存活率及增殖抑制率差异无统计学意义(P>0.05)。5μmol/L组、10μmol/L组和20μmol/L组与对照组比较,细胞存活率及增殖抑制率差异均有统计学意义。随着米贝地尔浓度增加,尤其是≥5μmol/L时,其对神经干细胞的增殖具有明显的抑制作用(图6,表1)。计算得IC50为8.93μmol/L。
4 Cyclin A蛋白的表达 在实验组中加入米贝地尔,Cylclin A蛋白的表达明显降低(图7)。
讨 论
神经干细胞具有自我更新能力并且能够分化产生不同类型的神经细胞,利用神经干细胞治疗中枢神经系统损伤成为目前的研究热点。它可通过:1)产生外源性神经元,桥接损伤断端,形成功能性突触,重新建立神经传导通路。2)分化产生少突胶质细胞,使损伤的脱髓鞘轴索再髓鞘化,恢复有髓神经电传导功能[5]。3)分泌多种神经营养因子改善脊髓局部微环境,对神经进行保护及免疫抑制作用[6]。4)启动再生相关基因的顺序表达使轴突再生,产生多种细胞外基质,填充脊髓损伤后遗留的空腔,为再生轴突提供支持物等机制达到治疗的目的。虽然理论上干细胞移植治疗神经系统损伤具有美好前景,但实际操作中仍然面临着许多问题,比如损伤后胶质瘢痕阻碍轴突再生,损伤局部微环境及继发损伤不利于移植细胞存活及增殖,神经干细胞定向分化等[7-8]。
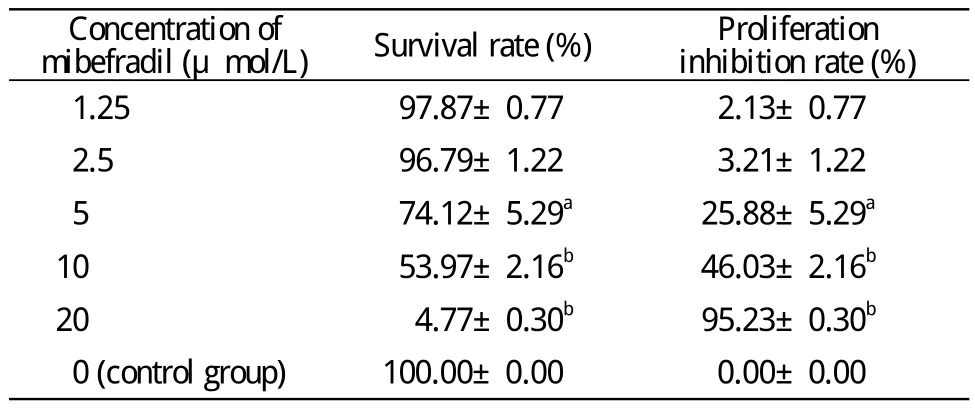
表1 不同浓度米贝地尔作用下神经干细胞的存活率及增殖抑制率Tab. 1 Survival rate and proliferation inhibition rate of neural stem cell in each group after adding different concentrations of mibefradil
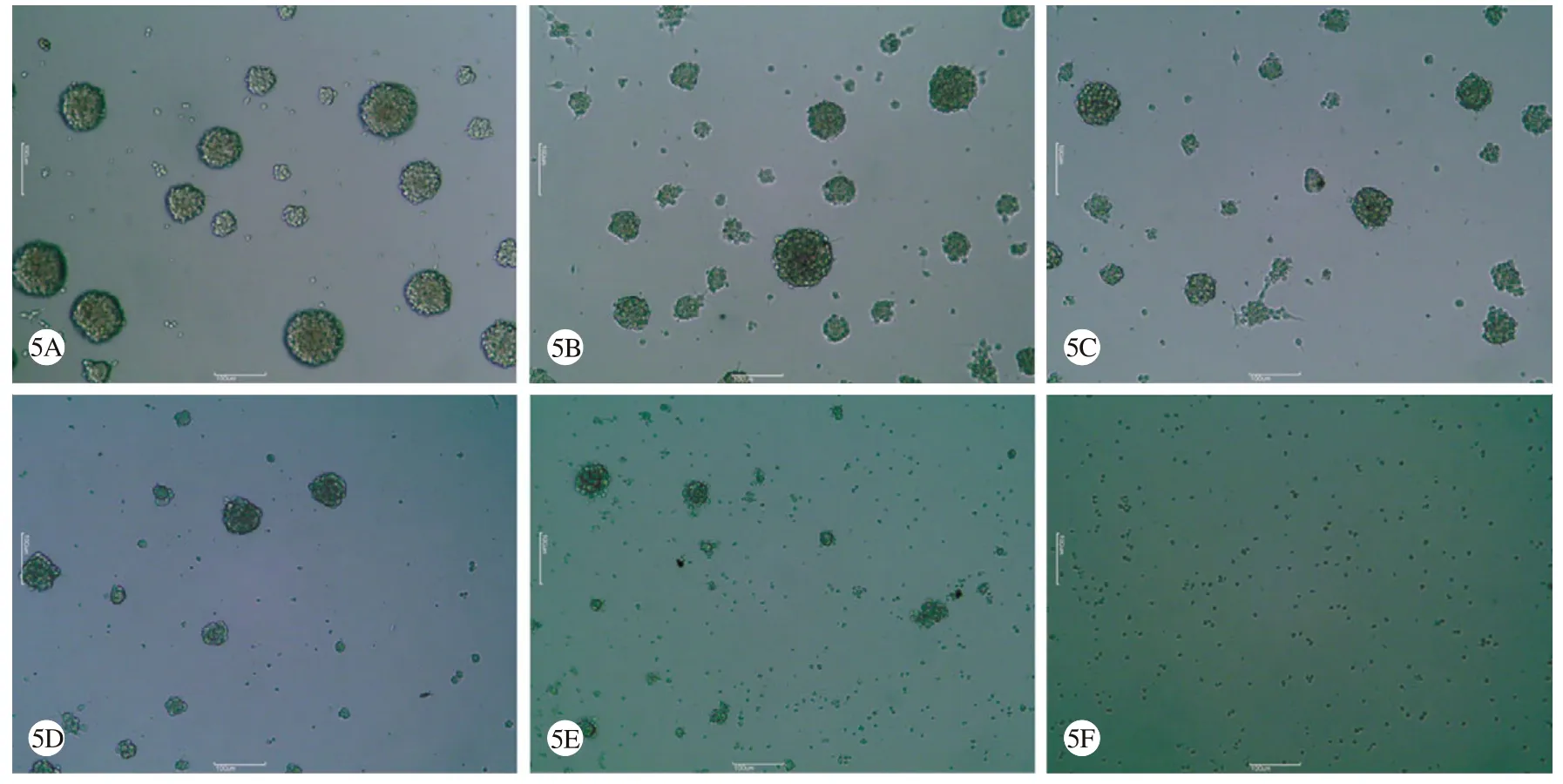
图5 加入不同浓度米贝地尔后各组神经干细胞球的鉴定A: Control组 B: 1.25μmol/L组; C: 2.5μmol/L组; D: 5μmol/L组; E: 10μmol/L组; F:20μmol/L组Fig. 5 Identif cation of neural stem cell spheres in each group after adding different concentrations of mibefradilA: Control group; B: 1.25μmol/L group; C: 2.5μmol/L group; D: 5μmol/L group; E: 10μmol/L group; F: 20μmol/L group

图6 加入不同浓度米贝地尔后各组OD值的鉴定Fig. 6 Identif cation of OD value in each group after adding different concentrations of mibefradil

图7 两组中Cyclin A蛋白的表达Fig. 7 Expression of Cyclin A protein in two groups
T型钙离子通道又名低电压激活钙通道,它具有易激活,失活缓慢,需要的电压阈值较低等特点[9-10]。T型钙通道家族包括3种T型钙通道亚型:Cav3.1、Cav3.2和Cav3.3,广泛表达于脑组织中,主要位于下橄榄核、丘脑、海马、下丘脑、室旁核、脑干网状结构、小脑深部核团、苍白球以及丘脑底核等[11-12]。Cav3.1蛋白主要位于神经元胞体和树突近端,Cav3.2蛋白主要位于神经元胞体和树突近端至中间部分,Cav3.3蛋白主要表达于特定类型细胞的胞体及树突[13]。研究表明,多种组织损伤后其内部的T型钙离子通道的表达明显上调[14]。我们的前期研究证明,颅脑损伤后脑组织内神经干细胞的增殖能力明显增加[1,15]。但是该过程是否与T型钙离子通道有关尚无定论。本研究构建了颅脑损伤模型,分离并培养侧脑室下区神经干细胞后,应用T型钙通道阻滞剂米贝地尔可明显抑制神经干细胞的增殖能力,说明了T型钙通道在神经干细胞的增殖过程中起着十分重要的作用。因此,在神经损伤后维持T型钙离子通道的功能,可促进神经干细胞的增殖,有利于神经损伤的修复。
在细胞的生长过程中,细胞只有通过了G1/S和G2/M期后才能够进行DNA的复制和增殖。在G1/S期,细胞需要外源性钙离子以及钙离子通道参与,刺激DNA复制所需的关键酶的分泌[14]。研究证明,T型钙通道存在于细胞的G1/S期,在其他阶段表达明显下调[16-17]。因此,T型钙通道在G1/S期发挥着十分重要的作用。Cyclin A的合成发生于G1期向S期的转变过程中,在中期时消失,属S期周期蛋白[18]。米贝地尔能够明显抑制Cyclin A蛋白的表达,说明它可能通过抑制细胞周期进展,尤其抑制是G0/G1期向S期进展,导致细胞凋亡,抑制神经干细胞的增殖,但其具体机制还需进一步研究。
1 屈建强,贺西京,杨平林,等.损伤反应性星形胶质细胞对成年大鼠室下区的再生作用[J].西安交通大学学报:医学版,2007,28(5):489-493.
2 Weaver EM, Zamora FJ, Puplampu-Dove YA, et al. Regulation of T-type Calcium Channel expression by Sodium butyrate in prostate cancer cells[J]. Eur J Pharmacol, 2015, 749: 20-31.
3 孙中洋,李东韬.成骨细胞钾、钙离子通道的研究进展[J].解放军医学院学报,2014,35(2):186-189.
4 傅西安,高国一,蒲军,等.PPAR-γ在液压脑损伤大鼠皮层的表达[J].中华神经外科疾病研究杂志,2014,13(4):326-328.
5 Tewarie RS, Hurtado A, Bartels RH, et al. Stem Cell-Based therapies for spinal cord injury[J]. J Spinal Cord Med, 2009, 32(2):105-114.
6 Kubinová S, Syková E. Nanotechnology for treatment of stroke and spinal cord injury[J]. Nanomedicine (Lond), 2010, 5(1):99-108.
7 Mouhieddine TH, Kobeissy FH, Itani M, et al. Stem cells in neuroinjury and neurodegenerative disorders: challenges and future neurotherapeutic prospects[J]. Neural Regen Res, 2014, 9(9):901-906.
8 Falnikar A, Li K, Lepore AC. Therapeutically targeting astrocytes with stem and progenitor cell transplantation following traumatic spinal cord injury[J]. Brain Res, 2014, pii:S0006-8993(14):01251-01259.
9 吕楠,肖波.T型钙离子通道在癫痫发生中的作用研究进展[J].中国神经精神疾病杂志,2013,39(7):447-448.
10 Engbers JD, Anderson D, Zamponi GW, et al. Signal processing by T-type Calcium Channel interactions in the cerebellum[J]. Front Cell Neurosci, 2013, 7: 230.
11 Cheong E, Shin HS. T-type Ca2+ channels in normal and abnormal brain functions[J]. Physiol Rev, 2013, 93(3): 961-992.
12 路蝉伊,刘立雄,张云峰.癫痫发病机制的研究进展[J].解放军医学院学报,2014,35(8):876-880.
13 Mckay BE, Mcrory JE, Molineux ML, et al. Ca(V)3 T-type Calcium Channel isoforms differentially distribute to somatic and dendritic compartments in rat central neurons[J]. Eur J Neurosci,2006, 24(9): 2581-2594.
14 Taylor JT, Zeng XB, Pottle JE, et al. Calcium signaling and T-type Calcium channels in cancer cell cycling[J]. World J Gastroenterol,2008, 14(32): 4984-4991.
15 屈建强,贺西京,杨平林,等.液压性脑损伤后室下区神经干细胞的分离培养与鉴定[J].中华神经外科疾病研究杂志,2007,6(5):396-399.
16 Dziegielewska B, Gray LS, Dziegielewski J. T-type Calcium channels blockers as new tools in cancer therapies[J]. Pflugers Arch, 2014,466(4): 801-810.
17 Li M, Zhang M, Huang L, et al. T-type Ca2+ channels are involved in high glucose-induced rat neonatal cardiomyocyte proliferation[J]. Pediatr Res, 2005, 57(4): 550-556.
18 Dai L, Liu Y, Liu J, et al. A novel cyclinE/cyclinA-CDK inhibitor targets p27(Kip1) degradation, cell cycle progression and cell survival: implications in cancer therapy[J]. Cancer Lett, 2013,333(1): 103-112.
