我院ICU环境多重耐药鲍曼不动杆菌基因多样性检测
2015-04-12于季红谢丽君索继江邢玉斌刘运喜
贾 宁,于季红,谢丽君,索继江,邢玉斌,刘运喜
解放军总医院 感染管理与疾病控制科,北京 100853
鲍曼不动杆菌属于条件致病菌,易寄生于人体或环境,生存能力强。自从1991年美国首次报道多重耐药鲍曼不动杆菌院内感染和流行以来,世界各国先后报道多重耐药鲍曼不动杆菌的流行和播散[1-2]。目前有关医院感染鲍曼不动杆菌的研究多集中于病人分离的菌株,医院环境中的多重耐药鲍曼不动杆菌的基因多样性及与病人分离株的相关性,相关报道很少。鉴于重症监护病房收治病人病情重、住院时间长、多重耐药菌感染多,医院环境易受污染。为此,我们收集了2010年10月- 2011年10月分离自我院3个重症监护病房环境的多重耐药鲍曼不动杆菌株,比较菌株间DNA指纹图谱,进而明确我院ICU环境中多重耐药鲍曼不动杆菌的主要流行菌株型,为医院感染病原菌的溯源提供技术支持和数据参考。
材料和方法
1 菌株来源 2010年10月1日- 2011年10月1日,每隔2周对外科监护室(20张床)、神经内科监护室(17张床)和呼吸科监护室(18张床)病人周边环境,包括床扶手、床边桌、监护仪、病人枕头以及护士袖口和ICU病房空气等部位,按《医疗机构消毒技术规范》2012版操作规程进行病原菌采样。
2 主要仪器与试剂 BioMérieux Vitek Colorimeter比浊仪、水浴摇床、水浴箱、CHEF-Ma pper脉冲电泳仪(Bio-Rad,美国)、Tanon GIS100013凝胶成像仪,SeaKem Gold琼脂糖凝胶购自美国CambraexBioScience Rockland公司,限制性内切酶ApaI购自Takara公司。
3 菌株培养及药物敏感性实验 菌株培养按临床检验操作规程常规方法进行,经法国生物梅里埃Viteck 32鉴定。分离的鲍曼不动杆菌-80℃保存。药物敏感性实验采用法国生物梅里埃公司ATB药敏条,对所收集的菌株对氨苄西林/舒巴坦、替卡西林、替卡西林/克拉维酸、哌拉西林、哌拉西林/他唑巴坦、头孢吡肟、亚胺培南、美罗培南、头孢他啶、阿米卡星、庆大霉素、妥布霉素、环丙沙星、多黏菌素E、复方新诺明的药物敏感性进行检测,参照美国实验室标准化委员会(NCCLS)判断标准进行判读。质控菌株大肠埃希菌ATCC25922和铜绿假单胞菌ATCC27853。根据规范对3类或3类以上抗菌药物同时呈现耐药的鲍曼不动杆菌,定义为多重耐药菌,纳入本次研究[3-4]。
4 脉冲场凝胶电泳(pulsed-field gel electrophoresis,PFGE)检测分子分型 取新鲜菌落,用比浊仪调整菌液溶度至3.6 ~ 4.5(4.0最佳)混匀。取400μl细菌悬浊液包埋后,20μl蛋白酶K(0.5 mg/ml)裂解,TE液洗脱,限制性内切酶ApaI 50 U 37℃水浴中孵育酶切至少4 h,0.5×TBE电泳缓冲液,电泳条件:电压6 V/cm,夹角120°,脉冲时间5 ~ 30 s,电泳20 h。电泳结束后,EB染色25 ~ 30 min,清水脱色60 ~ 90 min,Tanon GIS100013凝胶成像系统成像。根据PFGE图谱带型判断个体菌株间的相关性,条带数相同,且相应条带大小相同时,为同一克隆株;有3条以下(包括3条)条带差异的菌株,为同一克隆株的不同亚种;菌株出现4 ~ 6条带差异,为可能相关菌株;有7个或更多个条带的差异的菌株为不相关菌株。
5 统计方法 利用BioNumerics软件对菌株电泳结果进行聚类分析。
结 果
1 菌株分布 2010年10月- 2011年10月我院3个监护室病人周边环境共采集标本7 878份,分离鲍曼不动杆菌229株,其中多重耐药鲍曼不动杆菌89株,分离率为1.13%(89/7 878);在多重耐药鲍曼不动杆菌分离株中,呼吸监护室(RICU)占40.5%(36/89),外科监护室(SICU)占28.1%(25/89),神经内科监护室(NICU)占31.5%(28/89),3个监护室多重耐药鲍曼不动杆菌污染程度差异无统计学意义(P>0.05)。选取病人多重耐药鲍曼不动杆菌分离株4株,其中呼吸监护室3株,神内监护室1株,作为基因型对照(表1)。
2 多重耐药鲍曼不动杆菌PFGE聚类分析 对93株鲍曼不动杆菌进行PFGE分型,PFGE图谱条带为15 ~ 20条。同一ICU鲍曼不动杆菌PFGE图谱型相似但不完全相同。不同ICU鲍曼不动杆菌PFGE图谱型差异较大(图1)。93株鲍曼不动杆菌产生的基因图谱可分为A、B、C 3大聚类。A聚类分为A1 ~ A9九个亚聚类,在3个监护室均有分布,其中4株病人菌株均是A类,3株呼吸监护室病人菌株分别为A1、A5、A8亚聚类,1株神经内科监护室病人菌株为A8亚聚类。89株环境菌株以A2聚类为主,占24.7%;A1亚类和A8亚类均占15.1%,其中呼吸监护室环境菌株以A1亚类为主,占8.6%;A2亚类占7.5%、A8亚类占4.3%。外科监护室环境菌株以A2聚类为主占7.5%,为A1聚类占5.4%、A8聚类占4.3%;神经内科监护室环境菌株以A2聚类为主占9.7%,A6聚类占5.4%、A8聚类,A9聚类占4.3%。B聚类主要集中于呼吸监护室环境菌株中,占4.3%;C聚类集中在呼吸监护室环境菌株中占2.2%。
3 菌株间同源性分析 在同一监护室中,呼吸监护室同源性90%以上的菌株有3株,分别是病人痰液分离株(20110523h8-6,分离自2011年5月)、枕头分离株(20101206h11-1,分离自2010年12月)和护士袖口分离株(20101115h13-2,分离自2010年11月);神内监护室同源性90%以上的菌株2株,分别是病人痰液分离株(20110926s14-6,分离自2011年9月)和枕头分离株(20110509s13-1,分离自2011年5月)。在不同监护室间,存在同源性90%以上的分离株有3组:分离自外科监护室桌面的菌株(20101206w14-4,分离时间2010年12月)和分离自呼吸监护室枕头的菌株(20110912h9-1,分离时间2011年9月);分离自外科监护室枕头(20101206w5-1,分离时间2010年12月)和分离自呼吸监护室枕头(20101115h12-1,分离时间2010年11月)的菌株;呼吸监护室病人痰分离株(20101123h11-6,分离自2010年11月)与外科监护室病床枕头的分离株(20100829w1-1,分离自2010年8月)PFGE图谱型完全一致,同源性100%。

表1 3个监护室多重鲍曼不动杆菌环境菌株基因多态性分布Tab. 1 Genotype distribution of Acinetobacter baumannii isolated from three ICU (n, %)
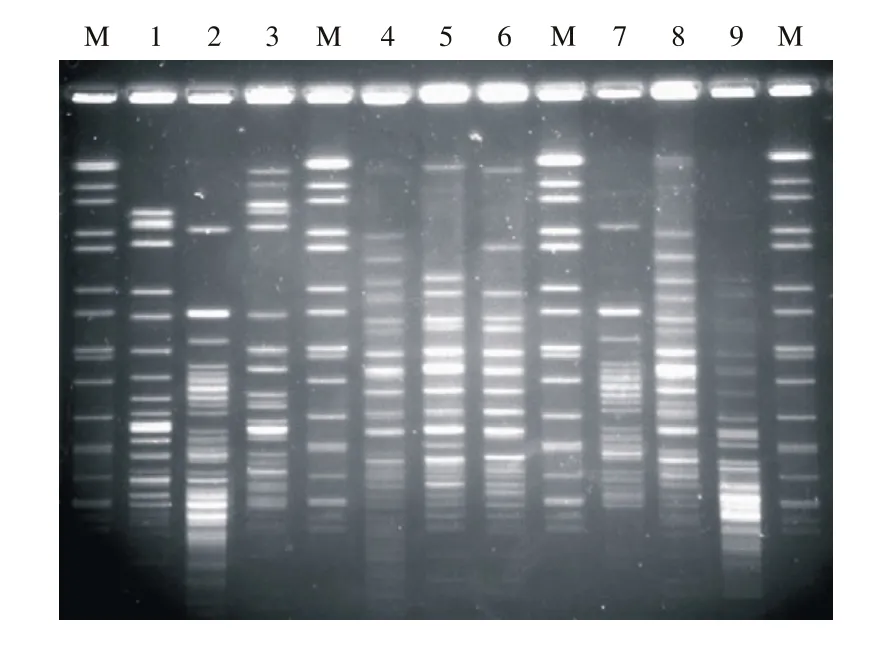
图1 9株鲍曼不动杆菌的PFGE电泳图Fig. 1 Electrophoretogram of 9 Acinectobacter baumanii isolates 1: NICU environment 20110912s14-1; 2: RICU human 20101123h11-6; 3: SICU environment 20110912w16-1; 4:RICU environment 20110912h9-5; 5: NICU environment 20110912s12-1; 6: RICU environment 20110912h9-1b; 7:SICU environment 20110829w1-1; 8: RICU environment 20110829h6-4; 9: SICU environment 20111109w15-2
讨 论
全球对多重耐药鲍曼不动杆菌的研究发现,欧洲、北美、阿根廷、巴西、中国大陆、中国台湾、中国香港、日本、韩国。甚至偏远的西太平洋大西地岛等,均存在多重耐药鲍曼不动杆菌克隆株的播散,不仅限于病房内、科室内、不同科室间,还可以在整个国家,甚至在不同国家间广泛传播[5-7]。但引起大范围流行与传播的多重耐药鲍曼不动杆菌均来源于病人。有关医院环境中的多重耐药鲍曼不动杆菌的基因多样性及与病人分离株的相关性如何,相关报道很少。
本次调查显示,在我院3个监护室病人周边环境共采集标本7 878份中,其中多重耐药鲍曼不动杆菌分离率为1.13%(89/7 878);3个监护室多重耐药鲍曼不动杆菌污染程度无统计学差异(P>0.05)。89株环境和4株鲍曼不动杆菌的基因图谱总体分散,当相似性系数为40%时,可分为A、B、C 3大聚类。89株环境菌株以A2亚类为主(占24.7%),其次为A1亚类和A8亚类(各占15.1%),时间和空间上未见集中趋势,提示监测期间,采取的每日两次清洁消毒,污染后随时清洁消毒的清洁方式下,各监护室没有形成优势菌株,造成播散。
在同一监护室中,呼吸监护室同源性90%以上的菌株有3株,护士袖口和枕头分离株分离时间相隔1个月,但与病人感染时间相隔5个月,病人之前未在我院住过院。神内监护室同源性90%以上的菌株2株,分离时间相隔5个月。在不同监护室间,存在同源性90%以上的分离株有3组,分离自外科监护室桌面的菌株和分离自呼吸监护室枕头的菌株分离时间间隔9个月;分离自外科监护室枕头和分离自呼吸监护室枕头的菌株分离时间间隔1个月;呼吸监护室病人痰分离株与外科监护室病床枕头的分离株分离时间间隔3个月。本次调查中虽然在相似性较高的菌株间没有明显的流行病学关联,但提示病人枕头分离株与病人菌株相关性较高,说明易被污染,在日常工作中应注意清洁消毒。
研究显示,鲍曼不动杆菌主要通过染色体基因突变、外膜孔蛋白改变、药物主动外排系统(adeABC基因簇编码的泵出系统[8])和产生灭活酶(如β-内酰胺酶、碳青霉烯酶[9]、钝化酶[10]等)等共同介导多重耐药性或泛耐药性。最近国外学者通过比较抗菌药物产生前后75余年多种致病菌中质粒种类及其基因结构,发现这些细菌的质粒谱并无明显变化,只是许多耐药质粒中出现了多种插入序列,这些可移动的特殊DNA序列(整合子)是介导耐药基因在质粒之间或质粒与染色体之间转移、集聚和重组的重要工具,它不仅可通过位点特异性重组系统在细菌中传播,而且具有高效捕获耐药基因的功能[11]。临床上出现多重耐药的鲍曼不动杆菌与可移动的整合子对耐药基因的积累是分不开的。本次研究中的分离的环境多重耐药菌株耐药性呈现较高水平,但除了5组(8株)环境菌株相关性较高以外,其余81株基因型呈多样性,没有明显的流行优势株,其耐药性的获得可能与质粒或整合子的水平传播有关,因而合理使用抗生素,尽可能减少筛选出携带新型耐药基因的菌株,才能有效防止多重耐药菌在医院内的暴发和环境污染。
1 Turkoglu M, Mirza E, Tunçcan OG, et al. Acinetobacter baumannii infection in patients with hematologic malignancies in intensive care unit: risk factors and impact on mortality[J]. J Crit Care, 2011,26(5):460-467.
2 Choi WS, Kim SH, Jeon EG, et al. Nosocomial outbreak of carbapenem-resistant Acinetobacter baumannii in intensive care units and successful outbreak control program[J]. J Korean Med Sci,2010, 25(7): 999-1004.
3 李春辉, 吴安华. MDR、XDR、PDR多重耐药菌暂行标准定义—国际专家建议[J]. 中国感染控制杂志, 2014, 13(1): 62-64.
4 Magiorakos AP, Srinivasan A, Carey RB, et al. Multidrug-resistant,extensively drug-resistant and pandrug-resistant bacteria: an international expert proposal for interim standard definitions for acquired resistance[J]. Clin Microbiol Infect, 2012, 18(3):268-281.
5 Sieniawski K, Kaczka K, Rucińska M, et al. Acinetobacter baumannii nosocomial infections[J]. Pol Przegl Chir, 2013, 85(9):483-490.
6 Lemos EV, De La Hoz FP, Einarson TR, et al. Carbapenem resistance and mortality in patients with Acinetobacter baumannii infection: systematic review and meta-analysis[J]. Clin Microbiol Infect, 2014, 20(5): 416-423.
7 Wang X, Xu X, Li Z, et al. An outbreak of a nosocomial NDM-1-producing Klebsiella pneumoniae ST147 at a teaching hospital in mainland China[J]. Microb Drug Resist, 2014, 20(2):144-149.
8 Bou G, Santillana E, Sheri A, et al. Design, synthesis, and crystal structures of 6-alkylidene-2’-substituted penicillanic acid sulfones as potent inhibitors of Acinetobacter baumannii OXA-24 carbapenemase[J]. J Am Chem Soc, 2010, 132(38):13320-13331.
9 Martins N, Dalla-Costa L, Uehara AA, et al. Emergence of Acinetobacter baumannii international clone II in Brazil: reflection of a global expansion[J]. Infect Genet Evol, 2013, 20:378-380.
10 Montefour K, Frieden J, Hurst S, et al. Acinetobacter baumannii:an emerging multidrug-resistant pathogen in critical care[J]. Crit Care Nurse, 2008, 28(1): 15-25.
11 Domingues S, Toleman MA, Nielsen KM, et al. Identical miniature inverted repeat transposable elements flank class 1 integrons in clinical isolates of Acinetobacter spp[J]. J Clin Microbiol, 2013,51(7): 2382-2384.
