非诱导型基因重组工程菌发酵产人血清白蛋白各种参数的变化规律
2015-04-12战伟超李辰雨徐世艾
战伟超,李辰雨,徐世艾 *,林 剑
(1.烟台大学 生命科学学院,山东 烟台 264005;2.烟台大学 化学化工学院,山东 烟台 264005)
人血清白蛋白(human serum albumin,HSA)是人血浆中最丰富的蛋白成分[1],占血浆总蛋白的60%,每升成人血液中约有40 g 白蛋白,占血清总蛋白的(58±4)%[2-3]。人血清白蛋白不仅在中国,在世界上都拥有巨大的市场[4],其主要作用是维持血液正常渗透压,同时也是运输外源性和内源性物质必不可缺的载体[5-6];最新研究还发现人血清白蛋白与CD4受体形成的融合蛋白(HSACD4),有望成为阻止艾滋病病毒(human immunodeficiency virus,HIV)感染的阻断剂[7]:这种融合蛋白能够阻断艾滋病病毒感染CD4+淋巴细胞的途径[8],因此可以将其作为一种特效药进行更深层次的研究。当前,白蛋白类药物制剂多数来源于血液的直接提取[9-11],但是由于检测技术的不完善和血液来源的不稳定性及缺乏性,极易导致使用者感染艾滋病病毒或其他可以通过血液传播的疾病[12]。不仅仅如此,如果只是从血液中提取人血清白蛋白用于医用,是远远无法满足市场的巨大需求的[13-15],因此寻找一种新型的、安全的、可以大量生产白蛋白的方法迫在眉睫。采用转基因非诱导型毕赤氏酵母(Pichia pastoris)表达重组人血清白蛋白(recombinant HSA,rHSA),与目前文献报道的广泛采用的甲醇诱导型毕赤氏酵母[16]相比,具有下列优点:首先该菌株发酵过程中不需要添加甲醇诱导剂[17],这种优势降低了发酵过程中补料的危险系数,减少了染菌的可能性,产品的分离纯化可实现无污染排放;其次是在其发酵培养基中的碳源以葡萄糖为主,降低了甘油的使用量,能够有效的降低生产成本。另外该转基因非诱导型毕赤氏酵母在构建过程中将目的基因插入到表达甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)蛋白序列的前端,从理论上讲该工程菌表达的白蛋白应该是随着菌体的生长的而进行的,整个发酵周期明显缩短。
本实验以转基因非诱导型毕赤氏酵母为菌株,研究了该菌株在发酵过程中的生长规律、pH值的变化规律、人造血清白蛋白的产生规律等,为利用转基因非诱导型毕赤氏酵母高密度发酵产重组血清白蛋白提供了一定的研究基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
转基因非诱导型毕赤氏酵母菌株(Pichia pastoris)NCY-1:山东大学应用生命科学研究中心构建。
1.1.2 培养基
斜面培养基:酵母浸粉10 g/L,蛋白胨20 g/L,葡萄糖20 g/L,琼脂30 g/L。
种子培养基采用酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:酵母浸粉10 g/L,胰蛋白胨20 g/L,葡萄糖20 g/L。
摇瓶培养基:酵母提取物20 g/L,葡萄糖40 g/L,山梨醇15 g/L,甘油15 g/L,KH2PO42 g/L,FeSO4·7H2O 0.10 g/L,营养盐0.10 g/L。
发酵培养基:酵母提取物40 g/L,葡萄糖40 g/L,山梨醇30g/L,KH2PO42g/L,FeSO4·7H2O0.10g/L,营养盐10mL/L(单独灭菌),消泡剂1 mL/L。
营养盐:ZnSO4·H2O 20 g/L,MgSO4·7H2O 40 g/L,MnSO4·H2O 10 g/L。
1.1.3 化学试剂
酵母浸粉:FM888 安琪酵母股份有限公司;牛血清白蛋白(bovine serum albumin,BSA)标准品:北京索莱宝科技有限公司。其余试剂均为国药集团化学试剂有限公司生产的分析纯试剂。
1.2 仪器与设备
10JSA全自动代谢流发酵罐:上海保兴生物设备工程有限公司;DK-98-11多功能万用炉:天津泰斯仪器有限公司;Waters 1525液相色谱仪:美国Waters公司;Anke TKL-5-A离心机:上海标仪仪器有限公司;Motic BA310双目显微镜:北京汗盟紫星仪器仪表有限公司;AR1530电子天平:奥豪斯仪器(上海)有限公司;LRH-250生化培养箱:上海一恒科学仪器有限公司;ZWY-2102恒温培养振荡器:上海智诚分析仪器制造有限公司;G180TW全制动高压灭菌锅:致微仪器有限公司;XB-K-25型血细胞计数板:浙江省玉环县求精医用仪器厂;SW-CJ-2FD超净工作台:苏洁净化设备有限公司。
1.3 实验方法
1.3.1 种子培养
按10%的装液量,分别取2个3 L的锥形瓶装入300 mL的种子液,121 ℃、20 min、0.12 MPa灭菌后,在超净工作台上分别用接种针接入一环菌,放入恒温培养箱中220 r/min、30 ℃培养16 h。
1.3.2 摇瓶培养
按10%的装液量,在3 L锥形瓶中装入300 mL的发酵液,121 ℃、20 min、0.12 MPa灭菌后,在超净工作台上按10%的接种量接种,放入恒温培养箱中220 r/min、30 ℃培养70 h。
1.3.3 机械搅拌式发酵罐培养
在挑取一定量的菌分别接种到两个3 000 mL的锥形瓶中,装液量为300 mL,30 ℃、220 r/min培养16~18 h后,按10%体积比的接种量接种到10 L的机械式搅拌发酵罐中,控制通风比为1∶0.7,罐压0.02 MPa,搅拌转速350 r/min,温度30 ℃发酵90 h。
1.3.4 NCY-1菌株发酵液对白蛋白的水解
根据文献报道,甲醇诱导型菌株在合成白蛋白的过程中能够分泌蛋白酶并将发酵液中的白蛋白水解[13],导致发酵后期白蛋白浓度下降。尽管该菌株为非诱导型,但是也可能存在同一现象,为此设计了以下实验。
取一定体积的发酵液,在5 500 r/min条件下,常温离心10 min分离掉发酵液中的酵母细胞。分别取20 mL上清液,一份准确直接加入1.00 g的牛血清白蛋白,一份加热到100 ℃保温10 min灭掉酶活后冷却到常温,再加入1.00 g牛血清白蛋白。另取20 mL新配的发酵液加入1.00 g牛血清白蛋白作为空白对照。将上述3份溶液同时放在30 ℃水浴锅中保温10 h后分别测其溶液中残留的白蛋白含量。
1.3.5 分析方法
(1)菌体浓度:显微镜直接计数法[18]。
(2)重组人血清白蛋白检测方法[19]。
重组人血清白蛋白采用高效液相色谱法测定,色谱条件如下:
流动相:0.1 mol/L 磷酸盐缓冲液(phosphate buffer saline,PBS),1%异丙醇,0.05%三氮化钠(NaN3);凝胶色谱柱:TOSOH TSK-GEL G3000SW(7.8 mm×30 cm);流速0.6 mL/min;检测波长:280 nm;柱温:30 ℃,进样量:20 μL。
牛血清白蛋白标准曲线的制备:准确称取0.10 g的牛血清白蛋白用去离子水定容于100 mL容量瓶配制成为1 g/L牛血清白蛋白标准溶液,用去离子水将标准溶液稀释为100mg/L、200 mg/L、300 mg/L、400 mg/L、500 mg/L、600 mg/L牛血清白蛋白标准使用液,分别取不同质量浓度的稀释液20 μL进样,得出不同的峰面积并绘制标准曲线。
(3)其他指标
葡萄糖的含量采用费林试剂滴定法[20];白蛋白含量采用考马斯亮蓝法测定[21];铵根离子(NH4+)含量采用靛酚蓝-分光光度法测定[22]。
2 结果与分析
2.1 高效液相色谱法测牛血清白蛋白标准曲线
以峰面积(x)为横坐标,牛血清蛋白质量浓度(y)为纵坐标,绘制牛血清白蛋白标准曲线如图1所示。由图1可知,标准曲线的回归方程为y=19.791 0x+4.580 1,相关系数R2=0.999 6,表明二者线性关系良好。
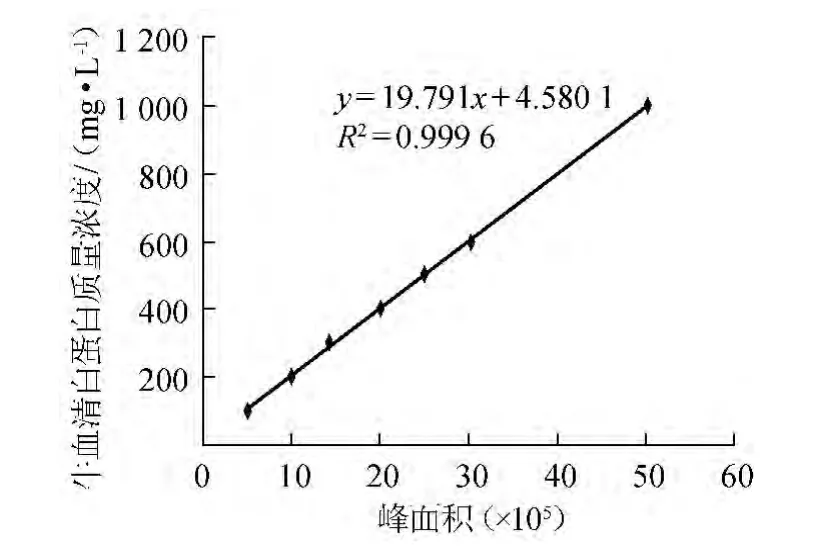
图1 牛血清白蛋白标准曲线Fig.1 Standard curve of BSA
2.2 10 L机械搅拌式发酵罐培养结果
2.2.1 菌体浓度及葡萄糖量对rHSA的影响
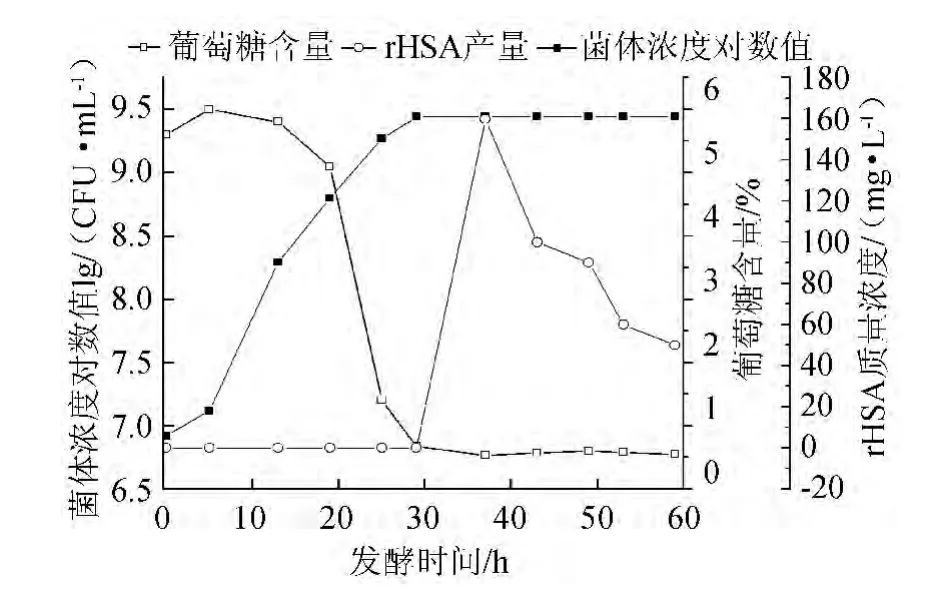
图2 rHSA分批发酵实验结果Fig.2 Experimental results of rHSA batch fermentation
由图2可知,该基因工程菌在前8 h为延滞期,此时菌体数目基本保持不变,发酵液中白蛋白含量为0;8 h后菌体进入对数生长期,菌体大量增殖,菌体开始不断地代谢碳源,将发酵液镜检观察到发酵液中的毕赤氏酵母多方位出芽,并且存在大量的体型较小的“小”酵母;30 h前,发酵液中存在rHSA但含量极低,在36 h时,对数生长期结束,发酵液中菌体体型形态正常,极少数菌体仍处于出芽状态,菌体最大浓度达到3.0×109个/mL,随后菌体进入平稳期,菌体浓度不再大幅上升,发酵液中的rHSA达到最大值160 mg/L,但随着时间的延续发酵液中的rHSA被不断降解时发酵液中的rHSA含量降低。菌体进入稳定期后,发酵液中的残糖量基本保持不变维持在5 g/L附近。因此,在10 L机械式搅拌发酵罐水平上,菌体在30 h后进入平稳期,发酵液中rHSA产量达到最高160 mg/L。
2.2.2 溶氧与重组人血清蛋白含量的关系
溶氧在发酵过程中不断变化,其与rHSA含量的关系见图3。
由图3可知,当菌体进入对数生长期后,溶氧(dissolved oxygen,OD)值一直保持在一个较低的水平,低水平的溶氧值一直维持到了稳定期的后期,当rHSA被大量水解后,发酵液的DO值迅速上升,此时发酵液能闻到一股乙醇的味道,发酵液中的NCY-1菌体开始进入无氧呼吸阶段。因此当发酵液中的DO值突然升高时可以作为结束发酵的一个考虑指标。
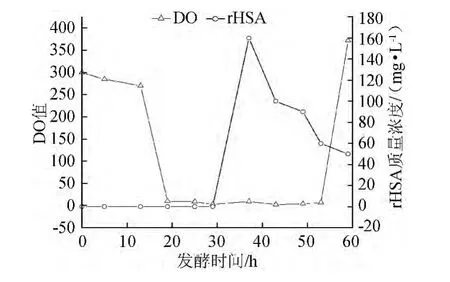
图3 DO和rHSA 的关系Fig.3 Relationship between DO and rHSA
2.2.3 补料对菌体浓度和rHSA产量的影响
在发酵后期由于碳源的不足导致菌体浓度不再增加,发酵液中的rHSA产量也不再上升,因此考虑到了通过后期补料的方法来刺激菌体的二次生长。补加葡萄糖及甘油对菌体浓度影响的实验结果如图4所示。
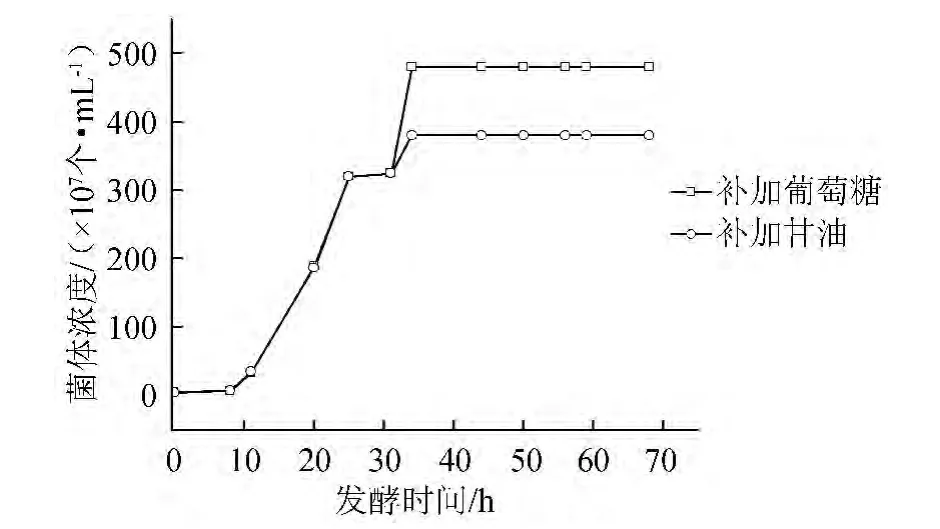
图4 补料对菌体浓度的影响Fig.4 Effect of feeding on the concentration of yeast
由图4可知,后期(发酵时间30 h后)补加10 g/L葡萄糖或是10 g/L甘油都会刺激菌体的二次生长,但是葡萄糖促使菌体二次生长的效果明显要高于甘油。补料后2 h分别对发酵液中的菌体浓度及rHSA产量进行了测定,发现补加了葡萄糖的发酵液中菌体浓度及rHSA的最高产量可分别达到4.95×109个/mL及185 mg/L,而补加了甘油的发酵液中菌体浓度及rHSA的最高产量可分别达到3.85×109个/mL及176 mg/L。NCY-1产rHSA的作用机理是将目的基因插入到甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GADP)蛋白序列的前端,所以只要发酵液中的NCY-1表达3-磷酸甘油醛脱氢酶,发酵液中就应该表达外源插入的rHSA基因。甘油是三碳化合物,在甘油激酶的催化下,磷酸化成3-磷酸甘油,然后经氧化脱氢酶变成磷酸二羟丙酮再经3-磷酸甘油醛脱氢酶进入糖酵解途径(embden-meyerhof-parnas pathway,EMP)。但是由于发酵液中的葡萄糖效应以及发酵液中加入甘油后会形成甘油二酯和甘油三酯等物质,所以促进菌体生长及rHSA产生的效果不如葡萄糖,因此若想通过后期(发酵时间30 h后)补加的方式来增加rHSA的产量,优先选择流加10 g/L葡萄糖。
2.3 3 L摇瓶水平的实验结果
2.3.1 发酵液中蛋白酶的研究结果
在3 L摇瓶水平发酵结束后,分别取出20 mL发酵液,加入1.00 g rHSA,再取20 mL蒸馏水加入1.00 g rHSA作为空白组实验。结果如表1所示。

表1 加热处理对rHSA含量的影响Table 1 Effect of heat treatment on rHSA content
由表1可知,没有加热处理的发酵液,经过30 ℃的保温处理10 h后,加入的1.00 g牛血清白蛋白完全被水解,而经过加热处理的发酵液尽管经过30 ℃的保温处理10 h后,其白蛋白浓度基本保持不变,这充分说明菌株NCY-1在合成白蛋白的过程中也能够分泌一定量的胞外蛋白酶,导致发酵液中的rHSA被降解。空白试验说明新配的发酵液中没有蛋白酶,所以蛋白酶的来源并非是原始发酵液而是在后期的发酵过程中产生的,所以要想提高发酵液中rHSA的产量需要在后期注意抑制蛋白酶的活力。
2.3.2 硫酸铵对发酵液中rHSA含量的影响
为探究发酵液中铵离子对rHSA含量的影响,在3 L摇瓶水平上进行了如下实验,在实验组中,始终维持发酵液中的(NH4)+质量浓度在3.0 g/L,而空白组不做任何处理,实验结果如图5所示。
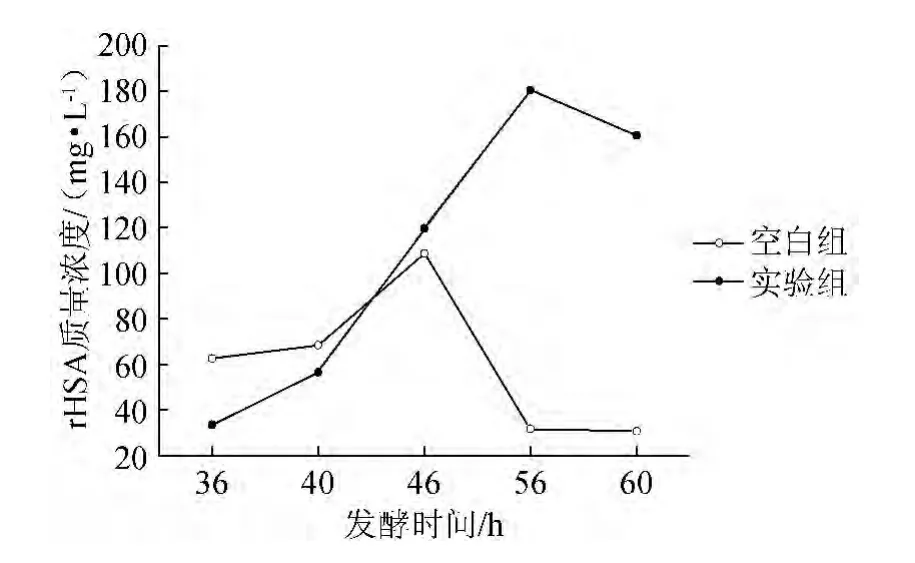
图5 铵离子浓度对rHSA含量的影响Fig.5 Effect of NH4+concentration on rHSA content
由图5可知,发酵时间<46 h,空白组中的rHSA的含量略高于实验组,原因可能是在发酵前期,硫酸铵影响了发酵液中的pH值,使溶液pH值高于NCY-1的最适生长pH值,影响了菌体的正常生长,所以前期空白组中蛋白表达量较高。发酵时间>46 h以后,菌体进入稳定期,空白组蛋白的表达量明显低于实验组,可能原因是,发酵液中存在的硫酸铵不仅抑制了蛋白酶的活性,还为NCY-1合成白蛋白提供了充足的铵离子,所以使得发酵液中的蛋白含量偏高,但是发酵时间>56 h后,白蛋白的含量还是有所下降,可能原因是发酵液中的碳源不足,导致rHSA被分解。所以在后期实验可以考虑在菌体进入稳定生长期约30 h时再补加硫酸铵,使流加后发酵液中的铵离子浓度始终维持在3.0 g/L。
3 结论
由于种子液与发酵培养基组成成分相似,所以种子液一经接种到10 L机械搅拌式发酵罐中,菌体立刻入了对数生长期,30 h后菌体进入平稳期,菌体能达到的最大菌体浓度为3.0×109个/mL,最大rHSA产量为160 mg/L,30 h后在发酵罐中补加10 g/L葡萄糖后,最大产量可达到185 mg/L;而在3 L摇瓶基础上的实验得出发酵液中确实存在较高活性的蛋白酶,但若始终保持发酵液中铵离子含量为3.0 g/L时,能有效的缓解发酵液中的rHSA的降解速度,提高发酵液中rHSA的产量。在后续实验中可以考虑将硫酸铵的作用放大到10 L发酵罐中,以期达到更好的效果。
[1]VERMEULEN J N,MEIJER D K,OVER J,et al.A phase I/IIa study with succinylated human serum albumin (Suc-HSA),a candidate HIV-1 fusion inhibitor[J].Antivir Ther,2007,12(2):273-278.
[2]刘永东,王云山,苏志国.重组人血清白蛋白生产工艺研究进展[J].微生物学通报,2003,30(5):128-132.
[3]殷艺伟,陈建华.重组人血清白蛋白的药学应用研究进展[J].药学进展,2006,30(2):70-74.
[4]李柏志.蛋白酶缺陷型毕赤酵母重组表达人血白蛋白中试发酵工艺的研究[D].吉林:吉林大学博士论文,2012.
[5]刘彦丽.巴斯德毕赤酵母发酵生产重组人血清白蛋白的研究[D].北京:北京化工大学硕士论文,2003.
[6]邱荣德,李士云,陈俊刚,等.重组人血清白蛋白在Pichia pastoris 中的表达与纯化[J].生物化学与生物物理学报,2000,32(1):59-62.
[7]张惠展.基因工程概论[M].上海:华东理工大学出版社,1999.
[8]CHAUHAN A K,ARORA D,KHANNA N.A novel feeding strategy for enhanced protein production by fed-batch fermentation in recombinant Pichia pastoris[J].Process Biochem,1999,34(2):139-145.
[9]CREGG J M,VEDVICK T S,RASCHKE W C.Recent advances in the expression of foreign genes inPichia pastoris[J].Biotechnology,1993,11(8):905-910.
[10]刘彦丽,刘永东,王艳辉,等.毕赤酵母发酵生产重组人血清白蛋白高密度培养条件的研究[J].北京化工大学学报:自然科学版,2003,30(4):25-28.
[11]孙战胜.重组人血清白蛋白在巴斯德毕赤酵母中的表达[J].北京:北京化工大学硕士论文,2004.
[12]UENO Y,MIO M,SATO C,et al.Single particle conformations of human serum albumin by electronmicroscopy[J].J Election Microsc,2007,56(3):103-110.
[13]满初日嘎,张英霞,张 云.重组人血清白蛋白的研究进展[J].生物医学工程学杂志,2009,26(4):900-903.
[14]黄明志,郭美锦,储 炬,等.重组人血清白蛋白发酵过程生长期的代谢计算[J].生物工程学报,2000,16(5):631-635.
[15]陈光明,周长林,魏元刚,等.发酵液中重组人血清白蛋白的纯化[J].药物生物技术,2003,10(1):25-28.
[16]郭美锦,庄英萍,吴康华,等.基因工程菌Pichia pastoris高密度发酵表达重组人血清白蛋白[J].华东理工大学学报:自然科学版,2002,28(1):101-103.
[17]周 鹏,赖心田,洪 葵.甲醇毕赤氏酵母在基因工程药物研发中的重要作用[C]//新世纪新机遇新挑战——知识创新和高新技术产业发展(上册).2001.
[18]沈 萍,陈向东.微生物学实验[M].北京:高等教育出版社,2007.
[19]王晓华,朱文渊.生物化学与分子生物学实验技术[M].北京:化学工业出版社.2008.
[20]山根恒夫著.生化反应工程[M].周斌编译.西安:西北大学出版社,1992:241-242.
[21]李 娟,张耀庭,曾 伟,等.应用考马斯亮蓝法测定总蛋白含量[J].中国生物制品学杂志,2000,13(2):118-120.
[22]梁剑光,朱 玲,徐正军.靛酚蓝-分光光度法测定发酵液中氨态氮含量研究[J].食品与发酵工业,2006,32(9):134-137.
