豆瓣中腐败菌蜡样芽孢杆菌性能及对抗生素敏感性研究
2015-04-12车振明周欣悦关统伟
董 丹,车振明,杨 娜,周欣悦,关统伟*
(西华大学 微生物研究所,食品生物技术四川省高校重点实验室,四川 成都 610039)
蜡样芽孢杆菌(Bacillus cereus)又名仙人掌杆菌,是芽孢杆菌属中的一种[1],分布广泛,常见于土壤、灰尘和污水中,在植物性食品和许多生熟食品中都常见;是一种好氧性、在厌氧情况下也可很好生长的革兰氏阳性杆菌[2]。有的蜡样芽孢杆菌菌株可作为益生菌添加到食品和饲料中;有的菌株则为条件致病菌,容易污染食物,引起人畜肠道疾病,甚至严重的呼吸系统感染[3]。蜡样芽孢杆菌存在于生活中的各个地方,如冷藏不当的食物、饮水、空气中等[4-7]。蜡样芽孢杆菌对人体造成危害的方式主要是通过食物进入人体,在人体内产生毒素。有的菌株能产生耐热的催吐毒素,引起呕吐。剩饭冷藏不当后容易产生很多蜡样芽孢杆菌,蜡样芽孢杆菌进入人体后或有8~16 h的潜伏期,若食用放置过久的剩饭易出现胃痛、呕吐症状[8-10],这就是常见的蜡样芽孢杆菌中毒。此外,人体发生食物中毒,也可能是由蜡样芽孢杆菌产生的热稳定性毒素所造成的。基于以上问题,本研究通过检测豆瓣中分离蜡样芽孢杆菌的生长特性以及抗生素敏感性能更好地了解蜡样芽孢杆菌的生长环境。根据这些生长特性,可以在豆瓣生产过程中更好地控制生产条件,从而抑制蜡样芽孢杆菌的生长,保证豆瓣酱的安全性;此外,在日常生活中也可以利用其生长特性来预防食物因蜡样芽孢杆菌造成的食物中毒。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株来源
实验所用菌株蜡样芽孢杆菌(Bacillus cereus)为郫县豆瓣酱中分离所得,编号ZZ1001。
1.1.2 实验试剂
蛋白胨、牛肉膏、酵母粉、氯化钠、琼脂:成都市科龙剂化工厂。
抗菌药物:本实验共选用25种常用药敏试纸,分别为链霉素、庆大霉素、青霉素G、可奇霉素、林克霉素、多粘菌素B、奈替米星、奈替米星、呋喃妥因、新生霉素、萘啶酸、环丙沙星、卡那霉素、头孢西丁、氧氟沙星、复方新诺明、妥布霉素、克林霉素、红霉素、氯霉素、氨苄西林、羧苄青霉素、诺氟沙星、头孢噻胯、利福平:杭州天和微生物试剂有限公司。
1.1.3 培养基
牛肉膏蛋白胨培养基:牛肉膏0.3 g,蛋白胨1.0 g,氯化钠0.5 g,琼脂1.5 g,水100 mL,调整pH值至7.2~7.6。
LB培养基(固态):蛋白胨10 g,酵母膏5 g,NaCl 5 g,琼脂15 g,蒸馏水1 000 mL,pH 7.2。
1.2 仪器与设备
LDZX-75KB立式压力蒸汽灭菌器:上海中安医疗器械厂;SW-CJ-2F双人双面净化工作台:苏州净化设备有限公司;SC-316海尔立式冷藏柜:青岛海尔特种电冰柜有限公司;DHG-9075A电热恒温鼓风干燥箱:上海一恒科学仪器有限公司;TB-214电子天平:北京赛多利斯仪器系统有限公司。
1.3 实验方法
1.3.1 蜡样芽孢杆菌在不同温度条件下生长研究
菌种的活化:将保存在-20 ℃下的甘油管放置于4 ℃条件下解冻,待甘油完全融化过后,迅速吸取100 μL的菌种保存液于LB培养基上,用涂布棒在无菌条件下涂布均匀后,置于37 ℃恒温培养箱中培养,直至长出明显的菌落。
将活化蜡样芽孢杆菌用无菌竹签蘸取少量菌于2 mL无菌水中,摇匀,然后用移液枪分别移取100 μL稀释液于牛肉膏蛋白胨培养基上,在无菌操作台内,用涂布棒均匀涂布,再分别置于5 ℃、15 ℃、25 ℃、35 ℃、45 ℃、55 ℃恒温培养箱中培养24 h[11],每个温度下做3个平行,观察细菌生长状况并计算各个培养基上菌落数,并计算不同温度条件下每个培养基菌落数的平均值。
1.3.2 蜡样芽孢杆菌在不同pH值条件下生长研究
将活化蜡样芽孢杆菌用无菌竹签蘸取少量菌于2 mL无菌水中,摇匀,然后用移液枪分别移取100 μL稀释液至0.02%的盐酸以及0.005%的氢氧化钠溶液调节的pH值分别为3.0、4.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、10.0、11.0的牛肉膏蛋白胨培养基上,用涂布棒均匀涂布,并置于37 ℃恒温培养箱中培养24 h,每个pH值条件下做3个平行,观察细菌生长状况并计数各个pH值培养基上的菌落数,并计算各个pH值条件下菌落数的平均值。
1.3.3 蜡样芽孢杆菌在不同盐含量条件下生长研究
将活化蜡样芽孢杆菌用无菌竹签蘸取少量菌于2 mL无菌水中,摇匀,然后用移液枪分别移取100 μL稀释液至氯化钠质量分数分别为0、2%、4%、6%、8%、10%、12%、14%的牛肉膏蛋白胨养基上,用涂布棒均匀涂布,并置于37 ℃恒温培养箱中培养24 h,每个盐含量条件下做3个平行,观察细菌生长状况并计数各个盐浓度下培养基上的菌落数,并计算每个盐含量下菌落数的平均值。
1.3.4 蜡样芽孢杆菌的药敏性研究[12]
将活化蜡样芽孢杆菌用无菌竹签蘸取少量菌于2 mL无菌水中,摇匀,然后用移液枪分别移取100 μL稀释液至牛肉膏蛋白胨培养基上,用涂布棒均匀涂布,并用无菌镊子夹取含有抗生素片的药敏片均匀放在平板上,每个平板放置5种药片[13]。再分别置于37 ℃恒温培养箱中培养24 h;观察是否有抑菌圈产生。
1.3.5 菌落计数方法
实验中菌落数的计算参考GB 4789.2—2010《食品微生物学检验菌落总数测定》。
2 结果与分析
2.1 蜡样芽孢杆菌在不同温度条件下生长状况
经过24 h培养之后,蜡样芽孢杆菌ZZ1001在不同温度条件下的生长情况见图1。
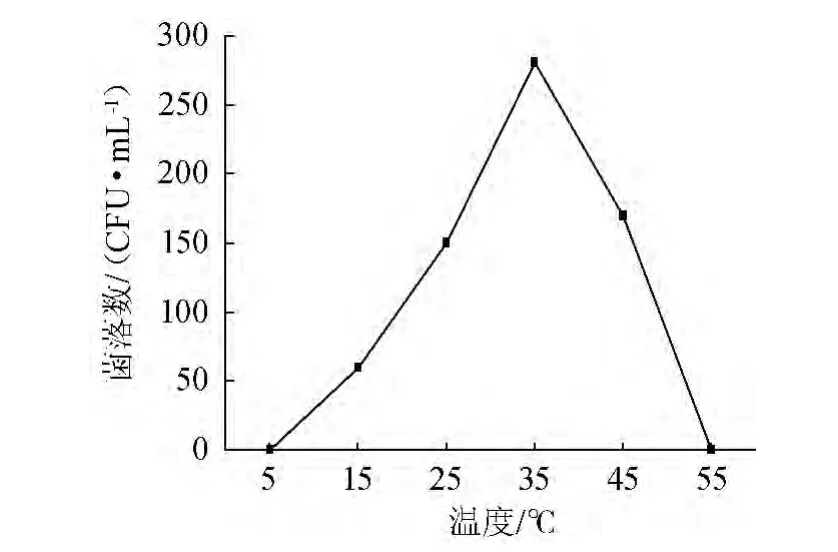
图1 温度对菌株ZZ1001生长的影响Fig.1 Effect of temperature on the growth of strain ZZ1001
由图1可知,菌株ZZ1001在5~35 ℃条件下,随着温度的升高,菌落数增加,在35 ℃时达到最大值,当温度从35 ℃升至55 ℃时,菌落数急剧下降。因此,可认为菌株生长的最适温度是35 ℃左右,当温度<5 ℃或>55 ℃时,菌株不生长。
2.2 蜡样芽孢杆菌在不同pH值条件下生长情况
在37 ℃恒温培养箱中培养24 h后,蜡样芽孢杆菌在不同pH值条件下的生长情况见图2。
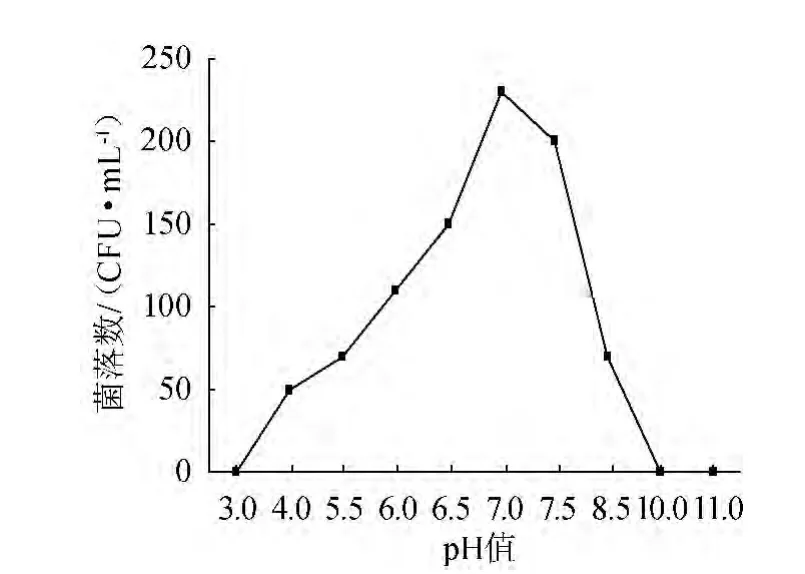
图2 pH值对菌株ZZ1001生长的影响Fig.2 Effect of pH on the growth of strain ZZ1001
由图2可知,菌株ZZ1001在pH值3.0~7.0范围内随着pH值的升高,菌落数逐渐增多,在pH值达到7.0时菌株生长最佳,当pH在7.0~10.0,菌落的生长急剧降低,且在pH>10.0或<3.0时,菌株停止生长,故菌株ZZ1001的最适生长pH值为7.0。
2.3 蜡样芽孢杆菌在不同盐含量条件下生长情况
在37 ℃恒温培养箱中培养24 h之后,蜡样芽孢杆菌在不同盐含量条件下的生长状况见图3。
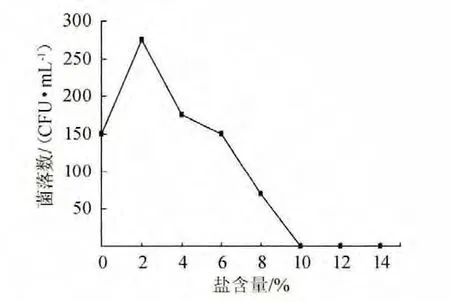
图3 盐含量对菌株ZZ1001生长的影响Fig.3 Effect of salt concentration on the growth of strain ZZ1001
由图3可知,菌株ZZ1001在盐含量2%时菌落数达到最大值,随着盐含量的增大,菌落数逐渐降低,在盐含量为10%时菌株停止生长。故菌株ZZ1001的最适盐含量为2%。
2.4 蜡样芽孢杆菌的药敏性研究结果
在37 ℃恒温培养箱中培养24 h之后,菌株ZZ1001在不同抗生素抗性试验结果见表1。

表1 菌株抗药性实验结果Table 1 Results of strain resistance experiment
从试验结果可得:多粘霉素、林可霉素、氨苄西林、羧苄霉素这几种抗生素对菌株ZZ1001的生长抑制情况非常弱;复方霉素、萘啶酸、四环素、利福平这几种抗生素对菌株ZZ1001的生长具有稍微的抑制情况;庆大霉素、新生霉素、妥布霉素、链霉素、氧氟沙星、头孢西丁、卡那霉素、环丙霉素、青霉素G、呋喃妥因、诺氟沙星、氯霉素、克林霉素这几种抗生素对菌株ZZ1001的生长抑制稍强;奈替米星、头孢噻肟、红霉素、阿奇霉素这几种抗生素对菌株ZZ1001的生长抑制最强。
3 结论
蜡样芽孢杆菌作为食品腐败菌,存在于各种食品中,对人体健康带来了巨大的隐患。从本实验结果可看出,为了更好的防止蜡样芽孢杆菌的滋生,可以通过改变环境温度、pH值及盐含量对其控制。在环境温度<5 ℃或>55 ℃时或pH值>10或<3时蜡样芽孢几乎不生长。在盐含量>5%时不生长,<5%时生长缓慢,而盐含量的高低会影响细胞膜的通透性,高盐环境下由于细胞膜的渗透作用会导致细菌胞内离子的流失,进而导致细胞失水死亡,因此食品在食用前进行加热处理可以很好的杀死蜡样芽孢杆菌[14-16],合理的控制盐浓度也是防止腐败菌生长的一种方法。25种试验抗生素中,有21种对蜡样芽孢杆菌都具有抗性,如红霉素、阿奇霉素等。因此,这对于医药上研制蜡样芽孢杆菌引起的各种疾病的针对药物提供了理论依据[17]。此次实验结果为抑制蜡样芽孢杆菌的生长或杀灭蜡样芽孢杆菌提供了理论依据,也为豆瓣产品品质的控制提供基础。
[1]周帼萍,袁志明.蜡样芽孢杆菌污染及其对食品安全的影响[J].食品科学,2007,28(3):357-361.
[2]SCHOENI J L.Bacillus cereusfood poisoning and its toxins[J].J Food Prot,2005,68(3):636-648.
[3]OZAWA K.Sepsis and meningoencephalitis caused byBacillus cereusin a patient with myelodysplastic syndrome[J].Internal Med,2013,52(17):1987-1990.
[4]白凤翎,马春颖,刘 岩,等.食品中微生物卫生标准相关性研究[J].食品科学,2006,11(5):17-18.
[5]余传萍,王 彬.由蜡样芽孢杆菌引起的食物中毒分析[J].中华现代临床医学杂志,2005,3(11):1121-1124.
[6]杨洁彬.食品微生物学[M].北京:北京农业大学出版社,1995.
[7]陈 顺,孙翠焕,冀宝营.蜡状芽孢杆菌LW9809 发酵条件研究[J].微生物学杂志,2002(5):45-47.
[8]LUCA C,PAOLA D,KALLIOPI R.Biodiversity and dynamics of meat fermentations:The contribution of molecular methods for a better comprehension of a complex ecosystem[J].Meat Sci,2011,89(1):296-302.
[9]CHEN Q,WEI S,DENG Z,et al.Optimization of DNA extraction from seeds of sorghum sudanense(Piper) Stapf[J].Not Bot Hort Agrobot Cluj,2009,37(1):256-260.
[10]MISHRA M K,RAN N S,RAM A S,et al.A simple method of DNA extraction from coffee seeds suitable for PCR analysis[J].Afr J Biotechnol,2008,7(4):409-413.
[11]周家春.食品工艺学[M].北京:化学工艺出版社,2003.
[12]曹伟平,冯书亮,杨更亮,等.抗生素类作为防腐剂对苏云金杆菌芽孢及伴胞晶体的影响[J].微生物学通报,2002,29(6):35-41.
[13]林 毅,陈风义,刘 琳,等.蜡状芽孢杆菌产青霉素酶的研究进展[J].河北工业科技,2008,25(2):125-128.
[14]张艳春,贾钧辉,郑 宇,等.两步控制策略优化生防菌B579 芽孢生成条件[J].安徽农业科学,2011,5(13):23-26.
[15]曾晓希,周洪波,刘飞飞,等.一株胶质芽孢杆菌的筛选和鉴定[J].湖南农业大学学报:自然科学版,2006,32(3):246-247.
[16]宜 齐,王 冬.世界各国的饮用水卫生检测的微生物限量指标[J].检验检疫科学,2004,6(9):135-142.
[17]刘建国,裴 炎,丛 威.蜡状芽孢杆菌S1 发酵条件的研究[J].工业微生物,2001,31(1):24-25.
