酮基还原酶基因工程菌发酵特性的研究
2015-04-12石小丹
张 松,李 啸, *,石小丹,程 奔
(1.三峡大学 生物与制药学院,湖北 宜昌 443003;2.安琪酵母股份有限公司,湖北 宜昌 443003)
手性醇是手性药物合成的重要中间体,例如(R)-(+)-4-氯-3-羟基丁酸乙酯(ethyl(R)-(+)4-chloro-3-hydroxybutanoate,(R)-CHBE)是非常重要的手性中间体[1],它可用于合成阿伐他汀钙系列的药物如L-肉毒碱[2]、大环内酯A和(R)-γ-氨基-β-羟基丁酸[(R)-γ-amino-β-hydroxybutyric acid,GABOB]等[3]。
微生物法催化酮类化合物制备手性醇具有效率高、选择性强、成本低、装置简单、环境污染少等显著优势,受到了人们的广泛关注[4]。微生物来源的酮基还原酶(ketoreduetase,KR)主要为醛酮还原酶系[5],属于短链醇脱氢酶家族(shortchain alcohol dehydrogenase,SDR)。重组大肠杆菌酮基还原酶一般为还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)依赖型,当KR 与NADPH 结合时,KR空间结构发生改变,执行由NADPH提供的、Tyr151 羟基介导的质子转移,完成酮类化合物的还原[6]。目前的研究主要集中于酮基还原酶的基因改造、辅酶再生以及生物催化过程优化[4],而对于酮基还原酶发酵调控方面的报道较少。
大肠杆菌高密度发酵是现代发酵领域逐渐兴起的一项新技术,基因重组改造过的工程菌只有经过进一步的高密度发酵优化,才能应用于实际的工业生产[7]。当前有关酮基还原酶发酵方面的研究仍然停留在摇瓶发酵水平,要想酮基还原酶真正能用于工业发酵,中试水平的酮基还原酶高密度发酵产酶研究无疑具有重要意义。课题主要对重组大肠杆菌发酵生产酮基还原酶的发酵特性进行了研究,以确定重组菌株菌体生长状况、发酵液重要参数指标、菌体产酶情况以及质粒的稳定性。为了进一步考察发酵特性曲线和质粒稳定性,采用流加氨苄的策略进行了补料分批发酵,并进行了多参数相关分析和前后两罐对比分析。实验为后续发酵过程优化以及生产放大奠定了一定的基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
重组大肠杆菌(Escherichia coli)KR-C:安琪酵母股份有限公司菌种室。
1.1.2 试剂
L-阿拉伯糖:美国Sigma 公司;酵母蛋白胨(FP101)、酵母抽提物(FM888):安琪酵母股份有限公司;氨苄西林钠(注射用):中诺药业(石家庄)有限公司。其他试剂均为国产分析纯。
1.1.3 培养基
斜面培养基:酵母蛋白胨(FP101)10 g/L,NaCl 10 g/L,酵母抽提物(FM888)5 g/L,琼脂粉15 g/L。
种子摇瓶液体培养基:甘油10 g/L,酵母抽提物13.5g/L,酵母蛋白胨31.5 g/L,KH2PO42.31 g/L,K2HPO412.54 g/L,MgSO40.5 g/L。
50 L发酵罐液体培养基:甘油20 g/L,酵母抽提物13.5 g/L,酵母蛋白胨31.5 g/L,KH2PO42.31 g/L,K2HPO412.54 g/L,MgSO40.5 g/L。
1.1.4 补料溶液
L-阿拉伯糖:质量浓度0.1 g/mL;氨苄西林钠:质量浓度0.1 g/mL。
1.2 仪器与设备
ZHWY-211D脚踏开门型大容量全温度恒温摇床:上海智城生物科技有限公司;FUS-50L(A)型新概念发酵罐:上海国强生化工程装备有限公司;PAS7000型生物尾气分析仪:重庆哈特曼科技有限公司;TDL-60B型飞鸽牌系列离心机:上海安亭科学仪器厂制造;SP-754型紫外可见光分光光度计:上海天普分析仪器有限公司;04711-45型超声波破碎仪:宁波新芝生物科技股份有限公司;SPX-150生化培养箱:北京科伟永兴仪器有限公司。
1.3 方法
1.3.1 发酵培养方法
一级种子培养:将斜面菌样接入装料量为25 mL液体培养基的250 mL三角瓶中,制备2瓶,于30 ℃、180 r/min摇床培养12 h。
二级种子培养:将6 mL一级种子液接入装料量为600 mL液体培养基的5 L三角瓶中,于30 ℃、180 r/min摇床培养12 h。
分批发酵培养:发酵罐灭菌前加入15 mL消泡油,调节pH值为7,灭菌后将600 mL二级种子液接入装有30 L液体培养基的50 L发酵罐中,于30 ℃、200~480 r/min(溶氧转速联动)、0.035 MPa条件下发酵培养,当菌体量OD600nm值为2时,一次性加入配制好的0.1 g/mL的L-阿拉伯糖溶液300 mL。
氨苄流加培养:其他培养条件及诱导条件同分批发酵培养,在加入诱导剂的同时,一次性加入100 mg/L的氨苄30 mL。
1.3.2 测定指标
罐上在线数据:pH、温度、搅拌转速、耗氧速率(oxygen consumption rate,OUR)、二氧化碳释放速率(carbon-dioxide evolution rate,CER)、呼吸商(respiratory quotient,RQ)、溶解氧(dissolved oxygen,DO)等。
发酵过程中每2 h测一次OD600nm、氨基酸态氮和乙酸含量,每4 h测一次酮基还原酶酶活。活菌数和质粒稳定性的取样点由细胞生长周期数据需求进行选择。菌体量测定:发酵液用蒸馏水稀释适当的倍数,振荡混合摇匀后,用紫外可见光分光光度计测定波长600 nm处的光密度值(OD600nm)。采用国际酶学委员会规定的定义酶活:40 ℃,pH值为6.0条件下,每分钟消耗1 μmol NADPH所需要的酶量为1个酶活单位(U/L)。活菌数测定:采用稀释涂布平板法,将发酵液进行适当的梯度稀释,分别涂布到琼脂平板表面,37 ℃培养24 h后检查平板上菌落形成单位(colony forming unit,CFU)数量。酮基还原酶酶活测定方法见参考文献[8]。发酵液氨基酸态氮测定:甲醛滴定法,见参照文献[9]。发酵液乙酸含量测定:测定方法见参考文献[10]。质粒稳定性测定:平行平板法,见参照文献[11]。
2 结果与分析
2.1 重组大肠杆菌KR-C在50 L发酵罐中生长规律研究
2.1.1 发酵过程中在线测定参数的变化
探索了50 L发酵罐的重组大肠杆菌KR-C的生长规律,发酵过程的在线参数检测结果见图1。
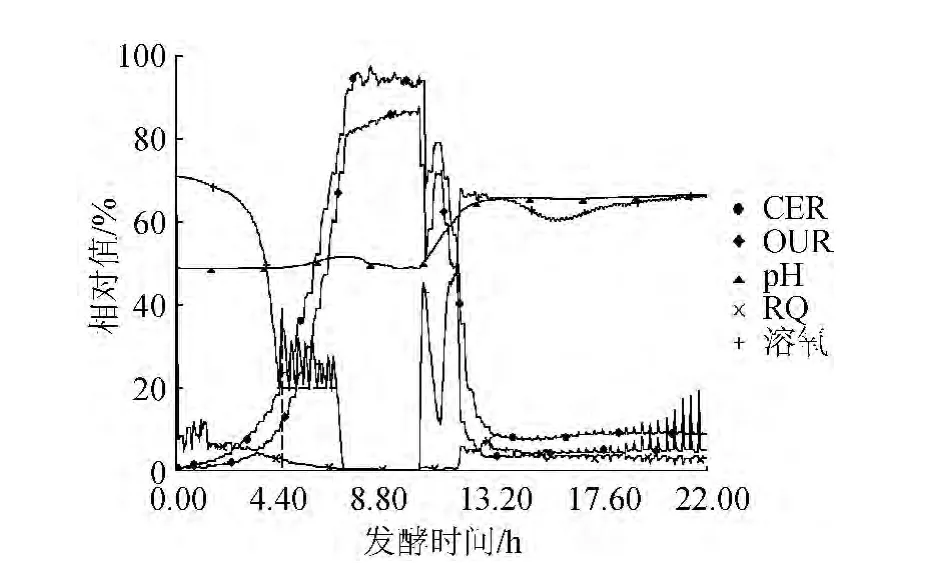
图1 发酵过程在线参数的变化趋势Fig.1 Trends of real-time parameters in the fermentation process
由图1CER与OUR曲线分析可知,菌体在0~4 h呼吸强度较弱,4~8 h呼吸强度呈指数增长,8~10 h CER与OUR达到最大值后趋于稳定,10~12 h呼吸强度经过急剧下降后出现了二次增长现象,此时溶氧也出现了短暂的回落,13 h后呼吸强度又一次急剧下降后一直处于较低的水平;从pH 曲线分析可知,发酵液的pH值在前6 h几乎稳定不变,6~10 h后pH值逐渐下降,10~12 h pH值回升达到最大,12 h后pH值几乎保持恒定。
2.1.2 发酵过程中氨基酸态氮、乙酸及酶活的变化
发酵过程中氨基酸态氮、乙酸及酶活的变化结果见图2。
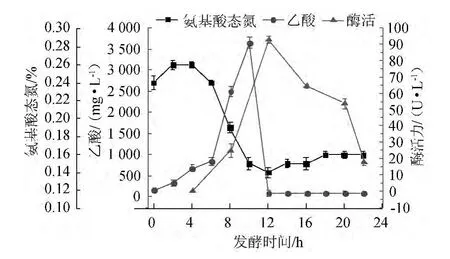
图2 发酵液中氨基酸态氮、乙酸及酶活随发酵时间的变化趋势Fig.2 Changing trends of amino acid nitrogen,acetic acid concentration and enzyme activity of fermentation broth with time
由图2可知,发酵液中氨基酸态氮含量在前4 h变化并不明显,4~12 h 急剧下降,12~18 h缓慢上升后达到最低并趋于稳定;乙酸在前6 h增长缓慢,6~10 h快速上升,10~12 h又迅速下降,12 h后趋于稳定;酮基还原酶的酶活在12 h达到最大,12 h后酶活迅速下降。
2.1.3 发酵过程中OD600nm、活菌数及质粒稳定性的变化
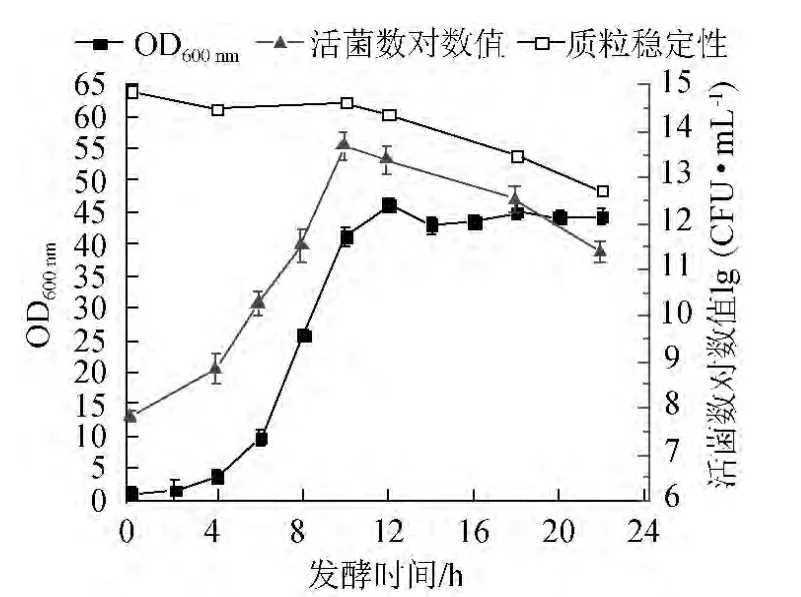
图3 发酵过程中重组大肠杆菌菌体的累积量(OD600nm)、活菌数以及质粒稳定性随时间的变化趋势Fig.3 Changing trends of the cumulative amount of the recombinant Escherichia coli (OD600nm),viable cells number and plasmid stability with time during fermentation
由图3可知,重组大肠杆菌菌体的累积量(OD600nm)在0~4 h增长缓慢,4~12 h 呈指数增长,12 h后趋于稳定;而活菌数在前10 h的变化趋势与OD600nm相似,在10 h达到最大值,但10~20 h期间发酵液中的活菌数逐渐下降,20 h活菌数下降速度加快;带质粒的重组大肠杆菌在前10 h几乎达到100%,10~20 h期间质粒稳定逐渐降低,20 h后,质粒丢失速度加快,发酵结束后,带质粒的菌体仅占所有菌体的83%。
2.1.4 质粒稳定性
发酵22 h后质粒稳定性检测结果见图4。

图4 发酵22 h后质粒稳定性检测结果Fig.4 Determination results of plasmid stability after fermentation for 22 h
由图4可知,在平皿上编号为2、17、20、24、31、33、48、50、57、66、84、88、86、91、95、96、97这17个区域内加有氨苄的A平板里面没有出现菌落,而没有加氨苄的B平板里面长了菌落,由此证实大约有17%的活菌的质粒在此时已经丢失了。
2.1.5 重组大肠杆菌KR-C在发酵过程的变化
重组大肠杆菌KR-C在发酵过程的生长规律如下:
(1)在发酵前期(0~4 h)为延滞期,此期间为菌体的适应期,表现为菌体生长速度较慢,总呼吸强度弱,碳源与氮源消耗速率低,pH值几乎不变化,乙酸积累量不高;
(2)4~8 h为对数增长期,菌体适应新环境后,活菌数、菌体累积量开始急剧增长,导致摄氧率以及呼出CO2增多,与此同时碳源被大量消耗,代谢副产物乙酸逐渐积累,pH逐渐降低,此过程菌体的累积为后续酮基还原酶的大量表达奠定了基础;
(3)8~10 h为稳定期,图1中CER与OUR曲线分析可知此阶段菌体的总呼吸强度几乎不变,值得注意的是,此阶段(图3)菌体的累积量、活菌数仍不断升高。可能是前期菌体的大量累积导致菌体生长环境中的能源以及溶氧的过度消耗,致使部分菌体提前进入呼吸衰弱期,而新增长的菌体弥补了这部分呼吸强度值,但是在检测OD600nm值时并不能表现出来。8 h的活菌数明显低10 h,可能原因是对数生长期的细胞容易形成细胞链[12],普通摇匀振荡很难有效分散成单个细胞,使得平板活菌计数中很多菌落由多细胞群体形成,从而导致测量的活菌数低于实际值。
(4)10~12 h为二次增长期,CER与OUR经过短暂的急剧下降后出现了二次增长现象,与此同时,乙酸的积累量从急剧下降,pH值回升,说明乙酸作为碳源再次被消耗导致了二次增长现象。这阶段虽然OD600nm值虽然有缓慢的增长趋势,但是活菌数开始下降。同样,此阶段为产酶积累期,酶活在12 h达到最高,说明该酶的表达与菌体量的增长部分关联,酶的大量积累需要一定数量的菌体累积作为前提。
(5)12 h后为衰亡期,由图3可知,活菌数逐渐下降,进入衰亡期的菌体增多。在发酵结束时,虽然活菌数比对数初期(4 h)高,但呼吸强度却远低于对数初期,说明此时大部分菌体处于死亡或者濒临死亡状态。在此阶段酶活逐渐降低,到发酵20 h后酶活仅为17.78 U/mL。原因可能是,一方面质粒稳定性逐渐下降,说明在发酵后期,即使菌体仍然存在活性,但是质粒逐渐丢失,因此产能降低;另一方面发酵营养条件的缺乏和有害代谢物的积累,可能激发细胞产生了比较剧烈的热激反应,由此产生的热激蛋白会增强胞内蛋白水解酶的活力[13]。
2.2 菌体生长与产酶的关联性研究
重组大肠杆菌培养过程中通常采用增加“选择压力”来提高重组大肠杆菌质粒的稳定性。史悦等[14]发现质粒PETNHM在无抗生素选择压力下,连续传代48代后质粒开始丢失,进一步研究表明,卡拉霉素的选择压力下能够保证质粒的稳定遗传。发酵过程中质粒的丢失可能会使重组大肠杆菌不再是优势菌,取而代之的是不带质粒的普通大肠杆菌。从前期实验可知,在发酵过程中重组大肠杆菌的质粒在4 h开始丢失,因此本实验设计为对照组罐1:不流加氨苄;实验组罐2当发酵4 h时,向发酵罐中流加氨苄溶液,并使发酵液中氨苄的终质量浓度为100 mg/L。发酵过程中,定时取样检测比生长速率、OD600nm、活菌数、氨基酸态氮、乙酸、酶活以及质粒稳定性。实验结果见图5。
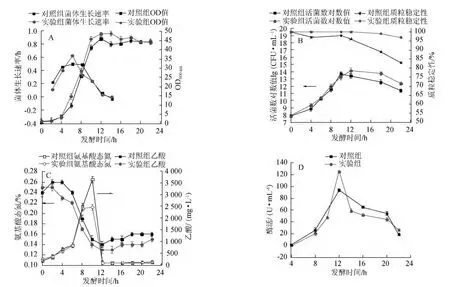
图5 两组实验检测比生长速率及OD600nm(A)、活菌数及质粒稳定性(B)、氨基酸态氮及乙酸含量(C)、酶活(D)结果对比Fig.5 Comparison results of specific growth rate and OD600nm(A),viable count and plasmid stablity (B),amino nitrogen and acetic acid contents (C) and enzyme activity (D) of the two experiments
由图5A可知,从OD曲线看虽然实验组的菌体最大累积量略大于对照组,但是除2~6 h时间段外大部分时间段内实验组比生长速率低于对照组;由图5B可知,实验组活细菌数到达最大值的时间为12 h,而对照组为10 h,虽然实验组在10 h活菌数比对照组稍低,但在10~12 h后赶超。实验组在发酵结束后仍有97%的菌体带有质粒;由图5C可知,实验组中氨基酸态氮的利用比对照组多,而在最大乙酸积累时期,实验组积累的乙酸低于对照组;由图5D可知,实验组最大酶活(125.9 U/mL)高于对照组(92.2 U/mL),两者出现的最高点均为12 h,从酶活曲线来看,酶活大量表达的时期为10~12 h。
结合上述现象可知,加入氨苄会使带有质粒的菌成为优势菌,这对于酮基还原酶的表达有一定的影响。首先,实验组的比生长速率低于对照组,说明带有质粒的菌体传代速率慢,而不带质粒的菌体传代速率快,表明质粒增加了菌体的代谢负荷。其次,在10~12 h内实验组活菌数高于对照组,相应时间段发酵液中的代谢产物酮基还原酶的酶活也高于对照组,由此可说明外源蛋白的表达量依赖于带有质粒的活菌的数量,带有质粒的活菌数越高,酶活越高。另外,8~10 h,实验组积累的乙酸以及比生长速率低于对照组,由于乙酸的积累不仅会限制菌体的生长[15],而且会抑制产物的合成[16],而减小对数生长期的比生长速率可以减少乙酸的积累[17],带有质粒的菌体传代速度较小,降低了比生长速率,同时也减少了乙酸的积累,进而使酮基还原酶的表达量增加。
与摇瓶实验相比,在50 L发酵罐中,菌体最大累积量远大于摇瓶,但酶活的表达量(无论有无添加氨苄)并没有达到理想的水平。可能由于摇瓶发酵条件的控制与罐上发酵条件存在着巨大差异,使得放大过程中存在“放大效应”[18]。此外,KR在大肠杆菌中的可溶性差[19],发酵过程极易产生包涵体,包涵体形式的KR需要变性复性的过程才能显示活性,因此也可能因为发酵罐中KR基因的表达过快而导致蛋白没有正确的折叠而产生包涵体,使酶活低于摇瓶发酵的产量。
3 结论
结果表明,重组大肠杆菌KR-C在50 L发酵罐中生长过程分为4个阶段:延滞期(0~4 h),为菌体的适应期;对数生长期(4~8 h),为菌体量积累期;稳定期(8~10 h),为酶的表达前期,乙酸积累期,二次增长期(10~12 h),为酶大量积累期,乙酸消耗期;衰亡期(12 h 后),为菌体衰亡,酶被降解期。
另外,重组大肠杆菌KR-C发酵中的一些问题也值得关注:(1)碳源的缺乏是发酵中期导致菌体提前进入衰亡期的关键因素,也是导致酮基还原酶表达时间缩短的关键因素;(2)酮基还原酶的大量表达要以大量的活菌数和生长环境中较低的乙酸含量为基础;(3)对数生长期的比生长速率对酮基还原酶表达有很大的影响,将比生长速率控制在0.3 h-1以下有利于酶活的提高;(4)在发酵后期,营养物缺乏可能导致胞内蛋白酶被激活,致使酶活迅速降低。
通过对重组大肠杆菌KR-C在50 L发酵罐中生产酮基还原酶的特性研究,摸索了其发酵的基本规律,为以后进一步放大生产研究奠定了基础,同时也为酮基还原酶的后续研究指明了方向。
[1]OPPERMANN U,FILLING C,HULT M,et al.Short-chain dehydrogenases/reductases(SDR):the 2002 update[J].Chem Biol Interact,2003,143-144:247-253.
[2]SONG C E,LEE J K,LEE S H,et al.New Method for the Preparation of R-Carnitine[M].Tetrahedron:Asymmetry,1995.
[3]陶 源,胡又佳,周 斌,等.他汀类药物中间体(S)-4-氯-3-羟基丁酸乙酯生物催化合成的研究进展[J].世界临床药物,2013,34(6):359-363.
[4]郁惠蕾,黄 磊,倪 燕,等.羰基生物还原法合成手性醇的研究进展[J].生物加工过程,2013,11(3):71-82.
[5]WHITE S W,ZHENG J,ZHANG Y M,et al.The structural biology of type II fatty acid biosynthesis[J].Annu Rev Biochem,2005,74:791-831.
[6]CAMPBELL J W,CRONAN J E JR.Bacterial fatty acid biosynthesis:targets for antibacterial drug discovery[J].Annu Rev Microbiol,2001,55:305-332.
[7]陈 理,俞昌喜.重组大肠杆菌高密度发酵工艺进展[J].海峡药学,2011,23(3):15-18.
[8]石小丹,李 啸,罗宇笛,等.发酵液中酮基还原酶活性测定方法的构建[J].中国酿造,2014,33(9):151-155.
[9]卜凤泉,刘忠英,胡秀丽,等.测定磷脂中氨基氮的新方法[J].食品科技,2003(5):87-88.
[10]张惟材,邓兵兵,彭清忠,等.气相色谱法测定工程菌发酵液中的乙酸[J].生物技术通讯,2000,11(3):196-198.
[11]WARNES A,STEPHENSON J R,FOOKS A R,et al.Expression of recombinant protein A from the lac promoter inEscherichia coliJM83 is not subject to catabolite repression when grown under specific conditions of continuous culture[J].Biotechnol Bioeng,1991,38(9):1050-1058.
[12]WANG H,CHENG H,WEI D,et al.Comparison of methods for measuring viableE.colicells during cultivation:great differences in the early and late exponential growth phases[J].J Microbiol Methods,2011,84(1):140-143.
[13]HOFFMANN F,RINAS U.On-line estimation of the metabolic burden resulting from the synthesis of plasmid-encoded and heat-shock proteins by monitoring respiratory energy generation[J].Biotechnol Bioeng,2001,76(4):333-340.
[14]史 悦,于慧敏,田卓玲,等.产腈水合酶重组大肠杆菌的质粒稳定性研究[J].中国生物工程杂志,2005,25(8):70-75.
[15]VEIT A,POLEN T,WENDISCH V.Global gene expression analysis of glucose overflow metabolism inEscherichia coliand reduction of aerobic acetate formation[J].Appl Microbiol Biotechnol,2007,74(2):406-421.
[16]LEE S Y.High cell-density culture ofEscherichia coli[J].Trends Biotechnol,1996,14(3):98-105.
[17]胡 云,王天文,堵国成,等.利用三阶段葡萄糖添加策略减少乙酸合成并促进重组大肠杆菌生产L-苯丙氨酸[J].工业微生物,2013,43(1):6-10.
[18]张嗣良.工业生物过程优化与放大研究中的科学问题——生物过程环境组学与多尺度方法原理研究[J].中国基础科学,2009,11(5):27-31.
[19]KALIAPERUMAL T,KUMAR S,GUMMADI S N,et al.Asymmetric synthesis of(S)-ethyl-4-chloro-3-hydroxybutanoate usingCandida parapsilosisATCC 7330[J].J Ind Microbiol Biotechnol,2010,37(2):159-165.
