发酵型茯苓葡萄酒的研制及品质评价
2015-04-12崔培梧谭朝阳
崔培梧,曹 婧,米 洁,陈 林,廖 彦,谭朝阳*
(1.湖南中医药大学 药学院,湖南 长沙 410208;2.垫江县中医院,重庆 408300;3.西安交通大学 药学院,陕西 西安 710049)
茯苓(Poria cocos)是重要的药食同源菌物,其味甘性平,归心、肺、脾、肾经,具有利水渗湿、健脾宁心之功效,在临床中药配伍及中成药生产领域应用非常广泛[1-2];同时相关研究已证明茯苓主要活性成分为多糖和三萜类化合物,且二者均具有显著的抗炎、免疫调节、抗肿瘤、抗氧化、保肝、降低移植手术后受体排斥反应等功能[3-5],因此茯苓保健品的研发备受关注,目前已有茯苓多糖口服液、茯苓饼干、茯苓面膜等问世。果酒是指以新鲜水果为原料,在保存水果原有营养成分的前提下通过酵母分解糖分而酿造出的具有保护心肌、软化血管、美容、促进消化等多重保健功效的营养酒饮,其中以葡萄酒最为著名[6]。因此,如能结合传统葡萄酒酿造工艺,研制具有特殊保健功能的发酵型茯苓葡萄酒,不失为茯苓保健品的一种新形式,虽然王谦等[7]也对茯苓发酵酒的酿造工艺,同时通过工艺优化获得色泽金黄、酒香纯正的茯苓发酵酒,但由于在酿酒原料中仅补充蔗糖,自然也就丧失了葡萄酒特有的风味和口感,而葡萄酒酿造过程中抑菌、防氧化等特殊处理措施又非常关键,故探索发酵型茯苓葡萄酒的酿造工艺仍非常必要。
因此本研究拟结合传统葡萄酒酿造工艺,首先以酒精度为评价指标,采用被广泛应用于发酵过程优化[8]和工艺设计[9]等过程中的Box-Behnken设计对影响发酵型茯苓葡萄酒酿造质量的初始糖度、接种量、发酵温度、偏重亚硫酸钾添加量4个参数进行优化,拟探讨在发酵体系中添加茯苓发酵液的发酵型葡萄酒酿制工艺,并对所得茯苓葡萄酒的感官品质及理化、卫生指标进行了检测,以期开发既具有多重保健功效、又不失口感、营养的新型茯苓葡萄酒。
1 材料与方法
1.1 材料与试剂
茯苓菌(Poria cocos)JZ由湖南靖州茯苓栽培基地提供并保藏于湖南中医药大学生物工程实验室。葡萄:当地超市,要求新鲜、籽粒饱满、无霉变、浆果。葡萄酒/果酒专用酵母菌:安琪酵母股份有限公司;熊果酸(纯度≥98%):中国药品生物制品检定所;葡萄糖、蔗糖、偏重亚硫酸钾、壳聚糖等均为国产分析纯。
1.2 仪器与设备
泰斯特MJX-250BX型培养箱:广州沪瑞明仪器有限公司;SKY-211D型恒温空气浴摇床、BLBIO-10SJ型生物反应器:上海保兴生物设备工程有限公司;520型板框压滤机:沧州亚龙压滤机有限公司;UV-1800型紫外-可见分光光度计:日本岛津公司;PHB-4型便携式pH酸度计:上海雷磁仪器厂;BK-8480酒精计:北京柏莱斯特科技发展有限公司;ATAGO PAL-α数字糖度计:日本爱宕公司。
1.3 方法
1.3.1 茯苓发酵液的制备
茯苓发酵培养基:葡萄糖40 g、蛋白胨7.5 g、硝酸钾7.5 g、维生素B10.005 g,水1 000 mL,初始pH值5.5,配好后于121 ℃灭菌20 min。
茯苓菌种的制备:取保藏的茯苓菌种,转接至马铃薯葡萄糖琼脂(potato dextrose agar,PDA)平板在28 ℃下培养5 d,然后转接至装有100 mL发酵培养基的250 mL摇瓶中,于28 ℃、160 r/min振荡培养5 d,作为二级菌种。
茯苓菌的放大培养:在10 L反应器中装入7.2 L发酵培养基,于121 ℃灭菌20 min后,接种10%(V/V)的二级种子,于28 ℃、300 r/min振荡培养3 d,收集发酵液,板框压滤得茯苓发酵液,经115 ℃条件下灭菌15 min,冷却、备用。
1.3.2 茯苓葡萄酒的制备
酵母菌的活化:在35~40 ℃含2%蔗糖的温水中加入10%(W/V)安琪葡萄酒活性干酵母粉,混匀,静置使之复水、活化,每隔10 min轻轻搅拌一次,共活化20~30 min。
茯苓葡萄酒的酿造工艺流程:
葡萄→筛选、洗涤、自然晾干→组织破碎→与茯苓发酵液以1 000 g/L进行混合,装入发酵缸(添加适量的蔗糖、偏重亚硫酸钾、酵母菌种)→主发酵(温度设置参考实验设计,7 d)→皮渣分离,酒液转至发酵缸→后发酵(20 ℃、20 d)→添加0.02%(V/V)10 g/L壳聚糖溶液→混匀、静置澄清(15 ℃、48 h)→巴氏消毒(85 ℃、15 min)→茯苓葡萄酒
1.3.3 茯苓葡萄酒酿造工艺条件的确定
在固定好其他条件不变的前提下,以茯苓葡萄酒酒精度为评价指标,分别考察不同初始糖度(150 g/L、175 g/L、200 g/L、225 g/L、250 g/L)、接种量(1%、2%、3%、4%、5%)、主发酵温度(20.0 ℃、22.5 ℃、25.0 ℃、27.5 ℃、30.0 ℃)、偏重亚硫酸钾添加量(0、50 mg/L、100 mg/L、150 mg/L、200 mg/L)对最终茯苓葡萄酒酒精度的影响,进而采用Box-Behnken设计对该4个因素的综合影响效应进行优化,以确定最佳茯苓葡萄酒发酵工艺,并对所得茯苓葡萄酒的品质进行综合评价。
1.3.4 理化指标和微生物指标的测定
糖度、酸度和酒精度的测定分别参照国标GB/T 15038—2006《葡萄酒、果酒通用分析方法》中的方法测定;多糖的测定采用硫酸-苯酚法[10];三萜的测定采用香草醛-高氯酸比色法[11];微生物指标的测定参考国标GB 4789.1—2010《食品安全国家标准食品微生物学检验总则》中的方法检测细菌总数、大肠菌群、致病菌。
2 结果与分析
2.1 初始糖度对茯苓葡萄酒发酵的影响
可发酵糖为酵母合成乙醇的重要底物,初始糖含量的高低直接影响着乙醇的产率,进而影响到成品酒的品质和口感。初始糖唐对茯苓葡萄酒发酵的影响结果如图1所示。

图1 初始糖度对茯苓葡萄酒发酵的影响Fig.1 Effect of initial sugar content on Poria cocos wine fermentation
由图1可知,初始糖度对茯苓葡萄酒的pH影响较小,pH值基本维持在3.39~3.80,在初始糖度为225 g/L时,酒精度达到最高,为11.9%vol,残糖含量为51 g/L,也有明显增加,推理其原因可能是因为酒精度的增加对酵母菌的糖酵解产生了一定的抑制作用,所以在初始糖度提高到250 g/L时茯苓葡萄酒的酒精度并没有继续增加,反而造成了残糖含量的升高,因此选择225 g/L作为最佳初始糖度。
2.2 酵母接种量对茯苓葡萄酒发酵的影响
果酒发酵过程中酵母的代谢分为细胞生长和乙醇积累两个阶段,其中接种量是影响着酵母细胞生长周期长短的关键因素,代谢周期过长会增加杂菌污染的概率,而接种量过大又会造成发酵糖的过度消耗,进而影响乙醇产率。酵母接种量对茯苓葡萄酒发酵的影响结果如图2所示。
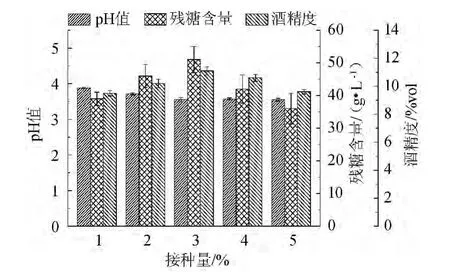
图2 酵母接种量对茯苓葡萄酒发酵的影响Fig.2 Effect of inoculum on Poria cocos wine fermentation
由图2可知,酵母接种量为3%时茯苓葡萄酒酒精度和残糖含量最大,此时酒精度为11.1%vol,残糖含量为51 g/L,酒液pH值为3.55,酵母接种量过高或过低均会引起酒精度和残糖含量的下降,说明接种量过低使得酵母细胞生长周期延长,相应的细胞维持代谢消耗糖量增加,而过高的接种量又会增加了细胞进行有氧代谢的底物消耗,因此选择3%作为最佳酵母接种量。
2.3 主发酵温度对茯苓葡萄酒发酵的影响
果酒酿造过程中,温度控制对酵母活性、酚类物质浸出、挥发性香气物质的形成及保留具有重要影响,发酵温度过低会影响细胞代谢速率,而过高的温度又会使得细胞致死,增加高级醇、挥发酸等不良风味物质的形成[12-13],主发酵温度对茯苓葡萄酒发酵的影响结果如图3所示。

图3 主发酵温度对茯苓葡萄酒发酵的影响Fig.3 Effect of main fermentation temperature on Poria cocos wine fermentation
由图3可知,当主发酵温度为27.5 ℃时,酒精度最高,为11.8%vol,残糖含量相对较低,为49 g/L,pH值为3.59,过低或过高的温度控制均会对酵母细胞的糖酵解代谢产生抑制作用,其原因可能是因为发酵过程中传热的滞后效应使得细胞的代谢热不能及时排除,进而产生毒性,同时低温又限制了代谢速率,因此选择27.5 ℃作为最佳主发酵温度。
2.4 偏重亚硫酸钾添加量对茯苓葡萄酒发酵的影响
果酒最主要的特色在于其风味和营养价值,生产过程添加二氧化硫可抑制不良微生物的生长,同时促进果酒的澄清、抗氧化、增酸、增溶等效果[14-15],通常以亚硫酸和亚硫酸盐的形式添加在主发酵前一次性添加,以实现二氧化硫的缓慢释放。因此,分别考察了0、50 mg/L、100 mg/L、150 mg/L、200 mg/L偏重亚硫酸钾对茯苓葡萄酒发酵的影响,结果如图4所示。
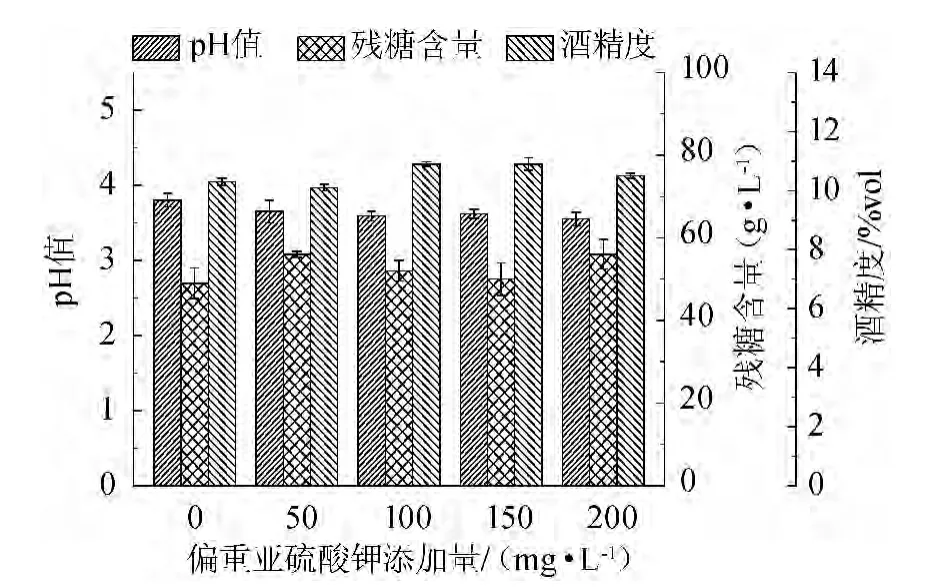
图4 偏重亚硫酸钾添加量对茯苓葡萄酒发酵的影响Fig.4 Effect of potassium metabisulphate addition on Poria cocos wine fermentation
由图4可知,当偏重亚硫酸钾添加量为100 mg/L时,茯苓葡萄酒酒精度达到最高,为10.9%vol,可以达到较好的发酵效果,此时残糖含量为52 g/L,pH值为3.59。偏重亚硫酸钾添加量继续增加并不会引起酒精度等指标的显著变化,但却引起二氧化硫残留的增加,而较低偏重亚硫酸钾添加量会增加发酵体系的染菌风险,同时与空白组相比,偏重亚硫酸钾对于酵母细胞乙醇的合成过程也有一定的调控作用,因此选择100 mg/L作为偏重亚硫酸钾的最佳添加量。
2.5 Box-Behnken设计优化茯苓葡萄酒的发酵条件
根据单因素试验结果,采用Box-Behnken中心组合试验设计,以成品茯苓葡萄酒酒精度(Y)为响应值,选取初始糖度(X1)、酵母接种量(X2)、主发酵温度(X3)、偏重亚硫酸钾添加量(X4)作为自变量,Box-Behnken试验设计及结果见表1。
采用Design Expert 8.05软件对表1数据进行分析,建立多元二次回归方程如下:
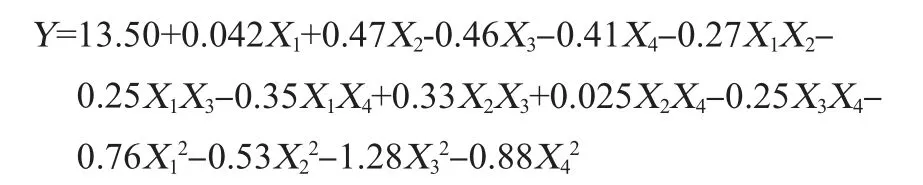
为验证该模型的可信度,对所得模型进行方差分析,结果如表2所示。
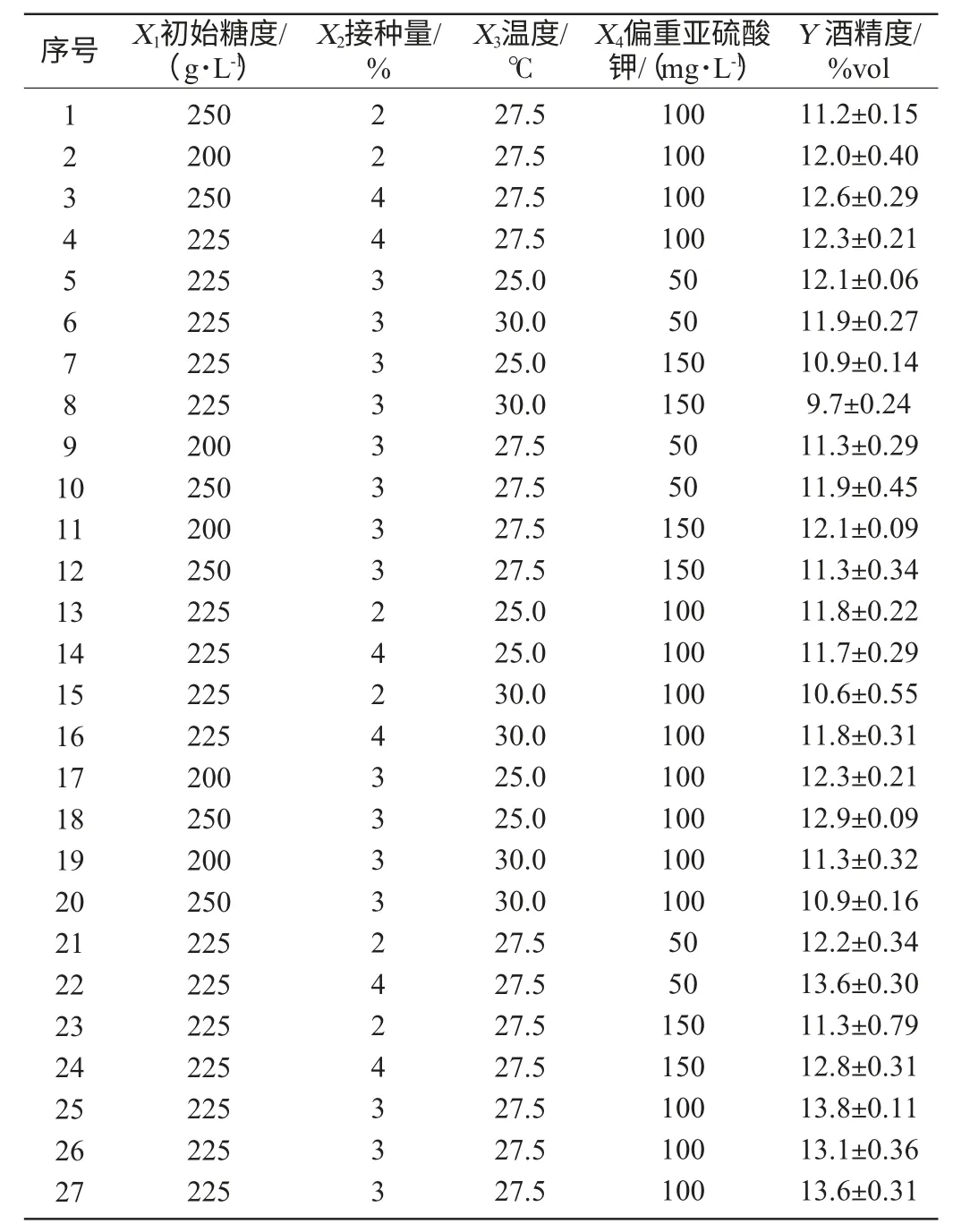
表1 Box-Benhnken试验设计及结果Table 1 Design and results of Box-Behnken experiment
由表2方差分析可知,模型P<0.05,该回归模型达到显著水平。模型中的X2、X3、X4、X12、X22、X32、X42对响应变量的影响均具有显著性,而X1、X1X2、X1X3、X1X4、X2X3、X2X4、X3X4不显著,这表明试验因素对响应值不是简单的线性关系。同时交互项均不显著说明任意两因素间不存在交互作用,模型失拟项不显著,说明模型拟合度良好,此模型可以用来对茯苓葡萄酒的发酵效果进行分析和预测。为进一步直观分析响应面优化效果,根据回归模型绘制相应的响应曲面图见图5。
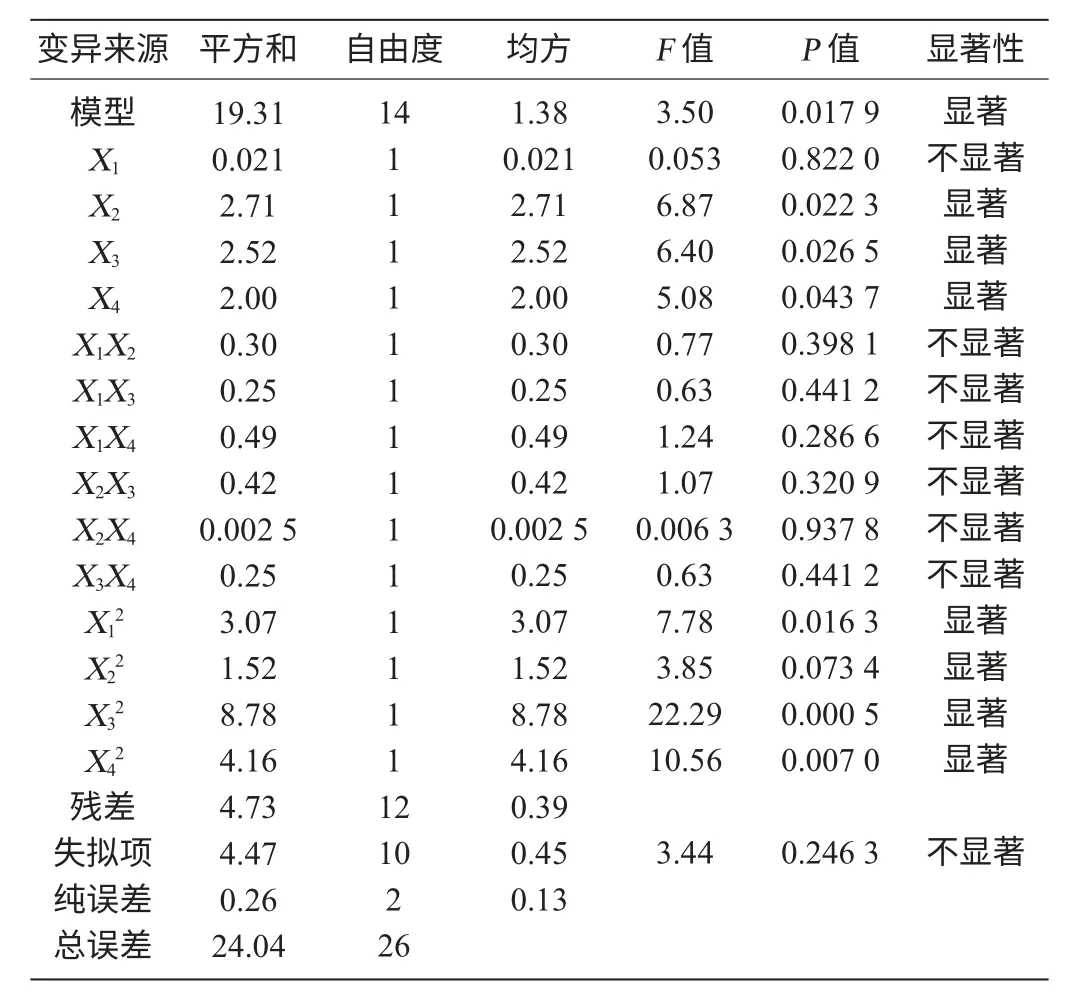
表2 回归模型方差分析Table 2 Variance analysis of regression model

图5 初始糖度、接种量、发酵温度和偏重亚硫酸钾添加量交互作用对茯苓葡萄酒发酵影响的响应面和等高线Fig.5 Response surface plots and contour line of interaction of effects of initial sugar content,inoculum,main fermentation temperature,and potassium metabisulphate on Poria cocos wine fermentation
由图5可知,对于任意两个因素,响应变量均存在极大值。结合所见二次模型,对该极大值进行求解,得出最优变量组合为初始糖度225.56 g/L、酵母接种量3.4%、主发酵温度27.23 ℃、偏重亚硫酸钾添加量89.26 mg/L,此时茯苓葡萄酒理论酒精度为13.67%vol。
为验证所建模型预测数据的准确性,依据最优变量组合进行了验证试验,结果显示酒精度为(13.72±0.29)%vol,实际值与理论值偏离<5%,说明所建模型有效。故茯苓葡萄酒主发酵的最优条件为:初始糖度225.56 g/L、酵母接种量3.4%、主发酵温度27.23℃、偏重亚硫酸钾添加量89.26 mg/L。
2.6 发酵型茯苓葡萄酒品质分析
在最佳工艺条件下制作发酵型茯苓葡萄酒,并对其进行品质评价。
感官指标:茯苓葡萄酒呈现红褐色或枣红色泽,富含葡萄及茯苓发酵液特殊香味,口味纯正,酸甜可口,酒体澄清透明、无悬浮物、无沉淀。
理化指标:酒精度为13.72%vol,pH值为3.52,残糖含量为52.1g/L,茯苓多糖含量为6.2g/L,茯苓三萜含量0.44g/L。
微生物指标:细菌总数≤50 个/mL、大肠杆菌总数≤3 MPN/100 mL、致病菌未检出,符合国标GB 2758—2012《食品安全国家标准发酵酒及其配制酒》。
3 结论
采用单因素试验设计分析了初始糖度、酵母接种量、主发酵温度、偏重亚硫酸钾添加量对发酵型茯苓葡萄酒的发酵效果影响,在此基础上采用Box-Behnken设计对主发酵工艺进行优化,并结合所建二次模型获得最佳发酵条件:初始糖度225.56 g/L、接种量3.4%、发酵温度27.23 ℃、偏重亚硫酸钾添加量89.26 mg/L。经验证,所建模型可以较好拟合实际数据,同时感官评价、理化及微生物指标检测数据显示所得茯苓葡萄酒符合相关标准。这与传统果酒和泡制药酒相比既改善了口感、风味,又强化了果酒的保健功能,为发酵型保健果酒的研制提供了参考。
[1]国家药典委员会.中华人民共和国药典[S].一部.北京:中国医药科技出版社,2010.
[2]赵英博,徐 斌,昝俊峰,等.不同产地茯苓中茯苓酸含量的比较研究[J].中国中医药信息杂志,2009,16(7):41-42.
[3]RIOS J L.Chemical constituents and pharmacological properties of Poria cocos[J].Planta Med,2011,77(7):681-691.
[4]WANG Y Z,LI T,ZHAO Y L,et al.Contents of some metabolites in the peel and flesh of the medicinal mushroomWolfiporia cocos(F.A.Wolf)Ryvarden et Gilb.(higher Basidiomycetes).[J].Int J Med Mushrooms,2012,14(1):79-83.
[5]XU Z Y,TANG W R,XIONG B,et al.Effect of revulsive cultivation on the yield and quality of newly formed sclerotia in medicalWolfiporia cocos[J].J Nat Med,2014,68(3):576-585.
[6]邵志芳.葡萄酒品质分析方法研究进展[J].中国酿造,2015,34(4):17-20.
[7]王 谦,宋桂庆.茯苓酒发酵工艺研究[J].食品研究与开发,2007,28(11):3-6.
[8]YANG F F,LONG L J,SUN X M,et al.Optimization of medium using response surface methodology for lipid production byScenedesmussp.[J].Mar Drugs,2014,12(3):1245-1257.
[9]崔培梧,黎继烈,肖作为.环氧基树脂固定化青霉菌柚苷酶的工艺条件[J].食品与发酵工业,2014,40(5):87-92.
[10]WEI Z H,DUAN Y Y,QIAN Y Q,et al.Screening ofGanodermastrains with high polysaccharides and ganoderic acid contents and optimization of the fermentation medium by statistical methods[J].Bioproc Biosyst Eng,2014,37(7):1789-1797.
[11]FAZENDA M,HARVEY L M,MCNEIL B.Effects of dissolved oxygen on fungal morphology and process rheology during fed-batch processing ofGanoderma lucidum[J].J Microbiol Biotechn,2010,20(4):844-851.
[12]陈祖满.桑椹酒人工发酵过程中化学成分变化的研究[J].中国酿造,2010,29(8):139-141.
[13]高 敏,曾新安,彭 郦,等.温度对荔枝酒发酵的影响研究[J].广东农业科学,2010(1):96-98.
[14]王 玲,庞晓智.二氧化硫对菠萝酒发酵过程及品质的影响[J].食品工业,2010(4):38-40.
[15]徐安书,郭 健,汪海英.杨梅果酒发酵工艺的研究[J].食品研究与开发,2015,36(3):67-71.
