高效液相色谱法测定纳豆胶囊中的葛根素
2015-04-12胡雪莲王莉娜
胡雪莲,刘 菲,王莉娜
(北京燕京啤酒集团公司技术中心 啤酒酿造技术北京市重点实验室,北京 101300)
葛根是我国分布较广的药食同源植物,其药用价值极高,素有“亚洲人参”之美誉,具有解肌退热、生津透诊、升阳止泻等功能[1]。其有效成分葛根素(puerarin)化学名为8-β-D-葡萄吡喃糖-4’,7二羟基异黄酮,分子质量为416.38 u[2],由于其具有抗炎解热、扩张冠状动脉血管、增加冠状动脉血流量及降低血压等作用[3],近年已被用于胶囊、口服液、片剂、保健茶等保健食品中。市场上的纳豆作为一种功能性保健食品,具有溶血栓、抗肿瘤、降血压、降血脂、抗氧化性、防止骨质疏松、促凝血等对人体较高的生理功能及营养保健作用,正在被越来越多的消费者所关注[4]。葛根素作为功能性有效成分的一种,将其添加到纳豆胶囊中可以更好的发挥扩张脑血管、降低胆固醇、改善血小板功能、抑制血小板凝集、降低血液粘稠度、改善微循环等功效。因此富含葛根素的纳豆胶囊中葛根素的准确分析对保证产品质量、控制工艺过程具有十分重要的意义。目前国内外已有对原植物[3,5]、保健食品[6-7]及药品[8-9]中葛根素含量测定的相关报道。而辅助添加了葛根提取物的纳豆胶囊中葛根素含量分析并未见有关报道。纳豆是黄豆经发酵而成的风味豆制品,其中富含大量蛋白、脂肪、粗多糖等成分,现市售护肝型纳豆胶囊产品除添加了葛根提取物外,还添加有灵芝粉等,产品基质更为复杂,测定复杂基质样品中的微量葛根素组分是一项困难的工作。关于葛根素的定量分析方法较多,如紫外分光光度法[8,10]、毛细管胶束电动力学色谱法[5,9]、薄层层析法[10-11]、荧光法、高效液相色谱(HPLC)法[12-14]等。本实验建立了富含葛根素纳豆胶囊产品中葛根素含量的高效液相色谱(high performance liquid chromatogrophy,HPLC)分析方法,该方法快速、简便、准确可靠,重现性好,可用于纳豆胶囊的质量控制。
1 材料与方法
1.1 材料与试剂
葛根素标准品:北京世纪奥科生物技术有限公司;甲醇(HPLC级):美国Fisher公司;Milli-Q超纯水:美国Milli-pore公司;乙酸(99.5%)(分析纯):北京化学试剂厂。
1.2 仪器与设备
Waters 2489高效液相色谱仪(真空脱气器、四元泵、自动进样器、柱温箱、UV检测器):美国Waters公司;KQ-500DE型超声振荡器:昆山市超声仪器有限公司。
1.3 方法
1.3.1 标准储备溶液及使用液的配制
标准储备溶液:精确称取葛根素标准品200 mg于100 mL容量瓶中,用体积分数70%的甲醇水溶解定容,配制成质量浓度为2 000 mg/L的贮备液,于4 ℃冷藏备用。
标准使用液:将贮备液稀释20倍,配制成100 mg/L的标准使用液,该溶液通过0.45 μm膜过滤,供HPLC测定。此溶液现配现用。
1.3.2 色谱条件
色谱柱:ZORBAX ODS C18(5 μm,4.6 mm×200 mm);流动相:甲醇+36%乙酸+水(25+3+72);流速:1 mL/min;等度洗脱;检测波长:247 nm;柱温:37 ℃;进样量:10 μL。
1.3.3 样品的制备
将纳豆胶囊脱去外壳,胶囊粉取出混匀,精密称取25 mg样品于25 mL容量瓶中,加入约15 mL体积分数70%的甲醇水溶液,超声提取20 min后用甲醇水溶液定容混匀,静置5 min,上清液经0.45 μm微孔滤膜过滤,滤液供高效液相色谱(HPLC)分析。
2 结果与讨论
2.1 色谱条件的选择
2.1.1 提取溶剂的选择
由于纳豆胶囊的剂型复杂,而且大部分又为复合组方,成分复杂。根据葛根素易溶于甲醇、水等极性溶剂的特性,采用不同体积分数的甲醇/水溶液超声提取,提取液经0.45 μm水相膜过滤,实验发现,体积分数70%的甲醇更能使葛根素提取完全,在除去蛋白质、脂肪等杂质,减少测定干扰方面效果很好,以此作为提取溶剂的样品谱峰干净,无杂质干扰,故选用体积分数70%的甲醇为样品提取溶剂。
2.1.2 检测波长的选择
根据现有文献[2,5-6],葛根素分别在波长239 nm、250 nm、247 nm处有较大紫外吸收,在此基础上,以现有的仪器条件试验了以上3个波长条件下葛根素的响应值,确定在波长247 nm处葛根素有最大吸收。
2.1.3 流动相的选择
分别比较了“甲醇-水”和“甲醇-36%乙酸-水”中性和酸性两种流动相系统[7-10],研究表明流动相为甲醇-36%乙酸-水(25∶3∶72)时,色谱峰形较好,保留时间适中,在此条件下葛根素的出峰时间为17.819 min,通过与标准的色谱图对照,样品中待测组分的色谱图与标准的色谱图匹配性很好,完全可以达到将待测组分与杂质峰完全分离的目的(见图1),满足分析的要求。
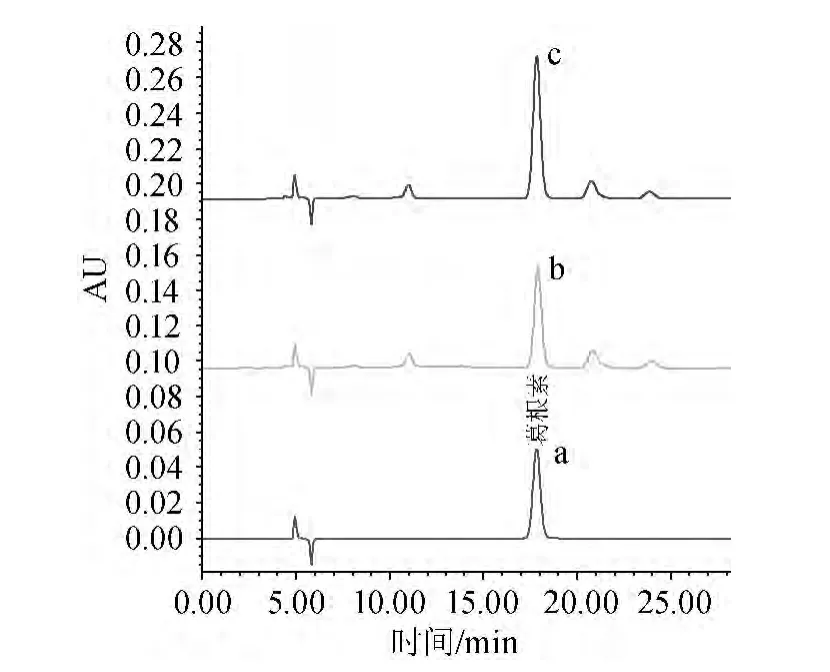
图1 葛根素标准溶液(a),样品(b),样品加标(c)色谱图Fig.1 Chromatogram of puerarin standard solution (a),sample (b)and sample standard addition (c)
2.2 线性关系和灵敏度
将标准贮备液以体积分数70%的甲醇为溶剂适当稀释,配制成系列浓度梯度的标准溶液,在1.3.3条件下依次测定,以峰面积(y)为纵坐标,质量浓度(x)为横坐标绘制标准曲线,进行线性回归分析。其线性范围为0~1 000.0 mg/L,回归方程为y=70 364x+297 207,相关性系数R2为0.999 4,并以3倍信噪比,得出方法检出限为4.5 mg/kg。结果表明线性良好,灵敏度较高(见图2)。

图2 葛根素标准曲线Fig.2 Standard curve of puerarin
2.3 精密度与回收率
精密称取同一样品6份,用上述方法处理、测定,葛根素含量分别为22.5 mg/g、21.8 mg/g、23.1 mg/g、22.9 mg/g、23.7 mg/g、21.4 mg/g,相对标准偏差(relative standard deviation,RSD)为3.8%。分别选取纳豆胶囊样品,添加10 mg/g、20 mg/g、30 mg/g三个质量浓度的葛根素标准溶液,按本方法进行测定,结果(表1)表明,3个浓度的样品加标回收率分别为96.6%~104.3%、103.2%~106.4%、97.5%~105.2%。本方法的准确度及精密度能满足纳豆胶囊中葛根素的分析要求。

表1 纳豆胶囊样品中葛根素的加标回收率Table 1 Recoveries of puerarin in the natto capsule
2.4 样品的检测与分析
按所建方法对统一品牌5个批次样品进行检验,计算葛根素含量,结果见表2。从表2可以看出,该产品葛根素含量稳定在22.2~23.6 mg/g。

表2 纳豆胶囊中的葛根素含量Table 2 Puerarin content in natto capsule
3 结论
在该方法条件下葛根素含量在0~1 000 mg/L范围内线性较好,R2=0.999 4。本方法在10 mg/g、20 mg/g、30 mg/g三个含量的样品加标回收率分别为96.6%~104.3%、103.2%~106.4%、97.5%~105.2%,检出限为0.005 mg/g,本方法前处理简便、准确度、精密度、回收率高、选择性好、分离速度较快,能够达到保健食品中功效成分的测定要求,经分批抽样检测葛根素含量符合要求,该方法可以用于纳豆胶囊中葛根素含量的测定。
[1]王 黎,高苏亚,李 华.不同产地葛根的HPLC 指纹图谱及质量评价研究[J].安徽农业科学,2011,39(18):10782-10784,10801.
[2]中国医学科学院药物研究所.中草药现代研究[M].北京:北京医科大学,中国协和医科大学联合出版社,1995.
[3]金文姗,谈钰元,陈有根,等.高效液相色谱法测定不同产地葛根中葛根素、大豆苷及大豆苷元的含量[J].中国中药杂志,2003,8(1):49.
[4]张 岩,王莉娜.高效液相色谱法测定纳豆及纳豆胶囊中的大豆异黄酮含量[J].北京工商大学学报,2001,29(1):38-41.
[5]CAO Y H,LOU C G,ZHANG X,et al.Determination of puerarin and daidzein in puerariae radix and its medicinal preparations by micellar electrokinetic capillary chromatography with electrochemical detection[J].Anal Chim Acta,2002,452(1):123-128.
[6]刘泰然,赵 珊,张 楠,等.反相液相色谱法测定保健食品中葛根素[J].中国卫生检验杂志,2005,15(2):147-148.
[7]甘宾宾,廖庆明.高效液相色谱法测定保健食品中葛根素的含量[J].化工技术与开发,2006,35(1):21-22.
[8]秦 青,冯敬肖.玉泉冲剂中葛根、人参的薄层鉴别研究[J].药物分析杂志,1994,14(5):56.
[9]阂庆旺,谭生建.薄层扫描法测定愈风宁心片中葛根素的含量[J].药物分析杂志,1994,14(1):57.
[10]吴 可,谢朝晖,王 芳.炮制对葛根中总黄酮及葛根素含量的影响[J].中国医药导报,2011,8(1):64-66.
[11]葛 新,刘秀芬,刘玉明,等.益心脑胶囊中葛根素含量测定方法的研究[J].山西医学院学报,1995,26(4):346-348.
[12]YAN B,XING D M,DING Y,et al.HPLC method for the determination and pharmacokinetic studies on puerarin in cerebral ischemia reperfusion rat plasma after intravenous administration of puerariae radix isolavone[J].J Pharmaceut Biomed,2005,37(2):297-301.
[13]王捷频,王四旺,蒋永培.椒葛软胶囊中葛根素的含量测定[J].中国新药杂志,2005,14(1):83-84.
[14]许宏伟,梁文能,陈若筠,等.高效液相色谱法测定加味葛根素片中葛根素的含量上[J].时珍国医国药,2002,13(8):468-469.
[15]李洪玉,戴诗文,寿 旦,等.葛粉中葛根素的高效液相色谱分析[J].中国实用医药,2009,4(1):39-40.
[16]中华人民国和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 22251—2008 保健食品中葛根素的测定[S].北京:中国标准出版社,2008.
[17]韩 剑,曹 伟,尹 华,等.正交试验法优选葛根素提取工艺[J].中国医院药学杂志,2007,27(3):332-333.
[18]鲁 杰,杨大进,宋书锋,等.层析一高效液相色谱法测定保健食品中葛根素的含量[J].中国食品卫生杂志,2008,20(1):33-36.
[19]中华人民共和国药典委员会.中国药典2010 版[S].一部.北京:化学工业出版社,2010.
