高效液相色谱-荧光检测法检测大米中的赭曲霉毒素A
2015-04-12梁桂娟
梁桂娟,张 琼,杨 波
(贵州省产品质量监督检验院,贵州 贵阳 550004)
我国大多数人以大米为主食,但由于近些年来优质米的产量和销量受到影响,导致一些粮食经营企业收购的大米大量囤积。粮食在收获时未被充分干燥或贮藏运输过程中湿度和温度高都会加速粮食上的真菌迅速生长[1-2]。真菌毒素是真菌在食品或饲料里生长所产生的代谢产物,对人类和动物具有危害。赭曲霉毒素是由曲霉属和青霉属产生的一组重要的、污染食品的真菌毒素,其中赭曲霉毒素A(ochratoxin A,OTA)的毒性最强[3],它能对肝、免疫系统、肾等产生损害[4],甚至有致畸和突变作用[5],被世界卫生组织的国际癌症研究组织列为2B级疑致癌物质[6]。GB 2761—2011《食品安全国家标准食品中真菌毒素限量》中规定谷物及其制品中赭曲霉毒素A的限量为5.0 μg/kg[7]。
目前报道的用于检测赭曲霉毒素A的方法很多,主要有薄层层析法[8],酶联免疫吸附法[9],胶体金免疫层析分析法[10],液相色谱-质谱联用法[11-12],高效液相色谱-荧光检测法[13]等。薄层层析法为定性或半定量的方法,检测周期长,灵敏度和重现性差。酶联免疫法较为常用,且灵敏度高、简单快速,但检测时假阳性率较高。胶体金免疫层析技术是一种快速测定的方法,但适合于保鲜时间短、检测量大的产品。超高效液相色谱-串联质谱法省时高效,但成本高。而高效液相色谱-荧光检测技术灵敏度高,结果准确,而且可以用于同时检测多种真菌毒素[14]。因此,本实验利用高效液相色谱-荧光检测技术分析检测大米中的赭曲霉毒素A,为粮食中赭曲霉毒素A的检测和调查提供良好的技术手段。
1 材料与方法
1.1 材料与试剂
大米:市售。赭曲霉毒素A标准品(纯度>99%):北京泰乐祺科技有限公司。
0.22 μm有机滤膜:上海泽孚实业有限公司;甲醇、乙腈(均为色谱纯):天津市津东天正精细化学试剂厂;氯化钠、碳酸氢钠等试剂为国产分析纯。
磷酸盐缓冲溶液:取8.0 g氯化钠,1.2 g磷酸氢二钠,0.2 g磷酸二氢钾,0.2 g氯化钾溶于990 mL水中,用浓盐酸调pH至7.0,再用水稀释至1 L。
淋洗缓冲溶液:取25 g氯化钠,5 g碳酸氢钠溶于水中,加入0.1 mL吐温-20,用水稀释至1 L。
1.2 仪器与设备
YP202N型电子天平(感量0.01 g):上海精密科学仪器有限公司;EE2101粉碎机:普润有限公司;Agilent1260高效液相色谱仪(带荧光检测器):安捷伦科技有限公司;Bag-Mixer 400SW均质器:法国interscience有限公司;Mnltireax振荡混匀器:德国Heielolph公司;Allegra X-22R冷冻离心机:美国贝克曼库尔特公司;TurboVap氮吹仪:美国Biotage公司;PriboFast 赭曲霉毒素免疫亲和柱(25T):北京泰乐祺科技有限公司。
1.3 方法
1.3.1 色谱条件
色谱柱为Agilent C18柱(150 mm×4.6 mm,5 μm);柱温:25 ℃;流动相:乙腈-水(1%甲酸)=45∶55;流速∶1.0 mL/min;进样量:10 μL;荧光检测波长:激发波长333 nm,发射波长460 nm。
1.3.2 样品前处理
提取:取粉碎的样品25.0 g(精确至0.01 g),加2.5 g氯化钠和50 mL提取液,剧烈振荡提取10 min,静置,过滤,取5 mL滤液转入25 mL比色皿中,用磷酸盐缓冲液定容至刻度,混匀并过滤。
净化:将上述滤液全部倒入玻璃注射器中,下接赭曲霉素免疫亲和柱,以不超过1 mL/min的流速过柱。待流干后依次用10 mL淋洗缓冲液和10 mL水淋洗免疫亲和柱,弃去,再用5.0 mL甲醇以上述方式洗脱,收集洗脱液,于45 ℃氮气吹干,用流动相定容至1 mL,过0.22 μm有机滤膜,上机分析测定。
1.3.3 标准曲线的绘制
准确称取适量(精确至小数点后四位)赭曲霉素A标准品,用少量甲醇溶解并定容,配制成质量浓度为0.1 mg/mL的赭曲霉素A标准储备液。准确移取适量赭曲霉素A标准储备液,用甲醇稀释成质量浓度为2 μg/L、10 μg/L、20 μg/L、50 μg/L、100 μg/L、200 μg/L的系列标准使用液。以峰面积(y)为纵坐标,赭曲霉毒素A含量(x)为横坐标进行线性回归,得标准曲线。
1.3.4 赭曲霉毒素A含量计算
试样中赭曲霉毒素A含量的计算公式如下[15]:
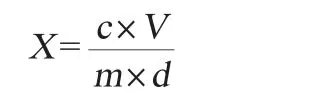
式中:X为试样中赭曲霉毒素A的含量,μg/kg;c为试样提取净化液中赭曲霉毒素A的含量,μg/L;V为甲醇洗脱液体积,mL;m为试样质量,g;d为样品稀释比。
2 结果与分析
2.1 标准品及样品溶液色谱图的绘制
根据1.3的色谱操作条件,得到标准品和样品中的OTA色谱图见图1。由图1可知,所得OTA色谱峰形对称,基线平稳,且样品中的OTA和杂质的分离度好。
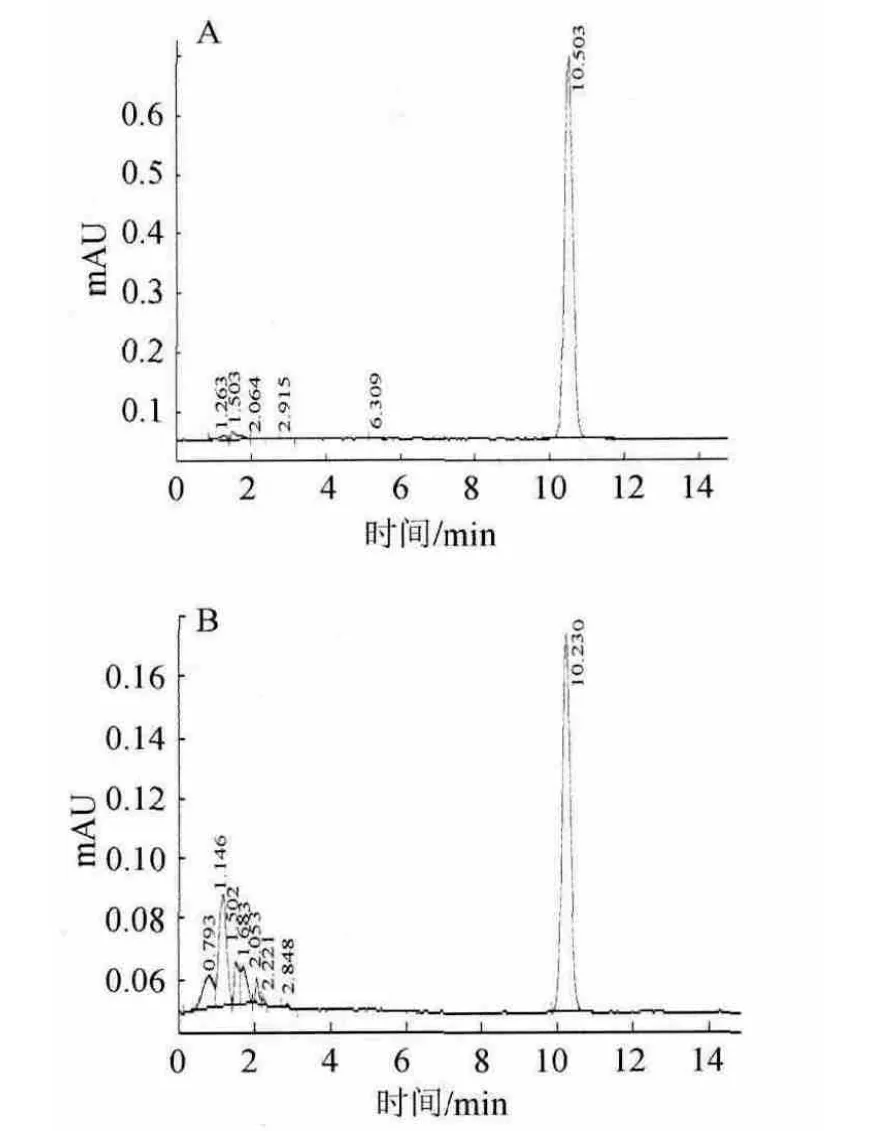
图1 标准品(A)和样品加标(B)的高效液相色谱图Fig.1 HPLC of standard (A) and sample (B)
2.2 标准曲线的绘制
由图2可知,线性回归方程为y=0.05x+0.005,相关系数R2=0.999 16,结果表明,在0~200 ng/mL范围内二者线性关系良好。
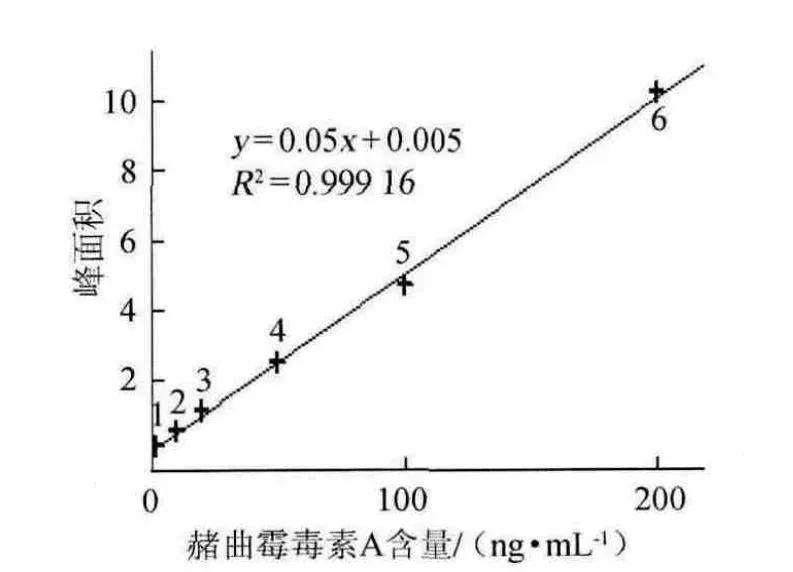
图2 赭曲霉毒素A标准曲线Fig.2 Standard curve of ochratoxin A
将标准品使用溶液逐级稀释,以信噪比S/N=3时的质量浓度为能检测的最低质量浓度,根据本方法中样品的取样量和定容体积,测得赭曲霉毒素A的检出限为0.8 μg/kg。
2.3 回收率实验
精密称取样品25.00 g,分别按照添加量为1.0 μg/kg、2.0 μg/kg、5.0 μg/kg加入赭曲霉毒素A标准品,之后按1.3.2的前处理方法和1.3.1的色谱条件进行测定,每个水平平行测定3次,测定其回收率及相对标准偏差(relative standard deviation,RSD),结果见表1。
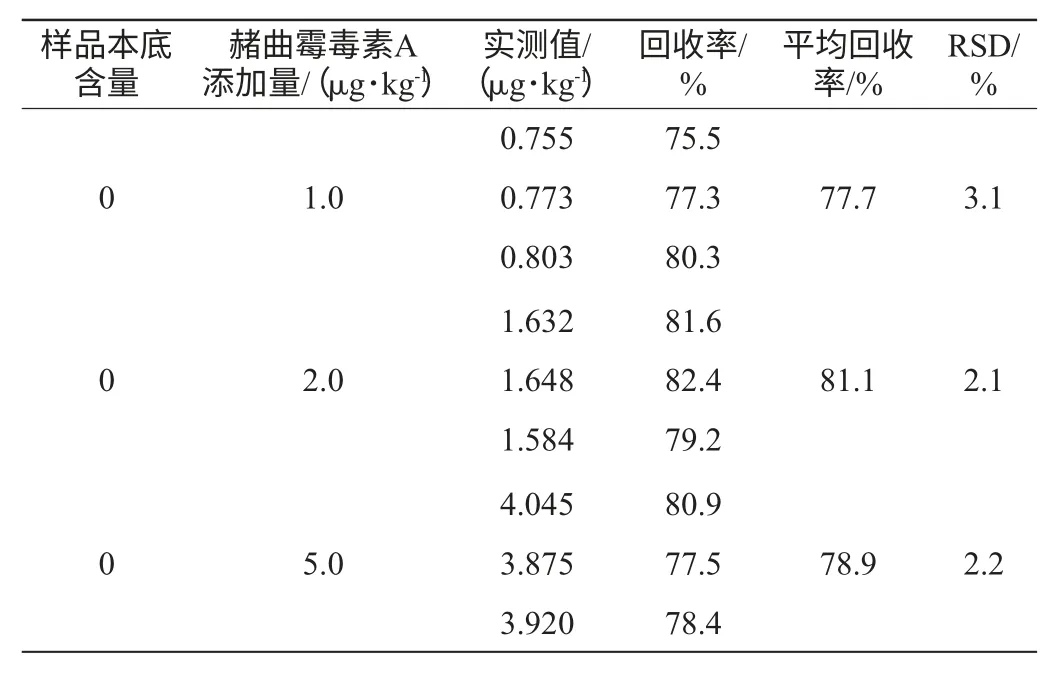
表1 样品回收率实验结果Table 1 Results of recovery assay
由表1可知,检测结果所得平均回收率为77.7%~81.1%,平均RSD为2.1%~3.1%,表示该方法准确度高。
2.4 精密度实验
为进一步考察整个过程的一致性,对10 μg/L的赭曲霉素A标准品连续进样6次,每次进样10 μL,根据峰面积计算精密度及RSD,结果见表2。

表2 精密度实验结果Table 2 Results of precision assay
由表2可知,检测结果的平均RSD为0.71%,<5%,表示该方法精密度良好。
2.5 重现性实验
精确吸取来自同一批原料的试样,按上述测定方法平行测定6次,检验方法的重现性,结果见表3。
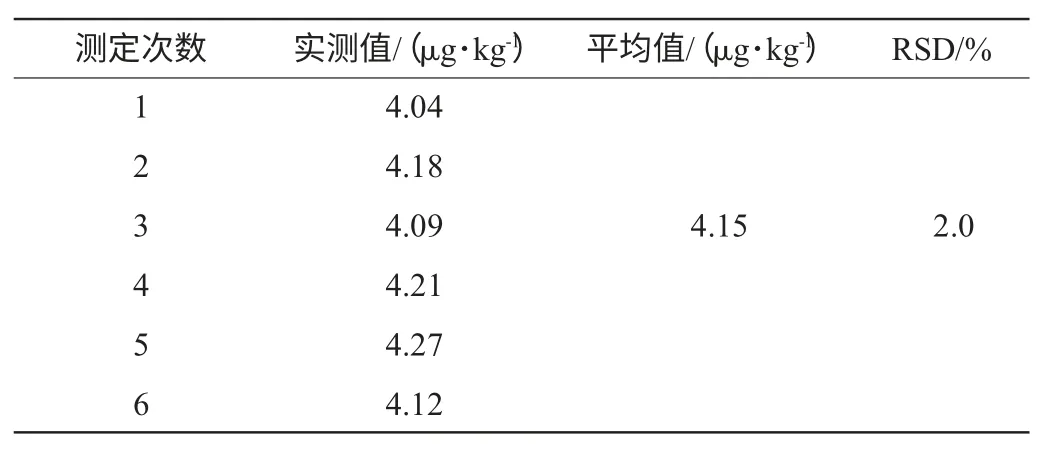
表3 重现性实验结果Table 3 Results of reproducibility assay
由表3可知,RSD=2.0%,<5%,表明该方法重现性好,方法稳定。
2.6 样品中赭曲霉毒素A含量的测定
抽检市面上不同来源的大米共38份,按1.3.1和1.3.2的仪器条件和前处理方法进行上机测定,结果发现有5份样品含有OTA,其余均为未检出,检出率为13.2%,测得其含量分别为1.23 μg/kg、1.58 μg/kg、4.15 μg/kg、2.05 μg/kg、2.13 μg/kg,均小于国家标准规定的限量值(5 μg/kg)。这可能是由于不同样品大米的产地、储藏时间、储藏环境都有所不同所导致。
3 结论
建立了高效液相色谱-荧光光度法检测大米中的赭曲霉毒素A含量的方法。结果表明,本方法前处理简单,准确度和精密度高,检出限低,加标回收率>70%,相对标准偏差<5%,满足食品检测的相关法规标准要求,能满足对样品快速准确的检测。
[1]唐合英.HACCP 在大米生产中的应用[J].粮食加工,2009,34(3):43-46.
[2]王 颖,张妮娜,雒丽娜,等.赭曲霉毒素A 检测方法的研究进展[J].中国卫生检验杂志,2014,24(5):757-760.
[3]王向红,刘 涛,王忠斌,等.高效液相色谱法同时测定谷物中的赭曲霉毒素和玉米赤霉烯酮[J].中国食品学报,2008,8(5):148-152.
[4]MAHAM M,KIAROSTAMI V,WAQIF-HUSAIN S,et al.Analysis of ochratoxin A in malt beverage samples using dispersive liquid-liquid microextraction couples with liquid chromatography florescence detection[J].Czech J Food Sci,2013,31(5):520-525.
[5]耿 霞,赵 强.基于结构转换适配体荧光法检测赭曲霉素A[J].分析科学学报,2013,29(2):164-168.
[6]谢 刚,王松雪,张 艳,等.粮食中赭曲霉毒素A 的快速定量检测-超高效液相色谱法[J].食品安全质量检测学报,2014,5(3):783-790.
[7]中华人民共和国卫生部.GB 2761—2011 食品安全国家标准食品中真菌毒素限量[S].北京:中国标准出版社,2011.
[8]王 帅,陈 贺,张继军,等.牛奶中赭曲霉毒检测方法研究进展[J].中国畜牧兽医,2013,40(Z1):78-80.
[9]柳其芳.酶联免疫吸附法测定粮食、饲料中赭曲霉素的应用研究[J].中国热带医学,2005,5(5):1078-1079,1132.
[10]吴 刚,姜瞻梅,霍贵成,等.胶体金免疫层析技术在食品检测中的应用[J].食品科学,2005,26(5):204-207.
[11]史 娜,路 勇,吴 颖,等.高效液相色谱-串联质谱法测定食品中的赭曲霉毒素A[J].食品科学,2011,32(18):260-263.
[12]侯建波,谢 文,李 杰,等.液相色谱-串联质谱法测定葡萄酒中赭曲霉毒素A[J].中国酿造,2014,33(5):146-149.
[13]傅武胜,邱文倩,郑奎城,等.药食两用类食品中赭曲霉毒素A 的高效液相色谱-荧光检测方法[J].食品科学,2011,32(14):298-302.
[14]TRUCKSESS M,WEAVER C,OLES C,et al.Determination of aflatoxins B1,B2,G1,and G2 and ochratoxin A in ginseng and ginger by multitoxin immunoaffinity column cleanup and liquid chromatographic quantitation:collaborative study[J].J AOAC Int,2008,91(3):511-523.
[15]粮油标准化技术委员会.GB/T 25200—2010 粮油检验粮食中赭曲霉毒素A 的测定高效液相色谱法和荧光光度法[S].北京:中国标准出版社,2010.
