酶联免疫法与液相色谱-串联质谱法检测猪肉中沙丁胺醇
2015-04-12何方洋于信念王兆芹
何方洋,于信念,王 坤,王兆芹
(1.北京勤邦生物技术有限公司,北京 102206;2.北京市食品安全免疫快速检测工程技术研究中心,北京 102206;3.金元证券股份有限公司,广东 深圳 518048)
沙丁胺醇是一种β-受体兴奋剂药物,常用于支气管哮喘以及哮喘性支气管炎等呼吸系统疾病的治疗[1]。由于沙丁胺醇能够减少动物的脂肪沉积、提高其瘦肉率、促进动物生长,因此被不良养殖者非法使用。如果食物中残留沙丁胺醇,那么可导致人体心悸、发烧、头痛、恶心、战栗等症状,对消费者的身体造成伤害[2-3],因此,各国政府都严禁沙丁胺醇用作饲料添加剂,我国农业部发布的《食品动物禁用的兽药及其它化合物清单》明确规定沙丁胺醇等β-受体兴奋剂被禁止所有用途,禁用所有食品动物[4]。
目前,对于沙丁胺醇的残留检测主要有高效液相色谱(high performance liquid chromatograph,HPLC)法、液相色谱-质谱(liquid chromatography-mass spectrum,LC-MS)联用分析法[5-6]、气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)法[7-9]、毛细管区带电泳法(capillary zone electrophoresis,CZE)[10-12]、酶联免疫测定(enzymelinked immunosorbent assays,ELISA)法[13-15]、胶体金免疫层析方法(colloidal gold immunochromatographic assay,GICA)等检测方法[16-18],仪器检测方法具有检测精确度高的优点,但其仪器化程度高,样品处理较复杂、检测费用高,难以对样品进行大量测定,而酶联免疫检测方法对实验人员要求较低,操作简单、快速,无需大型仪器,特异性也较高,可同时检测大量样品,因此本研究采用酶联免疫检测方法(ELISA)和液相色谱-串联质谱(liquid chromatography-tandem spectrometry,LC-MS/MS)法测定猪肉样品中沙丁胺醇的残留量,对比分析这两种方法的检测限、准确度、精密度,由此评估酶联免疫法检测沙丁胺醇的准确性,为快速检测方法的推广使用提供基础研究。
1 材料与方法
1.1 材料与试剂
猪肉:市购。
沙丁胺醇标准品:美国Sigma 公司;沙丁胺醇试剂盒(其中包括包被有沙丁胺醇偶联抗原的96孔酶标板、6种质量浓度的沙丁胺醇标准品和1瓶高质量浓度标准品、酶标二抗浓缩液、抗体工作液、浓缩洗涤液、样本稀释液、底物液A液和B液、终止液):北京勤邦生物技术有限公司;三氯乙酸、乙酸铵、高氯酸、氢氧化钠、乙酸乙酯、叔丁基甲醚、甲酸水溶液、氨水甲醇溶液、β-盐酸葡萄糖醛苷酶/芳基硫酸酯酶均为分析纯:北京百欣试剂公司。
1.2 仪器与设备
Alliance2695/Quattro液相色谱-串联质谱仪:美国Waters公司;DSY-Ⅲ氮吹仪:北京金科精华苑科技有限公司;Anke TDL-40B 低速离心机:上海安亭科学仪器有限公司;90-2 磁力搅拌器:上海振荣科学仪器有限公司;微量移液器(单道20~200 μL、100~1 000 μL、多道250 μL)、MK3酶标仪:美国Thermo公司;DHP-600 生化培养箱:天津市中环实验电炉有限公司;2000SBL 电子天平:美国Setra公司;QL-901 漩涡混合器:海门市其林贝尔仪器制造有限公司;8010S 匀浆机:上海斯伯明仪器设备有限公司;KS-Ⅱ振荡器:上海跃进医疗器械厂;DKZ-2 电热恒温振荡水槽:杭州汇尔仪器设备有限公司。
1.3 实验方法
1.3.1 样品前处理方法
(1)酶联免疫法样品前处理方法
向(2.0±0.05)g猪肉均质样品中加入3%三氯乙酸2 mL,涡动5 min,4 000 r/min室温(20~25 ℃/68~77 ℉)条件下离心5 min;取上清液500 μL,加入0.2 mol/L 磷酸盐缓冲液(phosphate buffer solution,PBS)500 μL,充分混匀(pH值应在7~9),取50 μL用于酶联免疫法分析。
(2)液相色谱-串联质谱方法的样品前处理方法
猪肉样品按照国标农业部1025号公告—18—2008《动物源性食品中β-受体激动剂残留检测液相色谱-串联质谱法》(检测限为0.25 μg/kg)中的操作方法进行样品前处理[19]。
1.3.2 酶联免疫方法测定沙丁胺醇方法
取出微孔板,向微孔中加入50 μL 沙丁胺醇标准品/处理好的样品,然后加入抗体工作液:酶标二抗浓缩液(10∶1,V/V)50 μL,混匀,避光环境25 ℃下反应30 min;用洗涤工作液250 μL/孔洗涤微孔板,然后加入50 μL底物液A液,再加入50 μL底物液B液,混匀,避光环境25 ℃下反应15 min。最后加入50 μL终止液,混匀,设定酶标仪于波长450 nm处测量每孔的吸光度值。
1.3.3 ELISA测定沙丁胺醇标准曲线的绘制及样品沙丁胺醇含量的计算
标准品或样本的百分吸光率的计算公式如下:
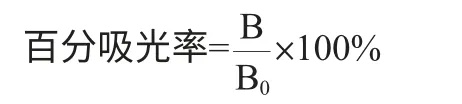
式中:B为标准品溶液或样品溶液的平均吸光度值;B0为空
白(浓度为0标准溶液)的吸光度值。
以标准品溶液的百分吸光率(y,%)为纵坐标,以沙丁胺醇标准品质量浓度(x,μg/L)的对数为横坐标绘制标准曲线,将样品的百分吸光率代入标准曲线中,从标准曲线上读出样本所对应的质量浓度,乘以其对应的稀释倍数即为样品中沙丁胺醇实际残留量。
1.3.4 液相色谱-串联质谱测定条件
(1)液相色谱条件
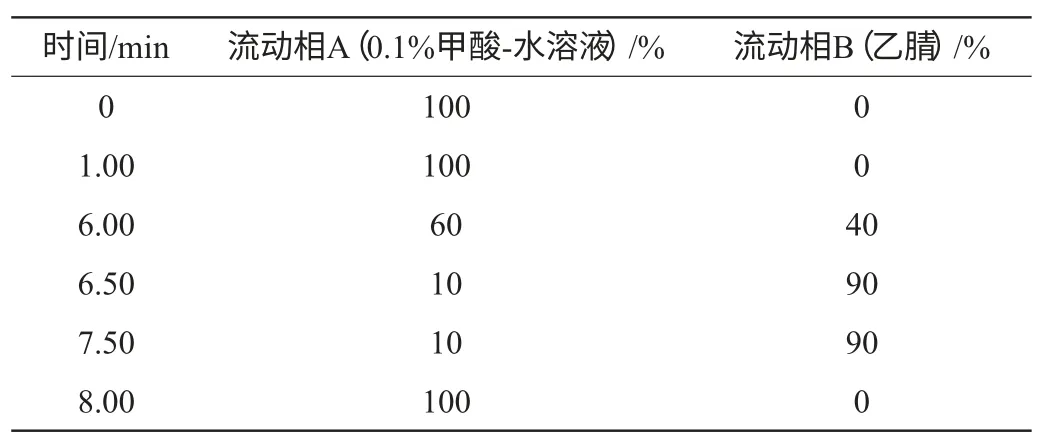
表1 流动相及梯度洗脱条件Table 1 The conditions of mobile phase and gradient elution program
(2)质谱条件
质谱测定条件见表2。
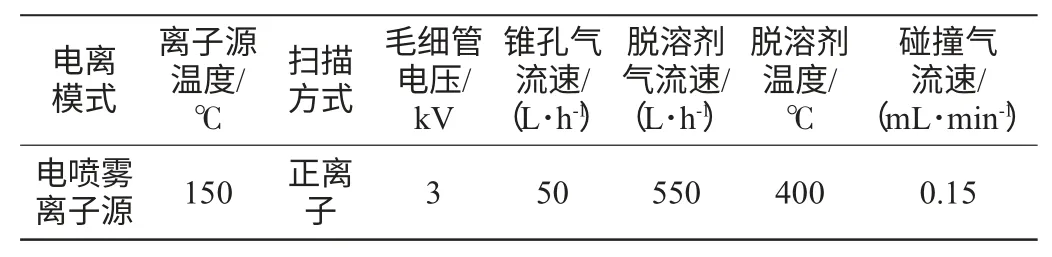
表2 质谱测定条件Table 2 The condition of mass spectrum
1.3.5 液相色谱-串联质谱法标准曲线的绘制及样品浓度的计算
取阴性猪肉添加一定质量浓度的沙丁胺醇标准溶液,按上述方法处理,经液相色谱-串联质谱法分析,得到峰面积。以沙丁胺醇特征离子质量色谱峰面积(y)为纵坐标,以阴性猪肉添加的沙丁胺醇标准品质量浓度(x)为横坐标,绘制LC-MS/MS标准曲线,并采用外标法定量。将样品的峰面积代入标准曲线中,从而读出样品所对应的质量浓度即为样品中沙丁胺醇实际残留量。
1.3.6 准确度和精密度实验
分别以回收率和变异系数(coefficient of variation,CV)表示准确度和精密度。称取阴性猪肉2.0 g置于50 mL聚丙烯离心管中,分别添加沙丁胺醇标准品至终质量浓度为1.0 μg/kg、2.0 μg/kg、4.0 μg/kg。然后利用酶联免疫法和液相色谱-串联质谱法测定沙丁胺醇残留量的回收率和变异系数。
2 结果与分析
2.1 ELISA测定沙丁胺醇标准曲线
按照沙丁胺醇标准曲线制作步骤,分别测定沙丁胺醇标准品质量浓度为0、0.1 μg/L、0.3 μg/L、0.9 μg/L、2.7 μg/L、8.1 μg/L的吸光度值,经ELISA分析,利用RIDAWIN数据分析软件建立标准曲线,结果见图1。
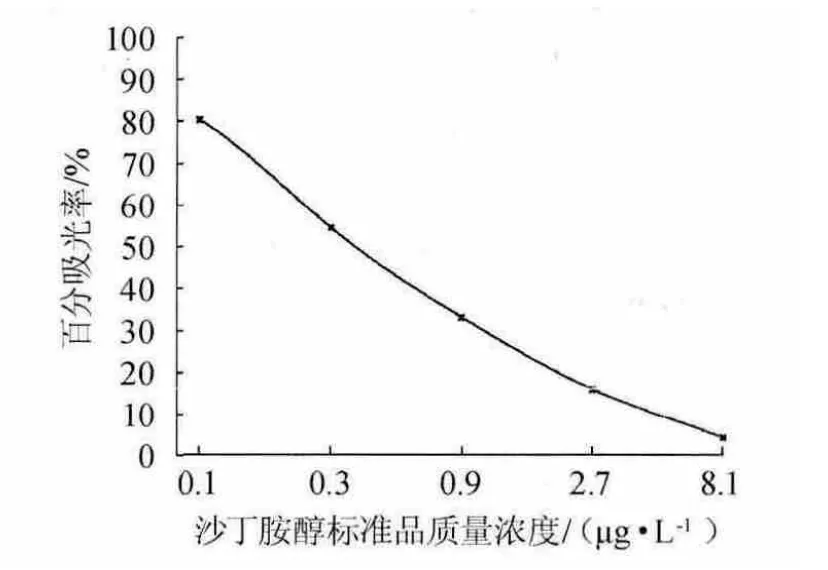
图1 沙丁胺醇ELISA测定标准曲线Fig.1 Standard curve of salbutamol determined by ELISA
由图1可知,标准曲线回归方程为y=-2.224 8x-0.815 2,相关系数R2=0.992 8,其中半抑制浓度(50%inhibitory concentration,IC50)值为0.366 μg/L,表明二者线性良好。
2.2 LC-MS/MS测定沙丁胺醇标准曲线
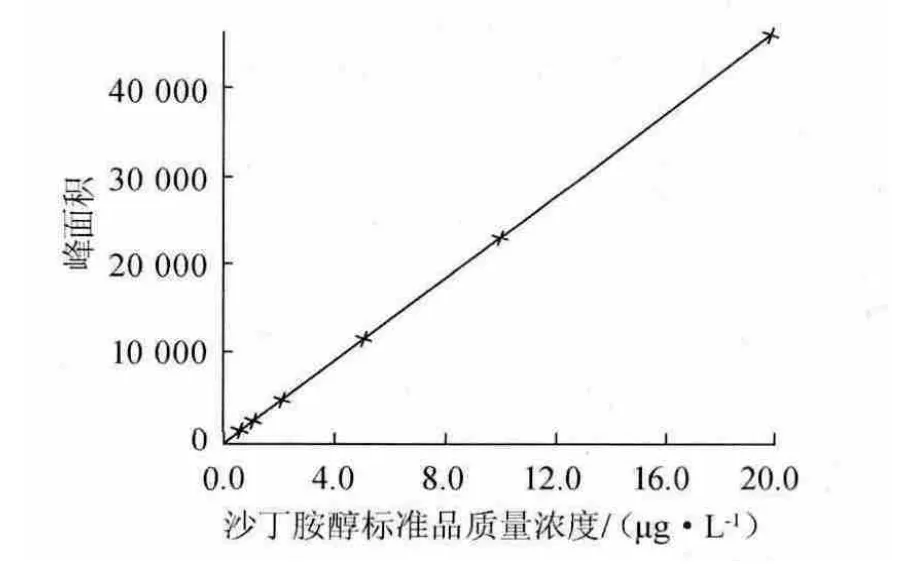
图2 沙丁胺醇LC-MS/MS测定标准曲线Fig.2 Standard curve of salbutamol of LC-MS/MS determined by LC-MS/MS
分别取阴性猪肉样品添加沙丁胺醇标准品质量浓度为0、0.5 μg/L、1.0 μg/L、2.0 μg/L、5.0 μg/L、10.0 μg/L,按上述方法处理,经液相色谱-串联质谱法分析,绘制标准曲线见图2。
由图2可知,标准曲线回归方程为y=2 303.89x,相关系数R2=0.997 37,表明二者线性良好。
2.3 准确度和精密度
常用回收率评估方法准确度,用变异系数评估方法精密度,酶联免疫法和液相色谱-串联质谱法测定准确度和精密度实验结果分别见表3和表4。

表3 ELISA方法测定的准确度和精密度实验结果Table 3 Determination results of accuracy and precision tests by ELISA
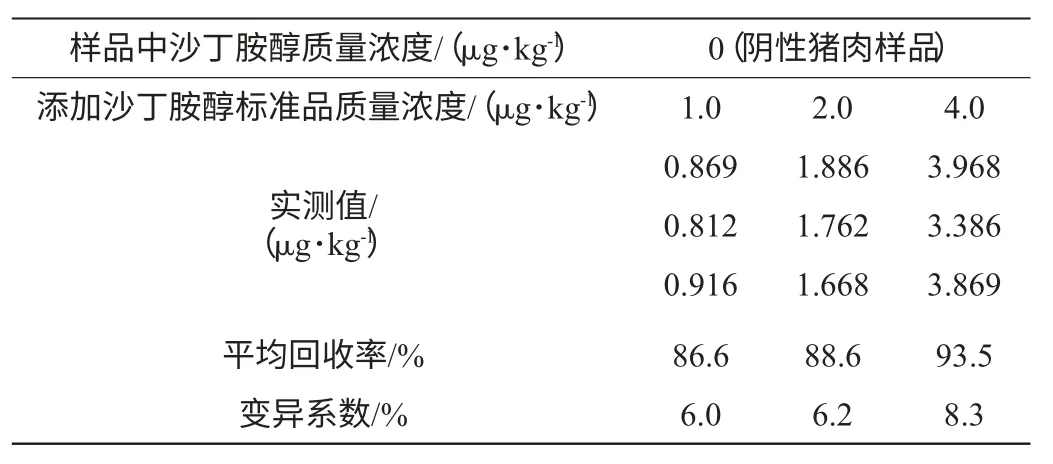
表4 LC-MS/MS法测定的准确度和精密度实验结果Table 4 Determination results of accuracy and precision tests by LC-MS/MS
由 表3、表4 可 知,分 别 添 加1.0 μg/kg、2.0 μg/kg、4.0 μg/kg 3个浓度水平的沙丁胺醇标准品的猪肉样品,酶联免疫法的平均加标回收率分别为83.7%、90.2%和90.9%;变异系数为5.4%~10.3%,液相色谱-串联质谱法的平均加标回收率分别为86.6%、88.6%和93.5%,变异系数为6.0%~8.3%。两种方法加标回收率在83.7%~93.5%,变异系数<10.3%,由此得出酶联免疫法和液相色谱-串联质谱法的准确度及精密度均较好。
2.4 检测限
2.4.1 酶联免疫法
通过标准曲线得到20个空白猪肉样品的沙丁胺醇质量浓度。利用公式:检测限=X+3s(X为重复测定空白样品的平均值,s为重复测定空白样品的标准差),得到该方法的检测限为0.5 μg/kg。
2.4.2 液相色谱-串联质谱法
最低检测限按照信噪比3∶1 计算,得到该方法的检测限为0.25 μg/kg。
2.5 ELISA法和LC-MS/MS法检测实际样品结果
利用ELISA法检测70份猪肉样品,2份疑似阳性猪肉样品(沙丁胺醇质量浓度>0.5 μg/kg)被筛选出,用LC-MS/MS法确证这2份疑似阳性猪肉样品均为阳性,结果见表5,阳性猪肉样品中沙丁胺醇的液相色谱-串联质谱多反应监测(multiple reaction monitoring,MRM)色谱图见图3。
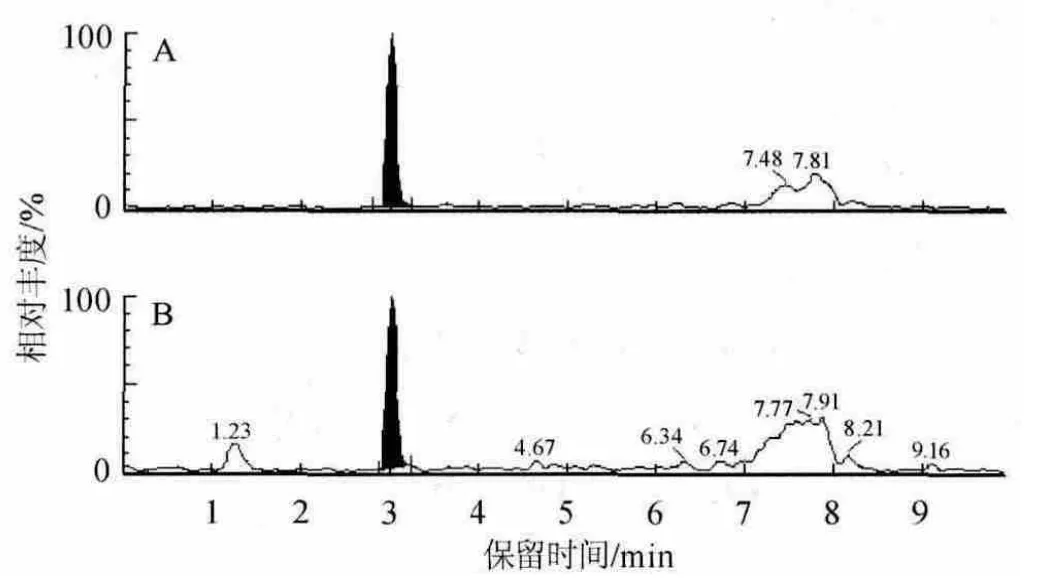
图3 阳性猪肉样品1(A)及样品2(B)中沙丁胺醇的MRM色谱图Fig.3 MRM chromatograms of salbutamol in positive pork sample 1(A) and 2(B)
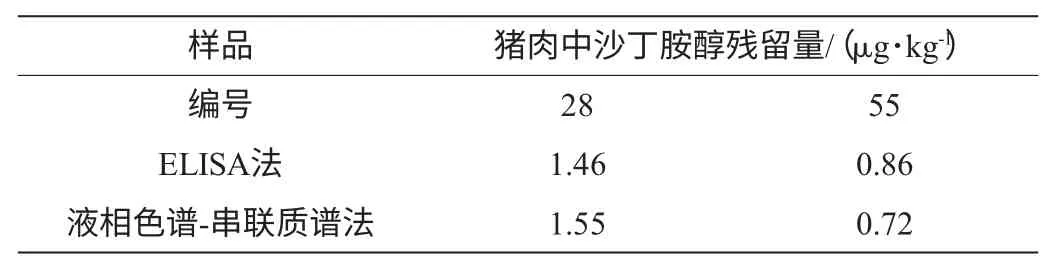
表5 酶联免疫法和液相色谱-串联质谱法检测结果比较Table 5 Determination results of ELISA and LC-MS/MS
由表5可知,酶联免疫方法和液相色谱-串联质谱法测定沙丁胺醇残留量结果基本一致,并且酶联免疫方法的假阳性率为0,因此,适用于猪肉产品中沙丁胺醇残留量检测的快速筛选。
3 结论
目前,酶联免疫法和液相色谱-串联质谱法是测定动物组织中沙丁胺醇残留量时的常用方法。两者的区别在于:酶联免疫法能够对动物源性食品中沙丁胺醇残留进行快速大量筛选,检测时间仅为1~2 h,主要作为一种快速筛选手段,在现场监控和基层检测中广泛使用。但由于快速筛选方法的国家标准或行业标准很少,因此给检测结果判定带来一定困难。而液相色谱-串联质谱方法更为准确、灵敏,适合对快速检测方法的结果进行确证。
本研究利用酶联免疫法和液相色谱-串联质谱法测定猪肉样品中沙丁胺醇药物残留量,结果表明,1.0~4.0 μg/kg添加猪肉样品时酶联免疫法回收率为83.7%~90.9%,变异系数为5.4%~10.3%,检测限为0.5 μg/kg;液相色谱-串联质谱法的平均回收率分别为86.6%~93.5%,变异系数为6.0%~8.3%,检测限为0.25 μg/kg。酶联免疫法适用于进行猪肉样品中沙丁胺醇的快速筛选,液相色谱-串联质谱法适用于阳性样品的确证和精确定量。
[1]陈新谦,金有豫.新编药物学(14 版)[M].北京:人民卫生出版社,1999.
[2]刘宣兵,庞玉芳,侯玉泽,等.沙丁胺醇的毒副作用及其残留检测[J].上海畜牧兽医通讯,2008,53(4):83-85.
[3]栗 艳.“瘦肉精”的危害及防治[J].中国畜牧兽医文摘,2011,27(4):175.
[4]中华人民共和国农业部兽医局.食品动物禁用的兽药及其它化合物清单[EB/OL].http://www.moa.gov.cn/sjzz/syj/dongtai/201006/t20100606_1535262.htm,2002-04-09.
[5]DAVID C J,KENARL D,GEORGE D,et al.The analysis of β-agonists by packed-column supercrltical fluid chromatography with ultraviolet and atmospheric pressure chemical ionisation mass spectrometric detection[J].Analysis,1999,124:827-831.
[6]梁晓聪,程国霞,朱参胜.GC/MS 法同时测定动物组织中4 种β-兴奋剂残留量[J].中国卫生检验杂志,2008,18(2):199-210.
[7]孟 娟,邵 兵,吴国华,等.气相色谱-质谱法同时测定动物性食品中8 种β-兴奋剂的残留量[J].中国卫生检验杂志,2005,15(6):641-643.
[8]SPISSO B F,LOPES C C,MARQUES M A,et al.Determination of β2-agonists in bovine urine comparison of two extraction/clean-up procedures for high-resolution gas chromatography-mass spectrometry analysis[J].J Anal Toxicol,2000,24(2):146-152.
[9]朱 坚,李 波,方晓明,等.气相色谱-质谱法测定肝、肾和肉中11种β2-受体激动剂残留量[J].质谱学报,2005,26(3):129-137.
[10]陈红青.高效毛细管电泳法用于饲料中盐酸克仑特罗与沙丁胺醇含量的测定[J].福州大学学报:自然科学版,2003,31(5):615-617.
[11]段建平,陈红青,陈 颖,等.毛细管区带电泳法同时测定饲料中西马特罗、盐酸克仑特罗和沙丁胺醇[J].色谱,2005,23(3):261-263.
[12]颜流水,温振东,井 晶,等.猪肝中克伦特罗和沙丁胺醇的毛细管电泳-质谱联用分析[J].分析测试学报,2006,25(6):43-45.
[13]HOWELLS L,SAUER M,SAYER R,et al.Extraction and clean up of the beta agonist salbutamol from liver and its determination by enzyme immunoassay[J].Anal Chim Acta,1993,275(1-2):275-278.
[14]杨正涛,张乃生,史利军,等.β-激动剂多组分残留的没脸免疫分析法[J].中国农学通报,2008,24(8):23-24.
[15]王建平,沈建忠.猪肝和猪尿中沙丁胺醇和克伦特罗残留的酶联免疫吸附检测法研究[J].畜牧兽医学报,2005,36(4):397-401.
[16]吴巧丽,叶春生.胶体金免疫层析技术快速检测沙丁胺醇残留[J].现代食品科技,2012,28(11):1595-1599.
[17]张亚峰,张会彩,刘聚祥,等.沙丁胺醇胶体金免疫试纸条的研制[J].中国兽医杂志,2009,45(9):59-60.
[18]王 森,周亚莲,盛慧萍,等.瘦肉精三合一胶体金快速检测板的研制及在畜肉中的应用[J].浙江农业科学,2012(12):1715-1719.
[19]中国兽医药品监察所.农业部1025 号公告—18—2008,动物源性食品中β-受体激动剂残留检测液相色谱-串联质谱法[S].北京:中国标准出版社,2008.
