巴戟天炮制工艺的优化及有效成分变化分析
2015-04-12孙君社胡绍峰张秀清
王 锋,孙君社,胡绍峰,张秀清*
(中国农业大学 食品科学与营养工程学院,北京 100083)
巴戟天(Morinda officinalis)为茜草科植物巴戟天的干燥根,味甘辛,性微温,有补肾阳、强筋骨、祛风湿的功效[1]。巴戟天含有多糖类、环烯醚萜苷类和蒽醌类等多种化学成分,其中丰富的多糖作为补肾壮阳的主要有效成分,能够对人类精子中的脱氧核糖核酸(deoxyribonucleic acid,DNA)起到保护作用[2],同时其还具有治疗老年痴呆症[3]、抗疲劳等生理作用[4]。水晶兰苷作为巴戟天环烯醚萜类物质的一种重要成分,具有抗炎镇痛作用[5],能够抑制软骨细胞凋亡[6],是巴戟天发挥祛风湿作用的主要物质基础。巴戟天中含有多种蒽醌类化合物,研究表明,巴戟天中提取出的蒽醌对于糖尿病的治疗具有帮助作用[7]。目前已经从巴戟天中分离并鉴定的蒽醌类成分共有34种,蒽醌类物质能够增加成骨细胞抗骨质疏松的能力[8],并且具有抗菌、抗癌、抗病毒、凝血等生物活性,但是近几年的研究表明蒽醌类化合物在体内蓄积会导致肝肾损伤[9],而蒽醌类化合物的药效毒效双向作用与其含量有较大的关系,因此研究巴戟天中的蒽醌含量具有重要意义。
巴戟天入药前需要经过炮制,其炮制的方法主要有盐制、蒸制、甘草水制、煮制,目前巴戟天的炮制研究主要集中在盐制上。巴戟天的主要功效之一是补肾壮阳,而盐性寒,有补肾、软坚、凉血解毒的作用,用盐制巴戟天可引药入肾,达到助阳补肾之功[10]。盐制巴戟天的方法主要是用食盐水拌匀,浸渍一定时间,置于适宜蒸制容器内加热蒸透,趁热抽去木心,切片,干燥。
本试验选择巴戟天中的多糖含量作为指标,对巴戟天盐制方法中的3个主要影响因素:氯化钠的质量浓度、浸渍时间和蒸制时间进行单因素试验和正交试验,以确定盐制过程的最佳工艺。并通过测定巴戟天炮制前后其主要活性成分水晶兰苷的含量变化情况,为巴戟天炮制品的质量控制提供试验依据,通过总蒽醌含量的变化情况为巴戟天的炮制机制解析提供一定试验证据。
1 材料与方法
1.1 材料与试剂
巴戟天:采自广东省肇庆地区;水晶兰苷(色谱纯):上海源叶生物技术有限公司;大黄素(纯度≥99%):中国药品生物制品检定所;葡萄糖(纯度≥99%):北京拜尔迪生物技术有限公司;甲醇(色谱纯):西陇化工股份有限公司;无水乙醇、苯酚、浓硫酸等(均为分析纯):北京化工厂。
1.2 仪器与设备
Agilent1200系列高效液相色谱(high performance liquid chromatography,HPLC)仪:美国Aglient公司;酸度计PB-10:德国Sartourius公司;TU-1901 双光束紫外可见分光光度计:北京普析通用仪器厂;TG 16-WS台式高速离心机:长沙湘仪离心机有限公司。
1.3 方法
1.3.1 巴戟天炮制工艺的优化
(1)葡萄糖标准曲线的绘制
采用苯酚硫酸法进行测定[19],标曲绘制方法为:准确称取105 ℃干燥至质量恒定的葡萄糖1.000 g,用蒸馏水定容至100mL,取出1mL该溶液定容至100mL,配成0.1mg/mL的葡萄糖标准溶液。准确吸取标准溶液0、0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL、1.2 mL,分别置于比色管中,各加蒸馏水使体积为2.0 mL。再各加入6%的苯酚1.0 mL,摇匀,迅速滴加浓硫酸5.0 mL。静置10 min后,摇匀,待反应液完全冷却后,于波长490 nm条件下测定其吸光度值,以水作空白试验。以吸光度值为横坐标,多糖含量为纵坐标,绘制葡萄糖标准曲线。
(2)样品中多糖的测定
称取已过60目筛的巴戟天粉末0.200 g,按照料液比为1∶40(g∶mL)加入5%的NaOH溶液,超声提取(90 W)30 min,4 000 r/min离心15 min,取一定体积的上清液,调节pH值至中性(6.8~7.2);再加入4倍体积的无水乙醇进行醇沉,置于4 ℃冰箱中。静置12 h后离心(4 000 r/min、10 min),弃去上清液,用水复溶醇沉多糖后定容至50 mL。吸取样品液1.2 mL,按照标准曲线绘制的方法操作。以空白试剂作参比,在波长490 nm处测量吸光度值。采用标准曲线回归方程计算多糖的含量。多糖含量按下公式计算:
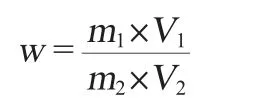
式中:w为多糖含量,mg/g;m1为从标准曲线上查到的样品测定液的葡萄糖含量,mg;V1为样品定容体积,mL;m2为样品的质量,g;V2为比色时所移取样品测定液的体积,mL。
(3)巴戟天炮制的单因素试验
氯化钠质量分数:称取5 g的巴戟天样品5份,分别加入质量分数为2%、4%、6%、8%、10%的氯化钠溶液50 mL,搅匀后浸泡50 min取出,蒸制相同时间后,趁热抽心,至70 ℃的烘箱烘干,粉碎样品,过60目筛,测定多糖含量。
浸渍时间:称取5 g的巴戟天样品6份,加入质量分数为4%的氯化钠溶液50 mL,搅匀,分别浸泡10 min、30 min、50 min、70 min、90 min、110 min后取出样品,蒸制相同时间后,趁热抽心,至70 ℃的烘箱烘干,粉碎样品,过60目筛,测定多糖含量。
蒸制时间:称取5 g的巴戟天样品6份,加入质量分数为4%的氯化钠溶液50 mL,搅匀,浸泡50 min后取出样品,依次蒸制15 min、35 min、55 min、75 min、95 min、115 min后,趁热抽心,至70 ℃的烘箱烘干,粉碎样品,过60目筛,测定多糖含量。
(4)巴戟天炮制的正交优化试验
在单因素试验的基础上,对氯化钠质量分数、浸渍时间和蒸制时间这3个因素分别选择3个水平,进行正交试验,因素与水平见表1。根据正交试验结果,选择出巴戟天炮制过程中的最佳工艺,对最佳工艺进行验证试验。

表1 巴戟天炮制工艺优化正交试验因素与水平Table 1 Factors and levels of orthogonal tests for Morinda officinalis processing technology optimization
1.3.2 巴戟天炮制前后水晶兰苷的测定
(1)色谱条件
色谱柱:Eclipse XDB-C18(5 μm,4.6 mm×250 mm);流动相:0.1%磷酸溶液-甲醇(10%~90%);流速:1.0 mL/min;检测波长:231 nm;柱温:30 ℃;进样量:20 μL。
(2)水晶兰苷标准曲线的绘制
准确称取水晶兰苷标准品5 mg,用甲醇定容至100 mL,即得质量浓度为50 μg/mL的标准溶液。以该标准溶液为母液,分别配制质量浓度为25.000 μg/mL、12.500 μg/mL、6.250 μg/mL、3.125 μg/mL的系列标准溶液。在上述色谱条件下进行HPLC检测,以各质量浓度的水晶兰苷标准液色谱图的峰面积为纵坐标,以相应的水晶兰苷质量浓度为横坐标,制作水晶兰苷的标准曲线。
(3)样品中水晶兰苷含量的测定
称取已过60目筛的样品粉末0.500 g至三角瓶中,加入体积分数为80%的甲醇100 mL,冷浸1 h,超声处理(500 W、53 kHz)30 min,抽滤,向不溶物中再加入体积分数为80%的甲醇超声提取30 min,抽滤,合并滤液于圆底烧瓶中。将滤液旋蒸至干,向圆底烧瓶中加入体积分数为80%的甲醇,在超声水浴中重新溶解分析物,溶解后用体积分数为80%的甲醇定容至50 mL,摇匀,溶液过0.45 μm微孔滤膜过滤器,收集滤液上HPLC仪测定。样品中水晶兰苷含量按下公式计算:
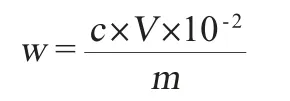
式中:w为水晶兰苷含量,mg/g;c为从标准曲线上查到的样品测定液水晶兰苷的质量浓度,μg/mL;V为样品定容体积,mL;m为样品的质量,g。
1.3.3 巴戟天炮制前后总蒽醌含量的测定
(1)大黄素标准曲线的绘制
标准溶液的配制:称取大黄素标品10 mg,用甲醇定容至100 mL,即得0.1 mg/mL的大黄素标准溶液。
最大吸收波长的选择:取标准溶液1 mL,沸水浴挥干甲醇,加5%氢氧化钠-2%氨水混合碱溶液至10 mL,在190~700 nm的范围内进行全波长扫描,结果显示其最大吸收峰在310 nm,因此检测波长选择310 nm。
反应时间的选择:取标准溶液1 mL,沸水浴挥干甲醇,加5%氢氧化钠-2%氨水混合碱溶液至10 mL,分别反应0、15 min、30 min、45 min、60 min、75 min、90 min于波长310 nm处测定其吸光度值,结果显示,在30 min后,其吸光度值达到了稳定,因此选择反应时间为30 min。
大黄素标准曲线绘制:分别取0、0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL、1.2 mL、1.4 mL的标准溶液于试管中,水浴挥干甲醇,加入5%氢氧化钠-2%氨水混合碱溶液至10 mL,放置30 min后,于波长310 nm处测定吸光度值。
(2)总蒽醌的提取及测定方法
称取已过60目筛的样品粉末2.000 g,加入2.5 mol/L的硫酸30 mL,在沸水浴上回流提取2 h,取出后冷却至室温。向溶液中加入20 mL氯仿,置于62 ℃的水浴上回流提取30 min。将提取溶液进行萃取,收集下层的氯仿溶液,向上层液体中继续加入20 mL氯仿,进行水浴回流提取,重复以上步骤,直至氯仿层为无色。将得到的氯仿层溶液进行混合,弃去上层液体。向氯仿溶液中加入20 mL蒸馏水进行洗涤,洗涤数次,直至水层无色,弃去水层。向氯仿溶液中加入20 mL的5%氢氧化钠-2%氨水的混合碱溶液,收集混合碱液,向氯仿液中再次加入混合碱液,重复操作,直至碱液层为无色,收集混合碱液层。向混合碱液中加入氯仿20 mL,混匀后静置萃取,弃去氯仿层,收集混合溶液层,重复加入氯仿萃取,直至氯仿层为无色。将收集到的碱液层用5%氢氧化钠-2%氨水混合碱溶液定容至250 mL,取该溶液于波长310 nm处测定吸光度值。样品中总蒽醌含量按下公式计算:

式中:w为总蒽醌含量,mg/g;m1为从标准曲线上查到的样品测定液大黄素的含量,mg;V1为样品定容体积,mL;m2为样品的质量,g;V2为比色时所移取样品测定液的体积,mL。
2 结果与分析
2.1 标准曲线的建立
分别以葡萄糖含量(x)为横坐标,吸光度值(y)为纵坐标;水晶兰苷质量浓度(x)为横坐标,峰面积(y)为纵坐标;大黄素含量(x)为横坐标,吸光度值(y)为纵坐标;绘制葡萄糖、水晶兰苷、大黄素的标准曲线见图1。
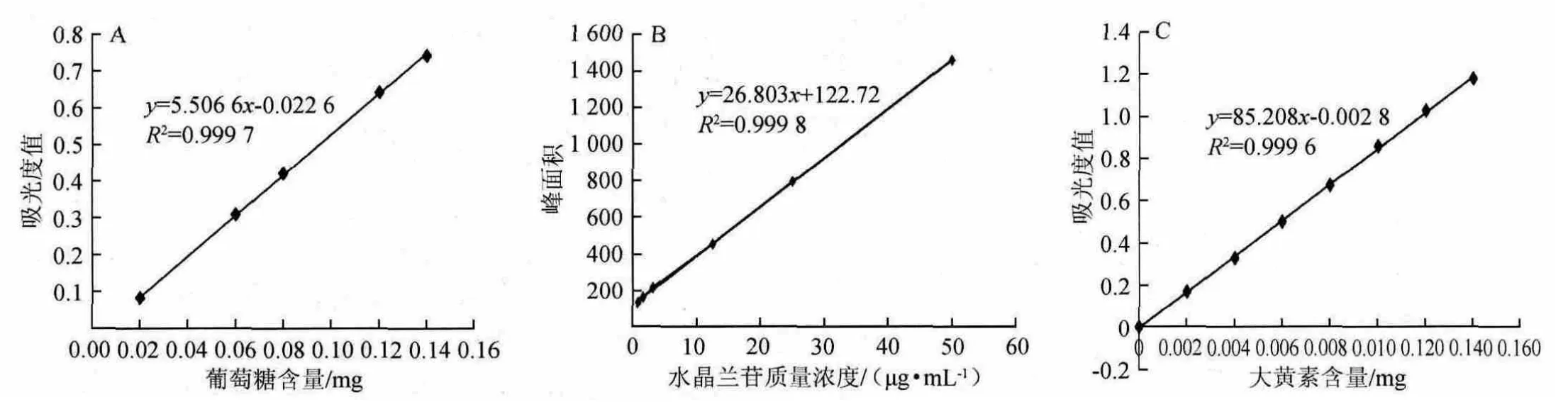
图1 葡萄糖(A)、水晶兰苷(B)及大黄素(C)标准曲线Fig.1 Standard curve of glucose (A),monotropein (B) and emodin (C)
2.2 巴戟天炮制工艺的单因素试验
选取氯化钠质量分数、浸渍时间以及蒸制时间3个影响巴戟天炮制效果的因素做单因素试验,以确定相关因素及各因素的合适范围。如图2a所示,在2%~4%的NaCl含量处理范围内,4%的NaCl含量处理所得巴戟天的多糖含量最高达到17.217 mg/g,显著高于其他NaCl含量处理组。如图2b所示,在10~120 min的考察范围内,50 min的浸渍处理最好,其多糖含量最高达到17.148 mg/g,而时间不足或者过长都会使得多糖含量降低。如图2c所示,在15~115 min的考察范围内,15~95 min,多糖含量逐渐升高,在蒸制95 min时多糖的含量最高为17.738 mg/g,>95 min后多糖含量呈现下降趋势。单因素试验的结果为:选用质量分数为4%的氯化钠,浸渍50 min,蒸制95 min,多糖含量最高。
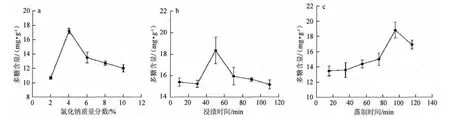
图2 氯化钠质量分数(a)、浸渍时间(b)及蒸制时间(c)对多糖含量的影响Fig.2 Effects of NaCl concentration (a),soaking time (b) and steaming time (c) on polysaccharide content
2.3 炮制工艺优化的正交试验
由于巴戟天炮制样品中的多糖含量实际上是受到氯化钠质量分数、浸渍时间、蒸制时间3个因素交叉影响,为了全面考察这3个因素的影响,设计了正交试验,以确定最佳炮制工艺的参数。根据单因素试验结果,各因素分别选择3个水平进行正交试验。结果及分析见表2,方差分析见表3。

表2 巴戟天炮制工艺优化正交试验结果与分析Table 2 Results and analysis of orthogonal tests for Morinda officinalis processing technology optimization

表3 正交试验结果方差分析Table 3 Variance analysis of orthogonal tests results
由表2可知,各因素对盐巴戟天多糖含量影响的大小关系为:A>C>B,即氯化钠质量分数>蒸制时间>浸渍时间。试验确定的最佳组合为A2B2C2,即用质量分数为4%的氯化钠溶液浸渍50 min,加热蒸制95 min,趁热除去木心。在此最佳条件下进行3次平行验证试验,多糖含量平均值为17.443 mg/g,高于其他组合,且有较好的重复性,说明该工艺可确定为巴戟天炮制的最优工艺。
由表3可知,3个因素中氯化钠质量分数对结果影响极显著(P<0.01),浸渍时间和蒸制时间对结果影响均不显著。
由于巴戟天发挥其主要药理作用的物质是多糖,因此选用多糖作为巴戟天工艺优化的评价指标要比一些研究者选用水晶兰苷以及蒽醌含量作为评价指标[11-12]具有更高的可靠性。该工艺与其他研究者得到的巴戟天炮制工艺[13]相比,具有节省时间、成本、能源的优势,对于生产具有一定的指导价值。
2.4 巴戟天炮制前后水晶兰苷和总蒽醌含量的测定
巴戟天炮制前后水晶兰苷和总蒽醌的含量结果见表5。由表5可知,按照最优的炮制工艺处理巴戟天样品后,其中的水晶兰苷和总蒽醌的含量较未处理之前依次降低了7.18%和10.54%。
炮制后水晶兰苷的含量有所降低,其原因可能是由于水晶兰苷作为环烯醚萜葡萄糖苷类化合物,其分子结构中含羧基和较多羟基等极性基团,在炮制过程中加入氯化钠使得部分水晶兰苷溶解到氯化钠溶液中,导致了水晶兰苷的丢失,使含量降低[14]。这一实验结果与景海漪等[15]的研究结论一致,因此对于巴戟天的生品和炮制品在质量控制时水晶兰苷含量应设定不同的标准。
实验中巴戟天经过炮制后总蒽醌的含量降低,其原因可能是蒽醌在蒸制的湿热条件下不稳定、发生降解所引起的[16]。蒽醌类物质虽然具有多种生物活性,但许多含蒽醌类物质的药材在入药之前需要经过炮制,其炮制机理与蒽醌类化合物的含量有重要关系。研究者通过研究何首乌提取物对人体正常干细胞的作用表明,其中产生影响作用的物质主要为大黄素,大黄素对于正常干细胞的作用具有双重性,低剂量时能够促进干细胞的生长,而高剂量则会抑制干细胞的生长[17]。此外,蒽醌类物质的药效毒效双向作用还与蒽醌类物质存在的状态有关,蒽醌类物质按照存在状态可以分为游离态和结合态,结合态蒽醌在肠道代谢过程中形成蒽酮这一类典型的毒物,从而对肝肾造成损害[18]。部分研究结果表明,未炮制的巴戟天中结合态蒽醌含量约占总蒽醌含量的80%,而炮制后其所占百分比降至50%[19],因此巴戟天入药前经过炮制的机理可能是降低结合蒽醌的含量。
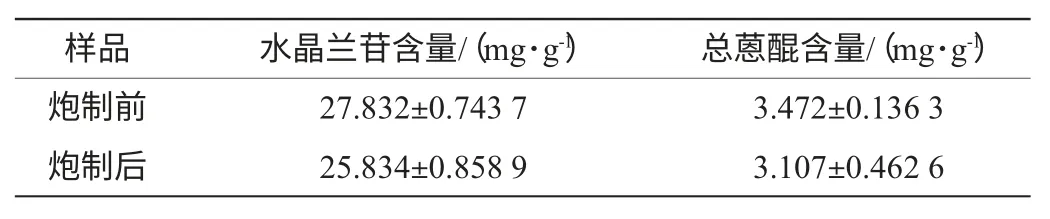
表4 巴戟天炮制前后水晶兰苷和总蒽醌含量Table 4 The contents of monotropein and total anthraquinone in processed and crude pieces
3 结论
巴戟天在临床使用中需要进行炮制,消除或减少药物的毒性、烈性和副作用,增强药物的疗效。盐制作为一种普遍使用的方法,对其炮制工艺的研究具有很大的价值。本试验确定巴戟天最佳的炮制工艺为:用质量分数为4%的氯化钠溶液浸渍50 min,加热蒸制95 min,趁热除去木心。并得到氯化钠质量分数是极显著影响因素,而浸渍时间和蒸制时间为不显著性影响因素。对炮制前后的水晶兰苷和总蒽醌含量进行测定,炮制后水晶兰苷降低了7.18%,总蒽醌含量降低了10.54%。虽然该炮制工艺会造成巴戟天的有效成分水晶兰苷含量的降低,但仅降低了总含量的7%,并未造成较大的损失;本次试验证明了总蒽醌含量在炮制过程中会降低,说明巴戟天炮制的机理可能是降低对肝肾有较大损伤的结合蒽醌的含量,因此在后期的研究中应对游离蒽醌和结合蒽醌的含量分别进行测定,为巴戟天炮制机理提供更有利的证据。
[1]陈 忠,刘琳玲,何猛熊,等.南药巴戟天多糖提取方法的比较研究[J].科技通报,2004,20(6):546-548.
[2]CHEN D L,LI N,LIN L,et al.Confocal mirco-Raman spectroscopic analysis of the antioxidant protection mechanism of the oligosaccharidesextracted fromMorinda officinalison human sperm DNA[J].J Ethnopharmacol,2014,153(1):119-124.
[3]CHEN Y G,LIU X H,LI L,et al.Protection effect of an oligosaccharide extracted from radixMorindae officinalison senile dementia in rats[J].Lat Am J Pharm,2013,32(8):1152-1157.
[4]ZHANG H L,LI J,GEORGE L,et al.Structural characterization and anti-fatigue activity of polysaccharides from the roots ofMorinda officinalis[J].Int J Biol Macromol,2009,44(3):257-261.
[5]CHOI J,LEE K T,CHOI M Y,et al.Antinociceptive anti-inflammatory effect of monotropein isolated from the root ofMorinda officinalis[J].Biol Pharm Bull,2005,28(10):1915-1918.
[6]WANG F,WU L H,LI L F,et al.Monotropein exerts protective effects against IL-1 beta-induced apoptosis and catabolic responses on osteoarthritis chondrocytes[J].Int Immunopharmacol,2014,23(2):575-580.
[7]LIU Q,KIM S B,AHN J H,et al.Anthraquinones fromMorinda officinalisroots enhance adipocyte differentiation in 3T3-L1 cells[J].Nat Prod Res,2012,26(18):1750-1754.
[8]WU Y B,ZHENG C J,QIN L P,et al.Antiosteoporotic activity of anthraquinones fromMorinda officinalison osteoblasts and osteoclasts[J].Molecules,2009,14(1):573-583.
[9]李翠丽,马 江,李会军.蒽醌类化合物的吸收和代谢研究进展[J].药物生物技术,2012,19(6):557-560.
[10]景海漪,史 辑,贾天柱.巴戟天的炮制历史沿革[J].中国药房,2013,24(27):2575-2577.
[11]胡昌江,周弋芠,李金连,等.盐炙巴戟天工艺研究[J].中成药,2009,31(12):1890-1893.
[12]王成永,金传山,吴德玲,等.盐巴戟天炮制工艺改进试验及质量标准研究[J].安徽中医学院学报,2005,24(4):46-47.
[13]许冬谨,伍小妹,黄 云,等.鲜巴戟天盐制工艺[J].中国试验方剂学杂志,2011,17(12):50-52.
[14]刘艳红,周 灿,廖 莎,等.不同炮制去心法对巴戟天水晶兰苷含量的影响[J].中国药师,2014,17(11):1840-1842.
[15]景海漪,史 辑,崔 妮,等.不同炮制方法对巴戟天中寡糖类成分和水晶兰苷含量的影响[J].中国试验方剂学杂志,2014,20(17):20-23.
[16]苏子仁,周 华,刘中秋,等.大黄素的湿热降解机理探讨[J].药物分析杂志,1998,18(2):83-86.
[17]张瑞晨,刘 斌,孙震晓,等.何首乌提取物对人正常肝细胞L02 周期阻滞及凋亡的影响[J].中西医结合学报,2010,8(6):554-561.
[18]李卫先,张 琦,王国仁,等.何首乌不同炮制品致肝损害的研究[J].湖南中医杂志,2011,27(5):129-130.
[19]景海漪,崔 妮,史 辑,等.巴戟天及不同炮制品蒽醌含量比较研究[J].亚太传统医药,2014,10(1):21-23.
