模拟失重条件下成骨细胞核基质DNA拓扑异构酶Ⅱβ的改变
2015-04-11胡泽兵孙中洋张连昌李东韬赵学武
王 瀚,胡泽兵,孙中洋,张连昌,李东韬,2,赵学武,3,张 舒
1第四军医大学航空航天生物动力学教研室,航空航天医学教育部重点实验室,陕西西安 710032;2海军总医院 心脏中心,北京 100048;393175部队医院,吉林长春 130051
随着我国航天事业的蓬勃发展,中长期载人航天活动已经进入初步实施阶段。长时间处于失重环境对航天员造成的不良影响亟待我们深入研究并开发有效的防护措施。失重导致航天员生理变化的细胞学机制已有深入研究,但对失重是如何被机体细胞感知的问题尚无较好的解释。已有较多研究表明,细胞骨架在细胞感知失重过程中起着关键作用[1]。但有着重要功能的核基质(核骨架)在细胞感知失重中的作用尚无研究涉及。由于核基质的成分十分复杂,现已发现其蛋白成分近400种[2]。故核基质没有一种良好的染色或其他原位显示其结构的方法。DNA拓扑异构酶是在DNA复制过程中必不可少的酶类,它同时也是一种核基质蛋白,即核基质结构上的固有成分[3]。本实验研究了DNA拓扑异构酶Ⅱβ(DNA TopoisomeraseⅡβ,TopoⅡβ)在模拟失重后的表达量与分布位置的变化,进而反映核基质的改变。
材料和方法
1 材料 出生3 d SD大鼠乳鼠12只,雄性(第四军医大学实验动物中心),胎牛血清(四季青公司),DMEM-F12/1:1培养基、双抗(Hyclone公司),胰酶(Millipore公司),Ⅰ型胶原酶(Biosharp公司),DNA拓扑异构酶Ⅱβ兔抗鼠多克隆抗体(一抗)、Lamin B1抗体(一抗)、羊抗兔抗体(二抗)(Abcam公司),Hochest染液(Sigma公司),细胞核蛋白抽提试剂盒(碧云天公司),BCA蛋白定量试剂盒(Thermo公司),回转器(2D-RWVs-ISME,中国航天员科研训练中心),激光共聚焦显微镜(FL-1000,Olympus公司),超净工作台(天津泰斯特公司),CO2培养箱(Heraeus公司)。
2 大鼠乳鼠原代成骨细胞培养 取4只出生3 d的SD大鼠乳鼠,脱颈处死,75%乙醇浸泡消毒。超净台中取出乳鼠的颅顶骨,将取出的颅顶骨表面结缔组织刮净,剪碎为直径约1 mm骨片移入培养瓶,加入0.25%胰酶4 ml预消化90 min,间断震荡。弃上清,无血清培养基漂洗2次。加入0.25%胰酶、0.1%Ⅰ型胶原酶混合液4 ml,消化30 min,间断震荡。收集上清液,1 200 r/min离心5 min,弃上清加入2 ml无血清培养基重悬细胞。同样转速时间再次离心,弃上清后加入1 ml完全培养基重悬细胞。再重复胰胶酶消化步骤3次,之后混合所有细胞并计数,以5×105/瓶的密度接种于
50 ml培养瓶[4]。按常规步骤换液传代。后续所有试验均使用第3代细胞。
3 模拟失重 将细胞以2×105/ml的密度接种于玻片上,正常培养1 d后,每个回转舱内随机装入4张玻片,充满完全培养基并排净气泡。将装好玻片的回转舱随机分为对照组和模拟失重组(MG)。将模拟失重组的回转舱安装至回转器,在37℃恒温培养箱内以24 r/min的稳定转速回转48 h。对照组放置在回转器旁边静置培养[5]。
4 间接免疫荧光染色 将玻片从回转舱中取出,PBS漂洗3次,4%多聚甲醛固定15 min。PBS漂洗3次,0.25% Triton-X100室温处理15 min。每张玻片滴加1滴山羊血清,室温封闭30 min,之后小枪头轻轻吸去。组化笔在玻片中间画一小圈,在圈中加入一抗(10 μg/ml),4℃孵育过夜。PBS漂洗3次,后续步骤避光操作。在圈中滴加荧光二抗(1∶1 000),37℃孵育1 h。PBS漂洗3次,再向圈中滴加Hochest染液(1∶1 000)。PBS漂洗3次,抗淬灭剂封片,多聚树脂固定[6]。在激光共聚焦显微镜下观察,以相同激光参数拍摄照片。
5 Western blot检测细胞DNA TopoⅡβ的表达将玻片从回转舱中取出,用胰酶将细胞消化并离心,PBS漂洗2次,用小枪头吸净残留液体。使用细胞核蛋白抽提试剂盒(碧云天公司)按说明书所述步骤提取细胞核蛋白,用BCA试剂盒对核蛋白样本进行蛋白定量。而后进行SDS-PAGE凝胶电泳,常规步骤进行转膜、封闭后分别孵育DNA拓扑异构酶Ⅱβ抗体(1∶1 000)与Lamin B1抗体(1∶1 000)4℃过夜。TBST将膜洗净后,加入HRP标记的二抗(1∶1 000)37℃孵育2 h。TBST漂洗后以ECL发光法进行发光,并使用凝胶成像系统对结果进行扫描分析[7]。以Lamin B1为内参。
6 统计学分析 使用SPSS17.0软件对所有数据进行统计学分析,实验数据以±s表示,组间比较均采用独立样本t检验,双侧P<0.05为差异有统计学意义。
结 果
1 模拟失重致TopoⅡβ分布位置发生改变 成骨细胞TopoⅡβ间接免疫荧光染色结果显示,对照组TopoⅡβ的绿色荧光信号与DAPI细胞核衬染的蓝色荧光信号完全吻合,且呈均匀性点状分布。模拟失重组TopoⅡβ的荧光信号与细胞核衬染的轮廓相符,但绿色荧光的分布失去了对照组的均一性,出现斑点状的局部荧光信号增强(图1中箭头所示),其他部位的荧光信号减弱。
2 模拟失重致TopoⅡβ表达量降低 模拟失重组和对照组成骨细胞免疫荧光染色图片中,分别随机抽取6个400倍视野,对其中细胞的绿色荧光强度使用Image J软件进行分析。对照组荧光强度为68.3±5.6,模拟失重组荧光强度为51.7±3.9,两组差异有统计学意义(P<0.05)(图2)。Western blot检测结果显示,与对照组相比,模拟失重组TopoⅡβ的蛋白表达量显著降低(P<0.05)(图3)。
讨 论
DNA拓扑异构酶是DNA复制过程中不可或缺的关键蛋白,其重要功能是完成DNA拓扑学异构体的转化,使其能够完成后续的复制、转录等过程。DNA拓扑异构酶分为Ⅰ型与Ⅱ型。Ⅰ型DNA拓扑异构酶(DNA TopoisomeraseⅠ,TopoⅠ)使超螺旋DNA在切断结合反应中发生松弛。将互补的单链环状DNA转变成具有螺旋结构的双链环状DNA,使单链DNA打结或解结。TopoⅠ的作用过程中无需ATP供能。Ⅱ型拓扑异构酶(DNA TopoisomeraseⅡ,TopoⅡ)可单独催化闭环状DNA产生超螺旋,同时还可催化促旋酶的催化反应,此过程需要ATP供能[8-10]。

图1 模拟失重后TopoⅡβ分布位置改变Fig. 1 Distribution changes of DNA TopoisomeraseⅡβ
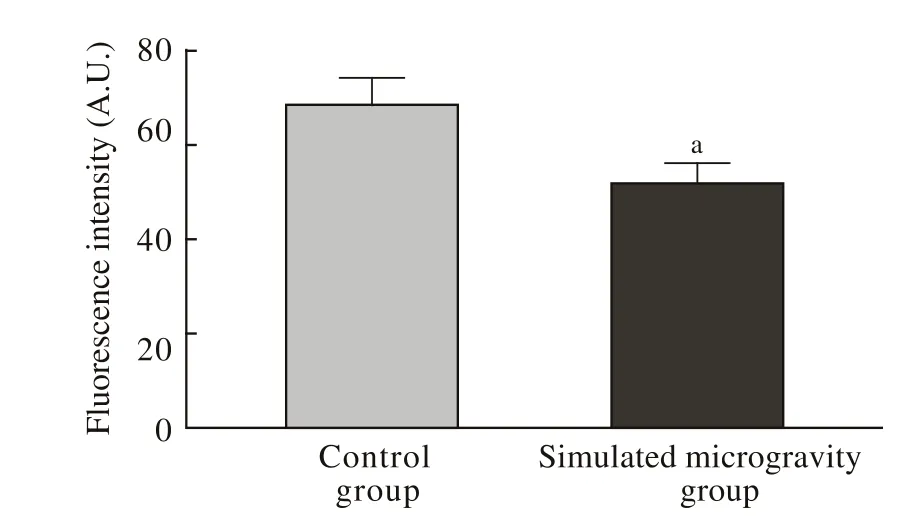
图2 模拟失重后TopoⅡβ免疫荧光强度的变化(aP<0.05, vs对照组)Fig. 2 Fluorescence intensity changes of DNA Topoisomerase Ⅱβ after simulated microgravity (aP<0.05, vs control group)

图3 Western blot检测模拟失重后TopoⅡβ表达的变化(aP<0.05, vs 对照组)Fig. 3 Western blot showing the expression changes of DNA Topoisomerase Ⅱβ after simulated microgravity (aP<0.05, vs control group)
细胞在模拟失重后,与对照组相比,TopoⅡβ的荧光信号分布发生改变,说明模拟失重可以导致细胞TopoⅡβ在核内的位置发生改变。1984年Nishizawa等[11]的研究证实了DNA拓扑异构酶是核基质结构中的一部分,所以本研究结果提示细胞核基质在模拟失重后可发生结构的改变。虽然TopoⅡβ分布位置的改变尚不能作为核基质结构改变的充分条件,但由于核基质的蛋白成分复杂,目前尚未发现良好的染色方法[12]。通过标记其中的某一种关键蛋白,理论上可以从侧面反映其结构变化。模拟失重后,TopoⅡβ发生了局部的聚集与其他部分的密度降低,提示核基质的结构发生了部分聚集挛缩同时其他部分出现了以结构松散为特征的紊乱[13]。核基质的此种改变也符合失重条件下细胞骨架结构改变的特征。但根据当前的实验证据尚不能排除引起TopoⅡβ发生此种改变还存在其他原因。
DNA拓扑异构酶在肿瘤细胞中高表达,这也是肿瘤细胞生长旺盛、增殖迅速的重要原因之一。相反,DNA拓扑异构酶也正成为抗肿瘤药物的重要靶点之一[14]。本次研究发现,模拟失重可以降低成骨细胞中TopoⅡβ的表达。由于Pogorelcnik等[15]的研究已证实TopoⅡβ的表达降低可以抑制细胞DNA的复制,进而影响细胞的增殖功能,最终导致细胞生长缓慢、细胞功能降低的结果,故本实验结果说明了模拟失重引起的DNA复制功能降低的部分原因是TopoⅡβ表达降低。
Wei等[16]的研究已证实,在失重条件下细胞的增殖受到抑制且伴有细胞周期的阻滞。而这种改变的重要原因之一就是失重影响了DNA的复制过程[17]。基于本次实验结果,我们提出3个失重影响DNA复制的可能机制:1)失重引起核基质结构发生局部聚集与局部的疏松。核基质的局部聚集使局部的空间过于拥挤,可以影响复制过程中DNA双链结构打开时的空间结构,以及其他许多类似的过程。核基质的局部疏松则使单位体积内发生DNA复制的位置减少,即DNA的有效复制面积减少。故核基质的聚集与疏松均使DNA复制的效率降低。2)作为核基质蛋白,DNA拓扑异构酶的空间结构会受到核基质结构改变的影响。从微观角度来看,核基质的结构改变可以使定位在改变位置的DNA拓扑异构酶的空间结构发生一定程度的挤压或牵拉等,进而影响其与DNA的结合或改变DNA拓扑结构的功能,最终抑制DNA复制。同样的改变还可能发生在DNA聚合酶、RNA聚合酶等多种核基质蛋白上。3)DNA拓扑异构酶表达量的降低也会降低DNA复制的效率。
失重的力学信号转导一直是空间生物学研究的难点,目前尚未形成公认的观点。虽然目前已对失重导致细胞改变做了较为深入的分子机制研究,发现了诸多重要的信号分子与通路[18-19]。但如此众多的分子调控机制的上游是否存在共同的始动因素,将重力改变的这种力学信号变化转化为细胞内的生物信号,从而引发下游信号的级联反应,目前由于实验技术限制尚缺乏相关的实验研究。但很多学者对于这一问题,基于对失重生物学效应的深刻理解,提出了相对成熟的观点。其中包括Ingber[20]提出的张力模型、细胞骨架感知失重的观点、基因优先改变的观点以及细胞质中物理性质改变的观点[21],但还缺乏直接的实验证据。我们课题组本次研究结果提示,包含有DNA拓扑异构酶的细胞核基质在细胞感知失重的过程中可能起到重要作用。
DNA拓扑异构酶是细胞生命活动重要的调控者,它在失重中改变的发现为研究失重生物效应提出了新方向。DNA拓扑异构酶与核基质之间的关系,及其在失重环境下的改变还有待进一步研究,以便我们早日揭开失重生物效应的神秘面纱,并发现简单有效的防护方法。
1 Vorselen D, Roos WH, Mackintosh FC, et al. The role of the cytoskeleton in sensing changes in gravity by nonspecialized cells[J]. FASEB J, 2014, 28(2): 536-547.
2 Mika S, Rost B. NMPdb: database of nuclear matrix proteins[J]. Nucleic Acids Res, 2005, 33(SI): D160-D163.
3 Kantidze OL, Iarovaia OV, Razin SV. Assembly of nuclear matrixbound protein complexes involved in non-homologous end joining is induced by inhibition of DNA topoisomerase II[J]. J Cell Physiol,2006, 207(3): 660-667.
4 胡泽兵,曹新生,张舒.成骨细胞体外培养技术[J].中国骨质疏松杂志,2014,23(11):1276-1283.
5 Wang B, Zhang S, Wu XY. Effects of BMP-2 on the gene expression of rat osteosarcoma cells under simulated weightlessness[J]. Space Med Med Eng (Beijing), 2004, 17(3):176-179.
6 Feister HA, Onyia JE, Miles RR, et al. The expression of the nuclear matrix proteins NuMA, topoisomerase II-alpha, and -beta in bone and osseous cell culture: regulation by parathyroid hormone[J]. Bone, 2000, 26(3):227-234.
7 Li TK, Liu LF. Tumor cell death induced by topoisomerase-targeting drugs[J]. Annu Rev Pharmacol Toxicol, 2001, 41:53-77.
8 Vettone A, Perugino G, Rossi M, et al. Genome stability: recent insights in the topoisomerase reverse gyrase and thermophilic DNA alkyltransferase[J]. Extremophiles, 2014, 18(5): 895-904.
9 Vejpongsa P, Yeh E. Topoisomerase 2 beta: A Promising Molecular Target for Primary Prevention of Anthracycline-Induced Cardiotoxicity[J]. Clin Pharmacol Ther, 2014, 95(1): 45-52.
10 Khadka DB, Cho WJ. Topoisomerase inhibitors as anticancer agents: a patent update[J]. Expert Opin Ther Pat, 2013, 23(8): 1033-1056.
11 Nishizawa M, Tanabe K, Takahashi T. DNA polymerases and DNA topoisomerases solubilized from nuclear matrices of regenerating rat livers[J]. Biochem Biophys Res Commun, 1984, 124(3):917-924.
12 Razin SV, Iarovaia OV, Vassetzky YS. A requiem to the nuclear matrix: from a controversial concept to 3D organization of the nucleus[J]. Chromosoma, 2014, 123(3): 217-224.
13 Neri LM, Martelli AM, Maraldi NM. Redistribution of DNA topoisomerase II beta after in vitro stabilization of human erythroleukemic nuclei by heat or Cu++ revealed by confocal microscopy[J]. Microsc Res Tech, 1997, 36(3):179-187.
14 Pogorelčnik B, Perdih A, Solmajer T. Recent developments of DNA poisons--human DNA topoisomerase IIα inhibitors--as anticancer agents[J]. Curr Pharm Des, 2013, 19(13):2474-2488.
15 Pogorelcnik B, Perdih A, Solmajer T. Recent advances in the development of catalytic inhibitors of human DNA topoisomerase II alpha as novel anticancer agents[J]. Curr Med Chem, 2013, 20(5):694-709.
16 Wei LJ, Diao Y, Qi J, et al. Effect of change in spindle structure on proliferation inhibition of osteosarcoma cells and osteoblast under simulated microgravity during incubation in rotating bioreactor[J]. PLoS One, 2013, 8(10): e76710.
17 Li X, Yang Y, Li Q, et al. Morphologic characteristics and proliferation of rabbit corneal stromal cells onto complexes of collagen-chitosan-sodium hyaluronate under simulated microgravity[J]. Invest Ophthalmol Vis Sci, 2013, 54(10):6877-6885.
18 Wang JW, Lu DY, Mao DB, et al. Mechanomics: an emerging field between biology and biomechanics[J]. Protein Cell, 2014, 5(7):518-531.
19 Ferranti F, Caruso M, Cammarota M, et al. Cytoskeleton modifications and autophagy induction in TCam-2 seminoma cells exposed to simulated microgravity[J/OL]. http://www.hindawi. com/journals/bmri/2014/904396.
20 Ingber DE. Tensegrity and mechanotransduction[J]. J Bodyw Mov Ther, 2008, 12(3):198-200.
21 Zhuang FY. The possible mechanlsm of the effectsof microgravity on cell function[C]. Proceeding of 2002 Inernational Symposium on Deep Space Exploration, 2002.
