活化条件对固定化葡萄糖异构酶酶活的影响
2012-12-03赵国群周雪艳胡弢
赵国群,周雪艳,胡弢
(河北科技大学生物科学与工程学院,河北 石家庄 050018)
果葡糖浆是一种新发展起来的淀粉糖品,其糖分组成主要是果糖和葡萄糖。果葡糖浆具有甜度高,风味好,发热量低,溶解度高,渗透压大等特点,是蔗糖的很好代用品,因而广泛应用于食品工业,尤其是软饮料工业[1-2]。工业上生产果葡糖浆一般采用玉米淀粉为原料,先经过双酶液化,糖化,转化为葡萄糖溶液,然后采用固定化葡萄糖异构酶进行异构化反应,得到果糖和葡萄糖的混合液即果葡糖浆,再经脱色,树脂处理,蒸发浓缩,得到42%的果葡糖浆[3]。为了方便储运及较高的稳定性,固定化葡萄糖异构酶的商品形态为干燥的颗粒,其中只含极少量的水,因此酶颗粒使用前需进行活化(水化)。活化过程就是用底物(葡萄糖浆)来使酶颗粒吸收水分,从而使酶发挥其催化功效[4]。关于葡萄糖异构酶的固定化方法、稳定性和葡萄糖异构化的研究很多,但是关于固定化葡萄糖异构酶活化的研究却尚未见报道[5-7]。本文对固定化葡萄糖异构酶的最佳活化条件进行了研究,以期提高活化后的酶活,进而提高葡萄糖异构为果糖的生产效率。
1 材料与方法
1.1 主要材料
GENSWEETTMIGI-SA固定化葡萄糖异构酶(简称异构酶):无锡杰能科生物制品有限公司产品,粒径300~1200 μm,浅棕黄色;葡萄糖:石家庄华营葡萄糖有限公司。
1.2 主要仪器
1100型高效液相色谱仪:安捷伦。
1.3 方法
1.3.1 活化时间对异构酶酶活的影响
配制浓度为30%的葡萄糖溶液100 mL,用0.2 mol/L的NaOH溶液调pH到7.5。取6支试管,每支试管中加入0.2 g异构酶和5 mL所配制的葡萄糖溶液,然后将试管置于40℃水浴锅中分别浸泡(活化)0、1、2、3、4、5h。倾倒、沥干糖液,测定酶活。
1.3.2 糖液浓度对异构酶酶活的影响
分别配制浓度为 30%、40%、50%、60%、70%(W/V)的葡萄糖溶液100 mL,用0.2 mol/L NaOH溶液调pH到7.5。取5支试管,每支试管中加入0.2 g异构酶和5 mL所配制的葡萄糖溶液。将试管置于40℃水浴锅中活化4 h。倾倒、沥干糖液。
1.3.3 温度对异构酶酶活的影响
配制浓度为60%的葡萄糖溶液100mL,用0.2mol/L NaOH溶液调pH到7.5。取5支试管,每支试管中加入0.2g异构酶和5mL所配制的葡萄糖溶液,分别在25℃、35℃、45℃、55℃、70℃水浴锅中活化4 h。
1.3.4 糖液pH值对异构酶酶活的影响
分别将60%葡萄糖溶液的pH调整为6.5、7.0、7.5、8.0、8.5。取5支试管,每支试管中加入0.2 g异构酶和5 mL所配制的葡萄糖溶液,然后将试管置于55℃水浴锅中活化4 h。
1.3.5 金属离子对异构酶酶活的影响
配制浓度为60%的糖液400 mL,用NaOH溶液调pH到7.5,并均分到5个烧杯中,然后分别添加MgSO4、CoSO4、ZnSO4、MnSO4,配制成 1.0 mmol/L 的葡萄糖液。取4支试管,每支试管中加入0.2 g异构酶和5 mL配制好的含金属离子葡萄糖溶液,然后将试管置于55℃水浴锅中活化4 h。
1.4 分析方法
1.4.1 果糖含量的测定
本试验采用高效液相色谱法来测定果葡糖浆中果糖的含量。其检测条件为:Waters Sugar-Park色谱柱,示差折光检测器,流速0.5 mL/min,温度70℃,流动相纯水,流速0.5 mL/min,进样量20.0 μL。
1.4.2 固定化葡萄糖异构酶酶活的测定
本试验按照GB 8274-87(固定化葡萄糖异构酶制剂)中所示的方法测定葡萄糖异构酶的酶活。0.2 g固定化葡萄糖异构酶在葡萄糖溶液活化之后,倾倒、沥干糖液,加磷酸缓冲液1.5 mL,硫酸镁溶液0.5 mL,葡萄糖溶液1.5 mL,再加去离子水定容至5 mL,70℃反应1 h,加高氯酸溶液5 mL终止反应,用高效液相法测定其中果糖含量。异构酶的酶活力定义为:在pH为7.5,温度为70℃的条件下,每小时生成1 mg果糖所需的最小酶量为1个酶活力单位。
异构酶酶活(U/g)=果糖浓度(mg/mL)×稀释倍数×10(mL)÷ 酶质量(g)
2 结果与讨论
2.1 活化时间的影响
将固定化葡萄糖异构酶浸泡在30%葡萄糖溶液(40℃)中进行活化,控制不同的活化时间,然后测定其酶活,结果见图1。
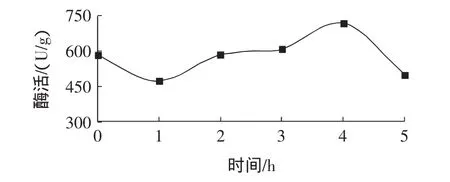
图1 活化时间对异构酶酶活的影响Fig.1 Effect of activation time on the enzyme activity of immobilized glucose isomerase
从图1中发现,活化1 h的异构酶酶活却明显低于未经过活化的异构酶。随着活化时间的延长,异构酶酶活逐渐提高。当活化时间为4 h时,其酶活达到最高,为720.3 U/g。然而,当活化时间延长到5 h时,异构酶酶活又显著下降,低于未经过活化的异构酶。为了方便储存和运输,异构酶固定化后被生产为干态。在干燥过程中,异构酶因失水而发生空间构象的变化,进而影响其酶活。在葡萄糖溶液中进行活化时,异构酶的空间构象趋于恢复原态,其恢复的程度可能与活化时间、活化温度、糖液浓度等有关,也可能与固定化时使用的固定载体有关。或许正是这些影响因素不恰当组合,使得活化后的异构酶空间构象恢复的不理想或最佳空间构象未能长时间保持,从而活化时间过短或过长均造成异构酶酶活降低。
2.2 糖液浓度的影响
在果葡糖浆的生产上,通常使用40%~50%的葡萄糖浆(纯度93%)进行活化[4]。考虑到果葡糖浆的实际生产,本试验采用的活化介质为葡萄糖溶液。将固定化葡萄糖异构酶分别在30%、40%、50%、60%、70%(W/V)的葡萄糖溶液中40℃下活化4h,试验结果见图2。
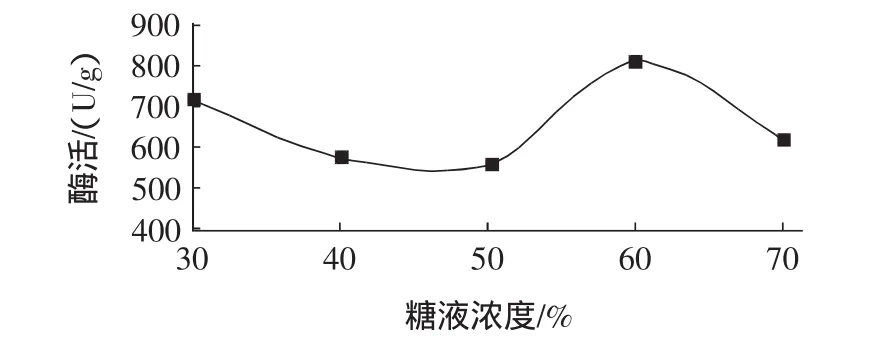
图2 糖液浓度对异构酶酶活的影响Fig.2 Effect of syrup concentration on the enzyme activity of immobilized glucose isomerase
如图2所示,糖液浓度对异构酶酶活有着显著的影响。当糖液浓度为60%时,异构酶酶活最高,达到了811 U/g,同40%葡萄糖溶液的相比,异构酶酶活提高了233 U/g。
2.3 活化温度的影响
异构酶固定化后,耐温性增强,但当温度超过70℃时仍容易变性失活,从而导致酶活降低。因此,生产商建议的活化温度为25℃~55℃,见图3。
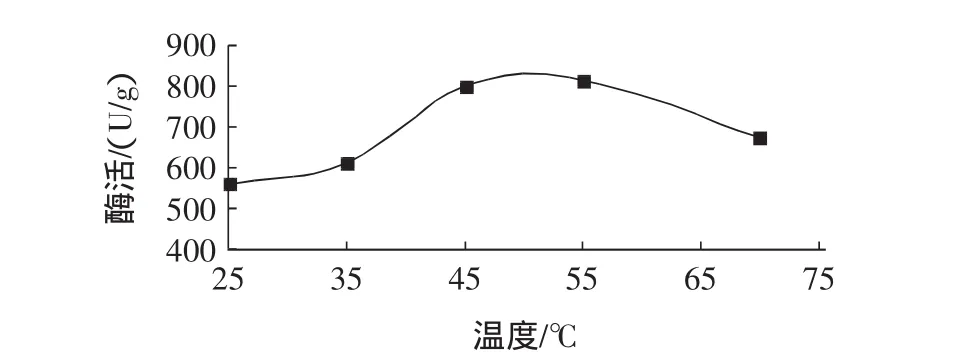
图3 活化温度对异构酶酶活的影响Fig.3 Effect of temperature on the enzyme activity of immobilized glucose isomerase
如图3所示,在25℃~55℃范围内,随着糖液活化温度的升高,异构酶酶活逐渐增加。当活化温度为55℃时,活化后的酶活最高,达815 U/g,同25℃相比,异构酶酶活增加了251.8 U/g。当活化温度超过55℃时,异构酶酶活明显下降。根据此试验结果,在实际生产中选择适宜的活化温度对提高异构酶酶活很重要。
2.4 糖液pH值对异构酶酶活的影响
根据来源不同,异构酶的最适pH有所差异,一般糖异构酶的最适pH在6.5~8.5,见图4。
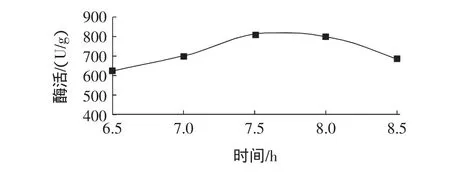
图4 pH对异构酶酶活的影响Fig.4 Effect of syrup pH on the enzyme activity of immobilized glucose isomerase
由图4可见,当糖液pH从6.5升高7.5时,异构酶酶活逐渐升高。pH7.5与pH8.0的酶活基本相同。但在碱性条件下高温(60℃)会使葡萄糖糖浆的颜色加深,所以糖液pH宜选定为7.5。
2.5 金属离子对酶活的影响
葡萄糖异构酶是金属酶。在葡萄糖异构化为果糖时,Mg2+、Co2+、Mn2+等对该酶有激活作用,而 Ca2+、Hg2+、Cu2+等则起抑制作用[8-9]。那么在异构酶活化时是否也需加入金属离子呢?为了考察金属离子在异构酶活化时的影响,在60%葡萄糖溶液中分别添加1.0 mmol/L的 MgSO4、CoSO4、ZnSO4、MnSO4,然后 55 ℃下活化 4 h,试验结果见图5。
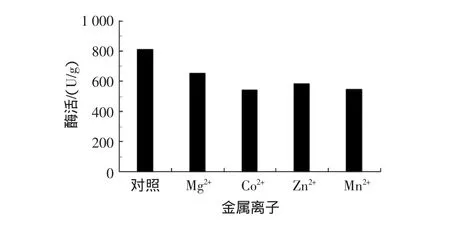
图5 金属离子对异构酶酶活的影响Fig.5 Effect of metal ions on the enzyme activity of immobilized glucose isomerase
由图5可见,同未加任何金属离子的对照相比,异构酶活化时添加 Mg2+、Co2+、Mn2+、Zn2+不但没有使酶活升高,反而明显降低了酶活。这说明Mg2+、Co2+、Mn2+、Zn2+在活化时均起抑制作用。造成这种想象的原因不清楚。或许是活化时添加的金属离子干扰了异构酶水化过程中最佳空间构象的恢复,从而造成酶活的降低。
3 结论
葡萄糖异构酶是果葡糖浆生产中的一个关键酶,其酶活的高低直接影响着生产效率和生产成本。本试验以果葡糖浆生产上普遍使用的GENSWEETTMIGISA固定化葡萄糖异构酶为研究对象,研究了活化条件对其酶活的影响。试验结果表明活化条件对固定化葡萄糖异构酶酶活有着非常显著的影响。GENSWEETTMIGI-SA固定化葡萄糖异构酶的适宜活化条件为:葡萄糖液浓度60%、温度55℃、pH 7.5、时间4 h。经此条件活化之后,其酶活达815 U/g,同常规活化条件(例如,葡萄糖液浓度40%、温度40℃、pH 7.0、时间 4 h)相比,异构酶酶活提高了40%以上。此外,还发现活化时添加 Mg2+、Co2+、Mn2+、Zn2+不但没有使酶活升高,反而明显降低了酶活。因此,在固定化葡萄糖异构酶活化时不适宜加入Mg2+等金属离子。
[1]郝建明.果葡糖浆及其生产工艺要点[J].食品工业科技,2006,27(8):204-205
[2]扶雄,徐丽霞,罗建勇,等.果葡糖浆中果糖分离方法研究进展[J].中国甜菜糖业,2008(1):29-32
[3]李纪亮.F-55高果葡糖浆厂设计和生产[J].食品工业科技,2008,29(10):170-173
[4]姜锡瑞,段钢.新编酶制剂实用技术手册[M].北京:中国轻工业出版社,2002:151-154
[5]葛玉斌,王立平,孔维,等.葡萄糖异构酶的固定化及其性质研究[J].高等学校化学学报,1996,17(5):735-738
[6]Lee H S,hong J.Kinetics of glucose isomerization to fructose by immobilized glucose isomerase:anomeric reactivity of D-glucose inkinetic model[J].Journal of biotechnology,2000(84):145-153
[7]Tukel S S,Alagoz D.Catalytic efficiency of immobilized glucose isomerase in isomerization of glucose to fructose[J].Food chemistry,2008(111):658-662
[8]陶丽梅,过莹立,李宁,等.Mg2+、Co2+、Mn2+和Ca2+对葡萄糖异构酶活性的影响[J].中国生物化学与分子生物学报,1999,15(6):1002-1005
[9]朱国萍,程阳,宫春红,等.葡萄糖异构酶的生物工程研究进展[J].生物化学与生物物理进展,2007,27(2):127-131
