肺腺鳞癌外科疗效分析
2015-04-11杨海堂姚烽孙益峰余科科顾海勇陈天翔赵珩
杨海堂姚烽孙益峰余科科顾海勇陈天翔赵珩
肺腺鳞癌外科疗效分析
杨海堂1姚烽1孙益峰1余科科2顾海勇1陈天翔1赵珩1
目的探讨分析原发性肺腺鳞癌(ASC)临床病理特征及预后因素。方法回顾性分析上海市胸科医院胸外科2008年10月至2014年12月术后病理证实为原发性肺ASC患者的临床资料。分别分析ASC患者3年和5年的总生存率以及5年无病生存率,采用单因素和多因素分析影响总生存期和无病生存期的预后因素。结果该研究共有205例ASC患者纳入分析,其中男性145例(70.7%),女性60例(29.3%);年龄21~70岁,平均年龄(60.7±9.7)岁。N0、N1和N2期(N0 vs N1,P=0.031;N1 vs N2,P=0.037)之间以及Ⅰ、Ⅱ和ⅢA期(ⅠvsⅡ,P=0.021;ⅡvsⅢA,P=0.007)患者之间预后均有统计学差异。Cox多因素回归分析表明:肿瘤T分期(P=0.011)、TNM分期(P<0.001)以及辅助化疗(P=0.008)是总生存期的独立预后因素;而TNM分期(P<0.001)和辅助化疗(P=0.005)是预测相应无病生存期的独立因素。结论ASC患者的预后与肿瘤的T分期和TNM分期有关;术后辅助化疗能提高ASC患者的生存。
腺鳞癌; 外科治疗; 生存
原发性肺腺鳞癌(adenosquamous carcinoma,ASC)是非小细胞肺癌中的一种相对比较少见的类型,约占肺癌的0.4%~4%[1]。世界卫生组织肺部肿瘤分类2015版把ASC定义为ASC中腺癌(adenocarcinoma,AC)和鳞癌(squamous cell carcinoma,SCC)成分至少占肿瘤成分的10%[2]。虽然从形态学上看,ASC是一种由AC和SCC组成的混合型肿瘤,但是诸多研究显示ASC预后显著低于单纯的AC和SCC患者[1,3-5],这表明ASC不是单纯的AC和SCC的混合。本研究回顾性分析了ASC的临床病理特征以及与预后相关的影响因素。
资料与方法
一、病例来源和分组
回顾性分析上海交通大学附属胸科医院胸外科2008年10月至2014年12月术后病理证实为ASC患者的临床资料。根据世界卫生组织肺部肿瘤分类2015版,ASC定义为ASC中AC和SCC成分至少占肿瘤成分的10%[2]。纳入标准:术后病理分期为Ⅰ~ⅢA期且肿瘤完整切除的病例;排除标准:术后切缘阳性以及ⅢB期病例。
二、治疗方案和病理分期
铂类为主的化疗方案作为ASC患者的术后辅助方案。术后病理分期根据第七版肺癌TNM(tumor,node,metastasis)分期。
三、随访
术后前2年常规要求患者每3个月随访一次,之后每6个月随访一次。主要研究终点是总生存期(overall survival,OS)和无病生存期(disease-free survival,DFS)。
四、统计学分析
采用SPSS 19.0软件进行统计分析。正态分布的连续型变量用±s进行表示,非正态分布用中位数表示;连续型数据比较用Student’s t检验或单因素方差分析;率的比较采用χ2检验。采用Kaplan-Meier法绘制生存曲线并进行Log-rank检验。P<0.05表示差异有统计学意义。
结 果
一、ASC患者的临床特征
本研究共有205例ASC患者纳入分析,其中男性145例(70.7%),女性60例(29.3%);年龄21~70岁,平均年龄(60.7±9.7)岁。ASC患者主要为吸烟的老年男性(125/205,61.0%)。行肺叶切除的ASC患者161例,行扩大性切除的有44例,后者包括袖切19例、双叶切14例和全肺切除11例,分别占总病例数的9.3%、6.8%和5.4%。143例(69.8%)患者接受了铂类为主的化疗,包括82例Ⅰ期患者中的52例,43例Ⅱ期患者中的28例,以及80例ⅢA期患者中的63例(表1)。另外,有5例表皮生长因子受体(epidermal growth factor receptor,EGFR)基因突变阳性的患者在复发后接受了表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitors,EGFR-TKIs)治疗。

表1 原发性肺ASC的临床特征
二、术后病理
基于术前细胞学或组织病理学检查结果,共66例术后病理证实为ASC的患者术前被诊断为SCC(n=26)、低分化癌(n=20)、AC(n=19)、大细胞癌(n=1)(表2)。术后TNM分期显示:T1、T2、T3期分别为40例(19.5%)、136例(66.3%)、29例(14.1%));N0、N1、N2期分别为99例(48.3%)、37例(18.0%)、69例(33.7%);Ⅰ、Ⅱ和ⅢA期分别为82例(40.0%)、43例(21.0%)和80例(39.0%)。

表2 ASC患者的术前病理诊断与术后病理分期
三、随访
所有患者随访3~81个月,中位随访时间37.0个月。截止至最后一次随访,51.2%(105/205)的患者死亡,61.5%(126/205)的患者有局部区域复发(n=51)或远处转移(n=75)。胸外器官远处转移位置以脑部(15.6%,32/205)最常见,其次是骨转移(8.8%,18/205)、肝转移(4.9%,10/205)、肾上腺转移(2.4%,5/205)、其他位置(2.9%,6/205),还有4例(2.0%,4/205)未知。4例锁骨上淋巴结转移患者,1例腋下淋巴结转移患者以及1例上眼睑转移患者经外科手术行转移灶切除,病理均证实为纯AC转移。
所有ASC患者3年和5年的总生存率分别为63.6%和41.2%,3年和5年的无病生存率分别为45.3%和32.0%。按照T分期分析,5年总生存率分别为:T1期60.4%,T2期43.7%,T3期6.2%;log-rank检验显示:T1期与T2期比较差异无统计学意义(P=0.233),但T2期显著优于T3期(P<0.001)(图1)。根据N分期分析,5年总生存率分别为:N0期为52.9%,N1期为40.3%,N2期为23.4%;log-rank检验显示:N0期显著优于N1期(P=0.031),N1期又显著优于N2期(P=0.037)(图2)。按照TNM分期分析,5年总生存率分别为:Ⅰ期57.7%,Ⅱ期40.6%,ⅢA期24.1%;logrank检验显示:Ⅰ期显著优于Ⅱ期(P=0.021),Ⅱ期又显著优于ⅢA期(P=0.007)(图3)。5年无病生存率也呈现出类似结果:T分期中T1期与T2期比较无统计学差异(P=0.593),但T2期显著优于T3期(P=0.001);N分期中,N0期优于N1期(P=0.004),N1期又优于N2期(P=0.014);TNM分期中,Ⅰ期优于Ⅱ期(P=0.009),Ⅱ期又优于ⅢA期(P=0.001)。
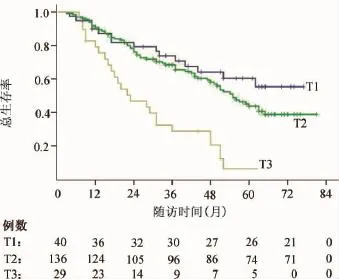
图1 按照术后病理T分期的总生存率比较
另外,在5例复发后使用EGFR-TKIs治疗的患者,3例存活且具有较好的生活质量,分别存活31、32和44个月;2例死亡,其中1例脑转移后存活39个月;1例骨转移后存活37个月。
单因素分析显示:影响DFS及OS的预后因素分别为T分期(P<0.001,P<0.001)、N分期(P<0.001,P<0.001)、TNM分期(P<0.001,P<0.001)以及辅助化疗(P=0.0 3 7,P=0.0 2 7)(表3)。Cox回归多因素分析显示:T分期(P=0.005)、TNM分期(P<0.001)以及辅助化疗(P=0.001)为OS的独立影响因素;结构成分(P=0.030)、TNM分期(P<0.001)、辅助化疗(P=0.005)为相应DFS的独立影响因素(表4)。

图2 按照术后病理N分期的总生存率比较

图3 按照术后病理TNM分期的总生存率比较

表3 单因素分析影响DFS和OS的预后因素

(续表3)

表4 多因素分析影响DFS及OS的预后因素
讨 论
原发性肺ASC相对比较少见,国内外有关临床病理特征及预后因素的研究报道较少。本研究报道了迄今为止国内外样本量最大的单中心外科治疗ASC的经验,结果表明ASC主要发生在60岁左右的男性吸烟患者,这一结果与先前的诸多研究[5,8-10]一致。
当前第七版非小细胞肺癌TNM分期与预后有良好的相关性,其组织学类型主要包括纯AC和SCC患者,而包含较少的ASC患者[11-12]。ASC患者的预后与当前TNM分期是否有良好的相关性尚未得到单独检验。在当前研究中,基于当前的TNM分期方法我们检验了Ⅰ~ⅢA期ASC患者预后与分期的相关性,结果表明在T分期方面,T2期与T3期患者预后差异明显,而T1期和T2期之间的预后无统计学差异;在N分期方面,N0、N1、N2期之间总生存率均存在显著差异;在TNM分期方面,Ⅰ、Ⅱ、ⅢA期之间也存在显著差异。Cox多因素分析表明病理T分期与TNM分期是OS的独立预后影响因素。因此,T分期和TNM分期与ASC的预后有较好的相关性,而N分期与预后是否显著相关有待进一步研究。该研究的缺陷之一是:由于样本大小相对不足,未能进一步细分T1a、T1b、T2a、T2b以及ⅠA、ⅠB、ⅡA、ⅡB期进一步比较。
本研究发现,术后以铂类为基础的辅助化疗亦是预测OS的独立因素,这一结果与之前的一些报道[3-4,10]结果一致。尽管缺乏前瞻性的临床试验,但鉴于其较高的恶性程度,对任何可切除的ASC患者,或许均需考虑术后辅助化疗[13]。ASC患者,甚至是早期,或许能够从多学科诊治中获益。另外,针对ASC这种特殊的组织亚型,目前尚无标准的化疗方案,是否需要考虑计划实施的化疗方案应该将ASC中AC和SCC成分的比例考虑进去仍需要进一步研究。
外科切除可为诊断提供足够的标准,然而细胞学诊断或小块组织活检仅能提供有限的诊断价值信息,尤其对混合有多种组织学类型的肺癌患者难以反映出真正的诊断信息[14-15]。基于细胞学或支气管镜活检,本研究共66例术后病理证实为ASC的患者术前被诊断为SCC(n=26)、低分化癌(n=20)、AC(n=19)和大细胞癌(n=1),这一结果表明对于混合有AC和SCC成分的ASC,术前的细胞学或小块组织活检诊断与手术切除的大体标本诊断之间有差异,反映出前者非手术切除标本对ASC诊断的不足之处[16-18]。了解这一点,尤其对于无法手术的肺癌患者十分重要,因为研究证实贝伐单抗(一种抗血管内皮生长因子的单克隆抗体)容易引起肺SCC患者发生致命性出血并发症[19]。对于瘤体内含有SCC成分贝伐单抗同样也是使用禁忌。也就是说,若原本无法手术的ASC患者通过细胞学或小块活检诊断为AC也不应接受贝伐单抗的治疗。ASC中包含AC成分,这提示ASC患者或许能从EGFR-TKIs治疗中获益。近年来,一些相关研究表明,ASC中EGFR基因突变频率和临床病理特征与AC相类似[20-21],前者也同样能从EGFR-TKIs治疗中获益[22-23]。本研究中共有5例带有EGFR基因有效突变的ASC患者在接受EGFR-TKIs治疗后得到较为满意的结果。因此,若原本无法手术的ASC患者通过细胞学或小块活检误诊为SCC则会错失靶向治疗获益的机会。
T分期和TNM分期能有效预测ASC患者的术后生存;术后以铂类为基础的辅助化疗能有效提高ASC患者预后;有适宜EGFR基因突变进展期的ASC患者也能从EGFR-TKIs治疗中获益。
1 Cooke DT,Nguyen DV,Yang Y,et al.Survival comparison of adenosquamous,squamous cell,and adenocarcinoma of the lung after lobectomy[J].Ann Thorac Surg,2010,90(3):943-948.
2 Travis WD,Brambilla E,Burke AP,et al.WHO classification of tumours of the lung,pleura,thymus and heart[R].Lyon:International Agency for Research on Cancer,2015.
3 Maeda H,Matsumura A,Kawabata T,et al.Adenosquamous carcinoma of the lung:Surgical results as compared with squamous cell and adenocarcinoma cases[J].Eur J Cardiothorac Surg,2012,41(2):357-361.
4 Filosso PL,Ruffini E,Asioli S,et al.Adenosquamous lung carcinomas:a histologic subtype with poor prognosis[J].Lung Cancer,2011,74(1):25-29.
5 Gawrychowski J,Brulinski K,Malinowski E,et al.Prognosis and survival after radical resection of primary adenosquamous lung carcinoma[J].Eur J Cardiothorac Surg,2005,27(4):686-692.
6 Bastide K,Ugolin N,Levalois C,et al.Are adenosquamous lung carcinomas a simple mix of adenocarcinomas and squamous cell carcinomas,or more complex at the molecular level?[J]Lung Cancer,2010,68(1):1-9.
7 Goldstraw P,Crowley J,Chansky K,et al.The IASLC Lung Cancer Staging Project:Proposals for the revision of the tnm stage groupings in the forthcoming(seventh)edition of the tnm classification of malignant tumours[J].J Thorac Oncol,2007,2(8):706-714.
8 Watanabe Y,Tsuta K,Kusumoto M,et al.Clinicopathologic features and computed tomographic findings of 52surgically resected adenosquamous carcinomas of the lung[J].Ann Thorac Surg,2014,97(1):245-251.
9 Ben Y,Yu H,Wang Z,et al.Adenosquamous lung carcinoma:clinical characteristics,surgical treament and prognosis[J].Chin Med Sci J,2000,15(4):238-240.
10 Mordant P,Grand B,Cazes A,et al.Adenosquamous carcinoma of the lung:surgical management,pathologic characteristics,and prognostic implications[J].Ann Thorac Surg,2013,95(4):1189-1195.
11 Wang J,Wu N,Zheng Q,et al.Evaluation of the 7th edition of the tnm classification for lung cancer at a single institution[J].J Cancer Res Clin Oncol,2014,140(7):1189-1195.
12 Bergman P,Brodin D,Lewensohn R,et al.Validation of the 7th tnm classification for non-small cell lung cancer:a retrospective analysis on prognostic implications for operated node-negative cases[J].Acta Oncol,2013,52(6):1189-1194.
13 Riquet M,Perrotin C,Lang-Lazdunski L,et al.Do patients with adenosquamous carcinoma of the lung need a more aggressive approach?[J]J Thorac Cardiovasc Surg,2001,122(3):618-619.
14 Yung RC.Tissue diagnosis of suspected lung cancer:selecting between bronchoscopy,transthoracic needle aspiration,and resectional biopsy[J].RespirCare Clin N Am,2003,9(1):51-76.
15 Bonifazi M,Zuccatosta L,Trisolini R,et al.Transbronchial needle aspiration:a systematic review on predictors of a successful aspirate[J].Respiration,2013,86(2):123-134.
16 Shelton DA,Rana DN,Holbrook M,et al.Adenosquamous carcinoma of the lung diagnosed by cytology:a diagnostic dilemma[J].Diagn Cytopathol,2012,40(9):830-833.
17 Dragnev KH,Gehr G,Memoli VA,et al.Alk-rearranged adenosquamous lung cancer presenting as squamous cell carcinoma:apotential challenge to histologic type triaging of nsclc biopsies for molecular studies[J].Clin Lung Cancer,2014,15(3):e37-e40.
18 Chen J,Gao YD,Cao Y,et al.Surgical specimen histology revealed inadequacy of conventional transbronchial needle aspiration sample in the diagnosis of adenosquamous lung carcinoma[J].J Thorac Dis,2015,7(4):680-686.
19 Sandler A,Gray R,Perry MC,et al.Paclitaxel-carboplatin alone or with bevacizumab for non-small-cell lung cancer[J].N Engl J Med,2006,355(24):2542-2550.
20 Shiozawa T,Ishii G,Goto K,et al.Clinicopathological characteristics of EGFR mutated adenosquamous carcinoma of the lung[J].Pathol Int,2013,63(2):77-84.
21 Powrozek T,Krawczyk P,Ramlau R,et al.EGFR gene mutations in patients with adenosquamous lung carcinoma[J].Asia Pac J Clin Oncol,2014,10(4):340-345.
22 Song Z,Lin B,Shao L,et al.Therapeutic efficacy of gefitinib and erlotinib in patients with advanced lung adenosquamous carcinoma[J].J Chin Med Assoc,2013,76(9):481-485.
23 Iwanaga K,Sueoka-Aragane N,Nakamura T,et al.The longterm survival of a patient with adenosquamous lung carcinoma harboring EGFR-activating mutations who was treated with gefitinib[J].Intern Med,2012,51(19):2771-2774.
Clinical outcomes of primary adenosquamous carcinoma of the lung treated by surgery
Yang Haitang1,Yao Feng1,Sun Yifeng1,Yu Keke2,Gu Haiyong1,ChenTianxiang1,Zhao Heng1.
1Department of Thoracic Surgery,2Department of Pathology,Shanghai Chest Hospital,Shanghai Jiao Tong University,Shanghai 200030,China
Zhao Heng,Email:h_zhao28@163.com
ObjectiveTo analyze the clinicopathological characteristics and prognostic factors associated with primary adenosquamous carcinoma(ASC)of the lung.MethodsThe clinical data of patients with ASC of the lung confirmed by postoperative pathology between October 2008and December 2014in Shanghai Chest Hospital were retrospectively analyzed.The 3-year overall survival,5-year overall survival and 5-year disease-free survival of patients was analyzed,and the prognostic factors for overall survival and disease-free survival were explored by univariate analysis and multivariate analysis.ResultsA total of 205patients were identified,including 145(70.7%)males and 60(9.3%)females with an average age of(60.7±9.7)years(range 21-70years).There were significant differences in the prognosis among patients with N0,N1and N2(N0 vs N1,P=0.031;N1 vs N2,P=0.037)and among patients withⅠ,ⅡandⅢA(ⅠvsⅡ,P=0.021;ⅡvsⅢA,P=0.007).Cox multivariate analysis demonstrated that T stage of tumor(P=0.011),TNM stage(P<0.001)and adjuvant chemotherapy(P=0.008)were independent prognostic factors for overall survival,and TNM stage(P<0.001)and adjuvant chemotherapy(P=0.005)were independent prognostic factors for disease-free survival.ConclusionsThe prognosis of ASC is associated with T stage and TNM stage,and postoperative adjuvant chemotherapy can increase the survival of patients with ASC.
Adenosquamous carcinoma; Surgery; Survival
2015-06-12)
(本文编辑:周珠凤)
10.3877/cma.j.issn.2095-8773.2015.03.005
200030 上海交通大学附属胸科医院胸外科1,病理科2
赵珩,Email:h_zhao28@163.com
杨海堂,姚烽,孙益峰,等.205例肺腺鳞癌外科疗效分析[J/CD].中华胸部外科电子杂志,2015,2(3):161-167.
