腹腔注射三氧化二砷对胶原诱导关节炎大鼠血清炎性趋化因子的影响
2015-04-08任丽民张莉芸张改连高晋芳
任丽民,张莉芸,张改连,许 珂,高晋芳
(山西医科大学附属大医院风湿免疫科,太原 030001)
类风湿关节炎(rheumatoid arthritis,RA)是以侵蚀性、对称性多关节炎为主要临床表现的慢性、全身性自身免疫性疾病,确切发病机制不明。基本病理改变为滑膜炎、血管翳形成,并逐渐出现关节软骨和骨破坏,最终导致关节畸形和功能丧失。三氧化二砷(arsenic trioxide,ATO)是传统中药砒霜的主要成分,目前常用于血液系统疾病的临床治疗。近年实验发现,ATO对RA发病过程中的关键因素如肿瘤坏死因子α(tumor necrosis factor,TNF-α)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、核转录因子Kappa B(nuclear factor Kappa B,NF-κB)的表达有调控作用,通过降低TNF-α表达水平、抑制血管新生、促进成纤维样滑膜细胞的凋亡抑制其增生来达到治疗RA的效果[1]。但其对RA发病过程中趋化因子有无影响以及其作用机制,目前尚不清楚。本研究将通过评估ATO对胶原诱导关节炎(collagen-induced arthritis,CIA)大鼠关节症状的改善程度及观察其对CIA大鼠血清炎性因子的影响探讨其可能作用机制。
材料和方法
实验动物
28只Witar大鼠:清洁级,雌性,体重(160±20) g,购自山西医科大学动物研究中心,饲养于山西医科大学动物房,空调控制室温20℃左右,相对湿度50%,饲养过程中自由摄食及水。
主要试剂和仪器
材料:ATO注射液10mg购于伊达公司;天然牛Ⅱ型胶原、完全弗氏佐剂购于Sigma公司(U.S.A)。Aimplex®Rat Custom 9-plex kit购于北京旷博生物技术有限公司。
仪器:流式细胞仪(NovoCyte D1040型,艾森生物有限公司)。
CIA模型的建立
牛Ⅱ型胶原5 mg溶于2.5 ml 0.01 mol/L pH 3.2的冰醋酸溶液中,4℃冰箱过夜;与25 ml完全弗氏佐剂反复乳化,制成含牛Ⅱ型胶原1 mg/ml的乳化液。分别给予准备造模的Wistar大鼠5个点(背部3个点、尾根部及任一后足掌各1个点)皮内注射乳化液,每点0.1 ml,共0.5 ml。正常组大鼠体内注射等量的生理盐水。第14天,给予每只大鼠用含牛Ⅱ型胶原1 mg/ml的乳化液腹腔注射0.2 ml加强免疫,正常组大鼠腹腔注射等量生理盐水[2]。
实验分组及实验方法
动物准备:给药前实验鼠苦味酸标记常规分组。A组:空白对照组8只;B组:CIA模型对照组8只;C组:ATO治疗组8只。
实验方法:造模第14天后,在20只Wistar大鼠中选择关节炎指数(arthritis index,AI)>7分且双后踝关节X线评分≥Ⅲ级改变的大鼠16只,将其完全随机分为2组,分组进行观察。另选取8只正常鼠作为对照组,分笼饲养。ATO治疗组在分组3 d后腹腔注射ATO液1周,剂量4 mg/kg,最后l d给予8 mg/kg,观察3 d取材[3],历时27 d。对照组以同样方法给予等容量的生理盐水。
关节炎指数评定
AI分为0~4分。0分:无关节炎症(无红肿);1分:有红色斑点或轻度肿胀;2分:关节中度肿胀;3分:关节重度肿胀;4分:关节僵直甚至畸形,严重功能障碍[4]。
主要观察后足踝关节,初次免疫前观察1次,初次免疫后急性期前6周每3天观察1次,此后慢性期每周观察1次。
双后肢足肿胀度测量
用容积法(排水法)测量双后肢的足肿胀度。测量方法:用带刻度的10 ml小试管装适量水,请助手固定大鼠,将待测后肢(包括整个足掌),以胫骨下端内踩处为解剖标志点,深入液面下,观察并记录水面上升数值。测量时点为:初次免疫前测量1次,初次免疫之后每周测量1次。
关节破坏情况观察
给予大鼠四肢关节行X线检查,观察关节破坏情况。每次检查前,对被测大鼠进行麻醉,每只大鼠予5%水合氯醛5 ml/kg,腹腔注射,约过5 min左右,接受麻醉大鼠肌张力消失,结膜反射消失,仰卧位于解剖板,将四肢伸展固定,通常用医用胶布固定,置于X射线机下,在一定放射条件下,留取影像学X线资料。于在初次免疫前、初次免疫后2周(造模成功)、初次免疫后27 d(ATO液干预后)留取大鼠关节影像学资料,由两位有经验的放射学医师结合大鼠关节表现及AI分别对检查结果进行分析,并作出定量评分,同时进行动态观察和组间比较。
影像学破坏分级标准:Ⅰ级:无破坏性改变,可见骨质疏松;Ⅱ级:骨质疏松,可有轻度的软骨破坏,有或没有轻度的软骨下骨质破坏,可见关节间隙狭窄,但无关节畸形;Ⅲ级:骨质疏松加软骨或骨质破坏,关节畸形,如半脱位、尺侧偏斜,无纤维性或骨性强直;Ⅳ级:纤维性或骨性强直。
趋化因子检测方法
干预后麻醉动物,内眦静脉取血2 ml,以2 500 r/min离心15 min,取血清,置于-20℃备检。流式多因子检测技术检测血清正常T细胞表达分泌的活性调节蛋白(regulated upon activation,normal T cell expressed and secreted,RANTES)、单核细胞趋化因子(monocyte chemotactic factor,MCP)-1、干扰素γ诱导蛋白10(interferon gamma induced protein 10,IP-10)浓度,操作按照Aimplex®Rat Custom 9-plex试剂盒说明书进行,按1∶3进行稀释,由FCAP Array软件(V3.0)分析。
统计学分析
应用SPSS 22.0统计软件进行分析,符合正态分布的计量资料用均数±标准差表示,应用两样本t检验进行组间比较;不满足正态分布的计量资料用中位数(四分位数间距)来表示,组间比较应用Kruskl-Wallis秩和检验进行。P<0.05为差异有统计学意义。
结 果
一般情况
造模组大鼠饮食、活动减少,体重增长缓慢,精神倦怠,毛发无光泽;部分大鼠于初次免疫1周后后肢足趾关节开始出现红肿瘀斑,并逐渐加重。药物治疗后精神状态逐渐好转、关节肿胀有不同程度减轻。空白对照组未见上述症状。
关节炎指数、足肿胀度及X线检查
腹腔注射ATO液1周后大鼠关节炎指数、双后足足肿胀度较同期CIA模型组明显改善,差异有统计学意义(表1、图1)。X线检查示,空白对照组关节无破坏,为Ⅰ级改变;CIA模型对照组在造模第14天时关节破坏均达到Ⅲ级改变,27 d后有6只达到Ⅳ级改变,2只为Ⅲ级改变;ATO治疗组在造模第14天时关节破坏均达到Ⅲ级改变,27 d后有4只为Ⅰ级改变,4只为Ⅱ级改变,腹腔注射ATO液后关节破坏程度减轻(图2)。
血清趋化因子水平比较
CIA模型对照组血清RANTES、MCP-1、IP-10均明显高于空白对照组,差异有统计学意义(P<0.05);ATO治疗组与CIA模型对照组相比上述因子均明显降低,差异有统计学意义(P<0.05)(表2、图3)。
表1三氧化二砷对胶原诱导关节炎大鼠关节症状改善程度(27 d)

分组足肿胀度(ml)关节炎指数空白对照组(n=8)4 11±0 140 41±0 11胶原诱导关节炎模型对照组(n=8)8 12±0 15∗6 62±0 91#三氧化二砷治疗组(n=8)5 13±0 102 63±0 92
与三氧化二砷治疗组比较,*t=5.21,*P=0.020,#t=8.73,#P=0.000
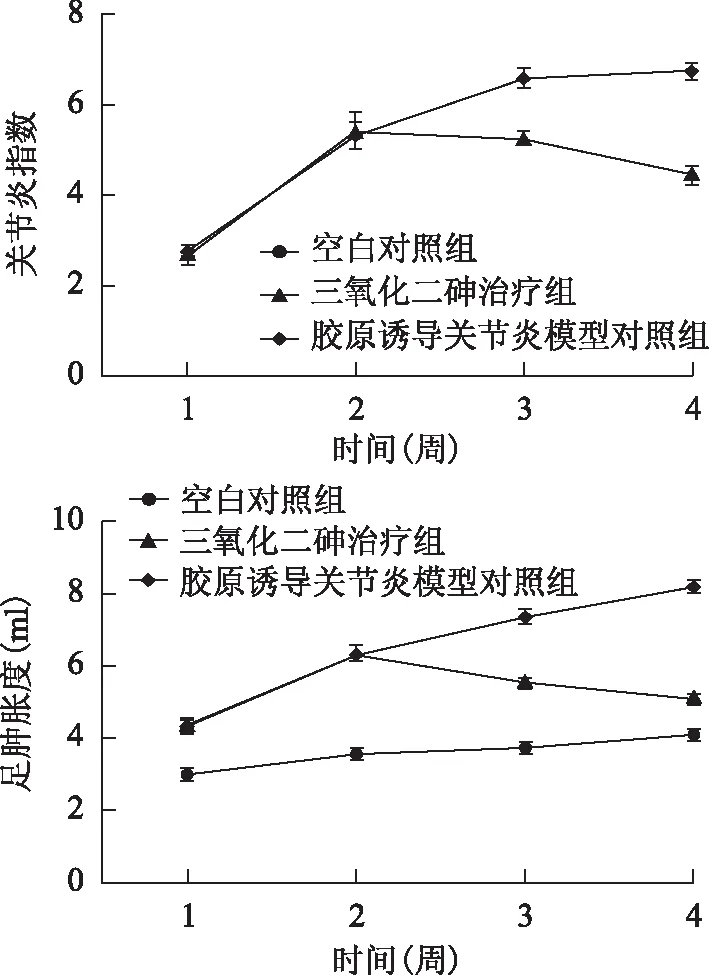
图1各组关节炎指数、足肿胀度变化趋势及组间比较
Fig1Tendency of arthritis index,foot swelling degree of each groups
A:关节炎指数;B:足肿胀度
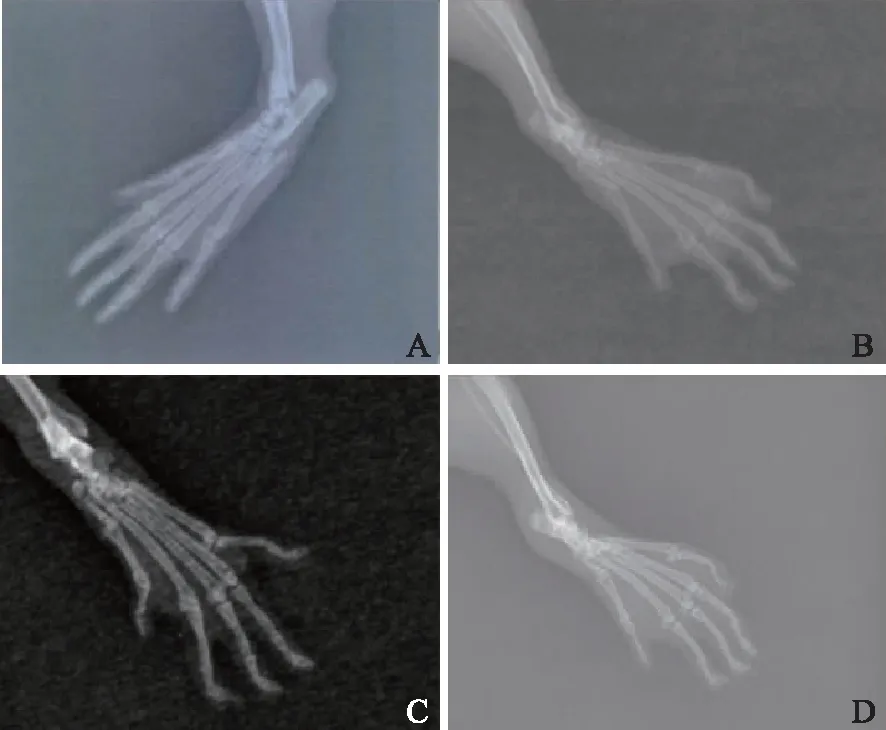
图2三氧化二砷对胶原诱导关节炎大鼠关节影像学X线表现
Fig2Change joint imaging X-ray of CIA rats after inject arsenic trioxide
A:空白对照组大鼠无关节间隙模糊、破坏;B:初次免疫后2周大鼠,骨质疏松、部分间隙狭窄、模糊,可见关节畸形;C:胶原诱导关节炎模型对照组(27 d),关节间隙狭窄、模糊,关节破坏明显,部分关节融合;D:三氧化二砷治疗组(27 d),关节间隙较胶原诱导关节炎模型对照组清晰,骨小梁较致密,关节破坏不明显
表2 各组血清趋化因子水平比较
Table 2 The serum chemokine level of each groups (pgml)
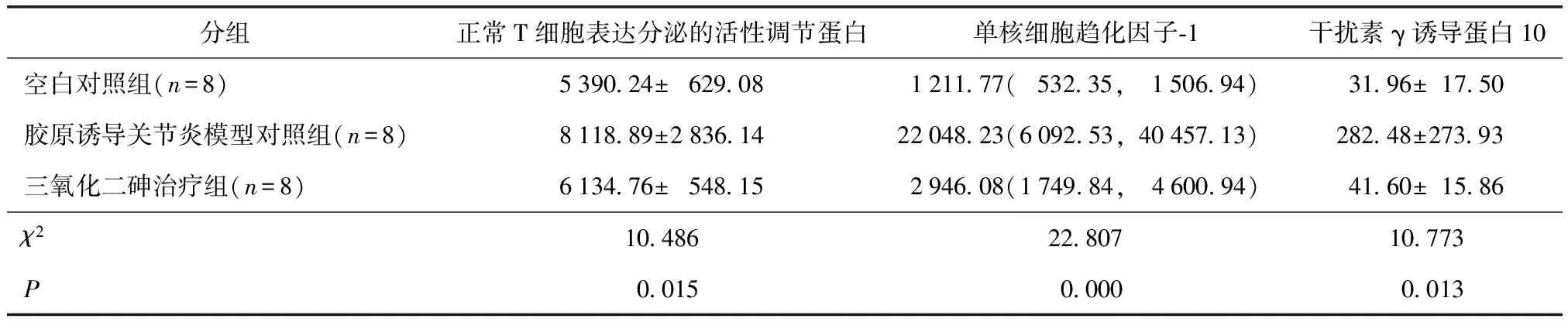
表2 各组血清趋化因子水平比较
分组正常T细胞表达分泌的活性调节蛋白单核细胞趋化因子⁃1干扰素γ诱导蛋白10空白对照组(n=8)5390 24±629 081211 77(532 35,1506 94)31 96±17 50胶原诱导关节炎模型对照组(n=8)8118 89±2836 1422048 23(6092 53,40457 13)282 48±273 93三氧化二砷治疗组(n=8)6134 76±548 152946 08(1749 84,4600 94)41 60±15 86χ210 48622 80710 773P0 0150 0000 013
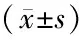
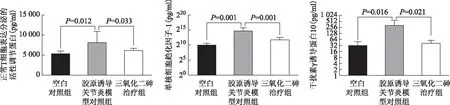
图3各组血清趋化因子水平比较
Fig3Serum chemokine level of each groups
A:正常T细胞表达分泌的活性调节蛋白;B:单核细胞趋化因子-1;C:干扰素γ诱导蛋白10
讨 论
RA是以侵蚀性、对称性多关节炎为主要临床表现的慢性、全身性自身免疫性疾病,致畸、致残率高。目前,用于RA治疗的药物主要为激素、免疫抑制剂以及生物制剂,但对于已经发生畸形的患者上述药物疗效不佳。ATO作为凋亡诱导剂,是治疗白血病的常用药。张志毅等[5]观察到,急性早幼粒细胞白血病合并RA的患者应用ATO治疗后,在白血病缓解的同时,RA的关节损害症状也明显减轻。国外也有报道,ATO用于治疗白血病合并RA的患者,RA的症状也得到明显缓解[6]。
趋化因子是一类可诱导的、分泌型促炎细胞因子,在RA中趋化因子对炎性细胞在关节局部浸润过程中具有重要作用,与滑膜炎、软骨组织破坏及血管新生有密切关系。根据分子结构中半胱氨酸残基的位置不同,趋化因子分为C-X-C、C-C、C、C-X3-C 4大超基因家族。其受体相应命名为CXCR、CCR、CR、CX3CR 4个亚家族。在RA患者血清和关节滑液中有大量趋化因子表达,其中以CCL5/RANTES、CCL3/MIP和CCL2/MCP-1这些CC类趋化因子最为显著[7-8]。RANTES属于CC类趋化因子,主要由T淋巴细胞产生,在炎性T淋巴细胞浸润到关节过程中起关键作用,在RA患者外周血、滑膜细胞、淋巴细胞中均可检测到高水平的RANTES[9]。动物研究发现,关节部位RANTES的表达与关节炎症及关节破坏程度有相关性,经RANTES拮抗剂治疗后可减轻关节炎症[10]。MCP-1也属于CC亚家族成员,主要是对单核细胞、T细胞、自然杀伤细胞产生趋化作用[11]。Yao等[12]研究发现,在RA患者滑膜及滑液中MCP-1表达明显升高。IP-10/CXCL10是CXC类趋化因子之一,干扰素γ和Fas调节信号刺激单核巨噬细胞和T淋巴细胞产生IP-10,与受体CXCR3结合后可向CD4+Th1细胞方向分化,促进炎症反应的发生[13-14]。Kwak等[15]发现,在CIA小鼠血清中IP-10水平明显高于对照组,CXCL10可诱导RANKL表达于破骨细胞前体,刺激RANKL、TNF-α表达于CD4+T细胞从而导致骨破坏,提示IP-10有助于炎细胞的招募和参与RA骨侵蚀破坏。
可见,趋化因子是RA发生发展过程中重要炎性介质,但是腹腔注射ATO液对RA发病过程中异常改变的趋化因子有无影响以及具体机制如何,目前尚无报道。本研究通过腹腔注射治疗剂量的ATO液来观察CIA大鼠关节症状的缓解程度,并通过流式多因子检测技术对CIA大鼠血清中RANTES、MCP-1、IP-10进行检测。结果发现,CIA模型组血清中RANTES、MCP-1、IP-10均明显高于同期空白对照组,说明CIA大鼠体内存在免疫功能紊乱,上述炎性趋化因子表达异常,可能在RA的发病中起一定作用。经腹腔注射ATO后CIA大鼠关节炎指数明显降低,上述血清趋化因子也显著低于同期CIA模型对照组,说明ATO改善CIA大鼠的关节炎症状的作用机制可能通过下调趋化因子MCP-1、RANTES、IP-10水平的表达来发挥作用。
本研究结果虽然证实了腹腔注射ATO液可以下调CIA大鼠血清中的趋化因子的产生,但这种作用效应是直接通过下调趋化因子及其受体蛋白或基因表达还是间接作用于各趋化因子诱导物或分泌细胞来使得血清趋化因子水平降低还需进一步实验探讨。
[1]王金帆,何成松.三氧化二砷对类风湿关节炎治疗作用机制的研究进展[J].西南军医,2013,23:274-277.
[2]Stuad JM,Cremer MA,Townes AS,et al.Type lI collagen induced arthritis in rats:passive transfer with serum and evidence that IgG antieollagen antibodies can cause arthritis[J].Exp Med,1982,155:1-16.
[3]崔宁,杨娉婷,赵丽娟,等.三氧化二砷在类风湿关节炎治疗中作用机制的探讨[J].中华风湿病学杂志,2006,10:393-397,450.
[4]Dominici M,Le Blanc K,Mueller I,et al.Minimal criteria for defining multipotent mesenchymal stromal cells.The International Society for Cellular Therapy position statement[J].Cytotherapy,2006,8:315-317.
[5]张志毅,梅轶芳,赵彦萍,等.三氧化二砷对胶原诱导关节炎大鼠及滑膜细胞的作用[J].中华内科杂志,2007,55:409-410.
[6]Naithani R,Mahapatra M,Kumar R,et al.Arsenic trioxide induced acute flare-up of rheumatoid arthritis in a patient with APL[J].Ann Hematol,2007,86:151-152.
[7]Yang MH,Wu FX,Xie CM,et al.Expression of CC chemokine ligand 5 in patients with rheumatoid arthritis and its correlation with disease activity and medication[J].Chin Med Sci J,2009,24:50-54.
[8]Coelho FM,Pinho V,Amaral FA,et al.The chemokine receptors CXCR1CXCR2 modulate antigen-induced arthritis by regulating adhesion of neutrophils to the synovial mierovaseulature[J].Arthritis Rheum,2008,58:2329-2337.
[9]王旭,任国诚.趋化因子RANTES的研究进展[J].科技信息,2011,28:34.
[10] Thomton S,Duwel LE,Boivin GP,et al.Association of the course of collagen-induced arthritis with distinct patterns of cytokine and chemokine mesenger RNA expresion[J].Arthritis Rheum,1999,42:1109-1118.
[11] 吴四海,楼跃,黄磊.单核细胞趋化蛋白-1的作用机制研究进展[J].中华临床医师杂志,2012,6:2773-2775.
[12] Yao TC,Kun ML,See LC,et al.RANTES and monocyte chemoanraetant protein as sensitive markers of disease activity ir,patients with juvenile rheumatoid arthritis:a six-year longitudinal study[J].Arthritis Rheum,2006,54:2585-2593.
[13] 冷红.趋化因子IP-10的研究进展[J].国际免疫学杂志,2006,29:241-244.
[14] 满斯亮,张丽丽,孙琳,等.趋化因子CXCL10(IP-10)CXCR3在类风湿关节炎发病中的作用及应用前景[J].中华老年多器官疾病杂志,2011,10:460-464.
[15] Kwak HB,Ha H,Kim HN,et al.Reciprocal cross-talk between RANKL and interferon-gamma-inducible protein 10 is responsible for bone-erosive experimental arthritis[J].Arthritis Rheum,2008,58:1332-1342.