自身免疫性疾病患者长期使用羟氯喹治疗的安全性
2015-04-08闫琳毅张海艇
闫琳毅,张海艇,林 玮,张 文
(中国医学科学院 北京协和医学院 北京协和医院风湿免疫科,北京 100730)
硫酸羟氯喹(hydroxychloroquine,HCQ)属抗疟药物,是风湿免疫性疾病的常用药物。该药的主要作用机制是通过抑制抗原呈递、抑制Toll样受体的活性等发挥免疫抑制作用;该药还有光线滤过、减轻炎性反应和减少血栓形成等作用。目前,HCQ已作为系统性红斑狼疮(systemic lupus erythematosus,SLE)的一线基础用药和类风湿关节炎(rheumatoid arthritis,RA)治疗中主要的改善病情抗风湿药。因HCQ的免疫抑制和抗炎作用,也应用于适应证以外的一些自身免疫性疾病,如干燥综合征、成人斯蒂尔病等[1]。随着HCQ的广泛应用,其安全性也备受关注。国外相关研究较多,但国内对于HCQ在风湿病治疗中的安全性报道较少,且主要关注该药眼的不良反应。本研究通过观察北京协和医院风湿免疫科门诊长期服用HCQ的患者,对其安全性进行探讨。
对象和方法
研究对象
2013年6月至2014年12月就诊于北京协和医院风湿免疫科一位专科医生门诊,口服HCQ累计时间超过6个月的风湿病患者,应用HCQ的商品名为纷乐(国产)和赛能(进口),口服剂量为200~400 mg/d。
研究方法
回顾性收集纳入患者临床资料,包括基本情况、实验室检查,以及部分患者的眼科检查结果。所有患者均进行HCQ安全性问卷调查,分别从眼、皮肤、胃肠道、血液系统、中枢神经系统、神经肌肉及过敏反应等方面的不良反应进行统计分析。
统计学分析
采用SPSS 13.0软件进行统计分析。HCQ累计用量以(均数±标准差)表示。计数资料比较采用χ2检验,P<0.05为差异有统计学意义。
结 果
人口统计学
入组患者412例,男34例,女378例,年龄为11~79岁,平均年龄(35.11±11.43)岁。以第一诊断进行统计,其中SLE 229例,RA 43例,结缔组织病60例,干燥综合征51例,抗磷脂综合征7例,肌炎/皮肌炎8例,系统性硬化症6例,自身免疫性肝病3例,系统性血管炎2例,未分化关节炎3例。
用药情况
所有患者使用HCQ时间为6~161个月,平均用药时间(39.01±26.03)个月,其中6~12个月者43例(10.44%),>12个月者369例(89.56%)。HCQ累计剂量为36.2~1638 g,平均累计剂量(261.54±246.12) g。连续服药者340例(82.5%),间断服药者72例(17.5%)。15例患者妊娠期间服用HCQ。单独使用HCQ者20例,其他392例均为联合用药,联用药物包括糖皮质激素、甲氨蝶呤、环磷酰胺、吗替麦考酚、硫唑嘌呤、环孢霉素、他克莫司、沙利度胺、白芍总苷等。
不良反应
眼部:分别统计眼球调节反射障碍、角膜沉积和视网膜病变这3方面的眼部不良反应。在412例患者中,285例行眼科检查,7例出现眼部症状和(或)检查异常。其中2/412例(0.48%)(HCQ累计剂量分别为36.2、96 g)发生眼球调节反射障碍,表现为复视,症状均发生于从0.2 g/d增加剂量至0.4 g/d后,其中1例(0.24%)未行眼科检查,停药后恢复;另1例眼底检查未见异常,停药后恢复。1例(0.24%)(HCQ累计剂量为456 g)无症状,眼科检查发现双眼视野缺损(图1),停药后好转。4例(0.96%)出现眼底异常表现,其中2例(0.48%)(HCQ累计剂量分别是294、540 g)因视力模糊,眼底检查可疑黄斑病变;另有2例(0.48%)明确黄斑病变(图2),其中1例(0.24%)(HCQ累计剂量为684 g)眼底检查左眼部可见黄斑细小色素斑点;1例(0.24%)(HCQ累计剂量为1 350 g)左眼颞上方出现“牛眼征”,呈圆形黑色斑块,表面结晶样沉积。无角膜受累患者。
皮肤:9例(9/412,2.18%)患者出现皮肤不良反应,HCQ累计剂量(238.04±178.52) g(90~462 g)。其中,2例(2/412,0.48%)患者(累计剂量分别为90、462 g)出现皮肤色素沉着,2例(2/412,0.48%)患者(累计剂量分别为60、132 g)出现头发变白。5例(1.21%)患者(累计剂量为72~251 g)脱发明显。
消化系统:6例(6/412,1.46%)累计药量分别为102~144 g的患者出现恶心、反酸、腹胀、胃部不适等胃肠道症状。1例患者服药7个月时丙氨酸转氨酶升高(108 U/L),停药后好转。
肌肉:1例(0.24%)累计药量156 g的患者有肌肉酸痛,停药后缓解。
过敏反应:1例累计药量60 g的患者出现皮疹、瘙痒,排除其他可能因素,考虑为HCQ过敏反应,停药后症状消失。
血液系统、中枢神经系统、心血管系统等未见受累。
妊娠安全性
15例患者在妊娠期间服用HCQ,7例完善了眼底检查,均未见异常,累计剂量为(298.80±225.47) g(48~834 g),其中1例累计剂量为216 g者自觉眼部分泌物增多但可耐受。15例合并妊娠者均未发生皮肤、消化、神经、血液、心血管系统等不良反应,均未发生过敏反应。15例新生儿均未发生出生缺陷。
讨 论
HCQ属抗疟药,近年来被广泛用于风湿免疫病,如SLE、RA等诱导缓解期和维持期的治疗,且许多患者需要长期使用,因此该药的长期不良反应,特别是眼部的不良反应值得关注。检索数据库,共发现9篇文献[2-10]报道了HCQ相关不良反应(表1)。根据药物说明书,国内外报道抗疟药的主要不良反应包括眼部(睫状体调节障碍、视觉模糊、黄斑水肿、视网膜萎缩,异常色素沉着、视野缺损)、中枢神经系统(兴奋、情绪改变、头痛、眩晕)、神经肌肉(眼外肌麻痹、骨骼肌软弱)、皮肤(头发变白、脱发、瘙痒症、皮损)、胃肠道(厌食、腹泻、腹部痉挛、肝功能异常)、过敏反应等,血液系统不良反罕见,如白细胞减少、贫血、血小板减少。绝大多数的不良反应可自行缓解或于减量后消失,在出现不良反应的患者中仅有7%~30%需停药。抗疟药的不良反应与每日的最大剂量呈相关性。小剂量(0.5 g)与大剂量(>0.5 g)比较,疗效无明显下降而不良反应明显减少[11]。国外最新的研究表明,抗疟药是相当安全的,较其他慢作用抗风湿药如注射或口服金制剂、青霉胺、硫唑嘌呤和环孢素的毒性小,甚至较许多非甾体抗炎药的毒性小[12]。
HCQ不良反应中最重要的是对视觉的影响,可发生视网膜色素沉着变化和视野缺损,该不良反应发生率低,早期停用可逆,如进一步发展,即使停用也有加重的危险。视网膜病变早期可能没有症状,或伴有旁中心暗点,中心周围环状缺损,颞侧缺损和异常色觉,其中牛眼征为其特征性改变。角膜变化的报道包括角膜水肿和浑浊,可无自觉症状或暂时视力模糊或停药后逆转。美国研究显示,30年间按推荐剂量服用(6.5 mg·kg-1·d-1),只有4例的视网膜病变与HCQ有关,提示HCQ具有良好的眼部安全性[13]。一项回顾性研究的526例患者,可逆性羟氯喹视网膜病变的发生率是0.38%,400例服用羟氯喹超过6年的患者的视网膜病变发生率是0.5%[3]。羟氯喹所致视网膜病变的文献分析,共有患者5 210例纳入研究,其中25例患者有视网膜病变,发生率0.48%[14]。在前瞻性研究和回顾性研究中,视网膜病变的发生率分别为0.43%(11/2 549)和0.53%(14/2 661)[15-19]。也有文献提出,长期使用低剂量的羟氯喹在眼科方面是安全的,在维持每日最高剂量400mg时,即使服了大量累积量,毒性反应也罕有发生[20]。表明羟氯喹(200~400 mg/d)具有良好的眼部安全性。新的资料显示,HCQ使用5~7年或累积使用1 000 g,眼毒性有上升趋势。美国眼科协会推荐,将服用HCQ或氯喹的患者眼部毒性分为低危组,即服用时间<5年,且HCQ剂最<6.5 mg/(kg·d),高危组即服用时间>5年、服用剂量大或有其他危险因素,如身体脂肪含量高、伴随肾脏或肝脏疾病、伴随视网膜疾病或年龄>60岁。所有患者服药1年内均应进行基线检查,前5年可以最短6个月随访1次,也可根据年龄、肝肾功能、体重、是否伴有视网膜疾病、治疗时间和累积剂量延长随访时间,无风险者可不查。5年以后建议每年随访1次。
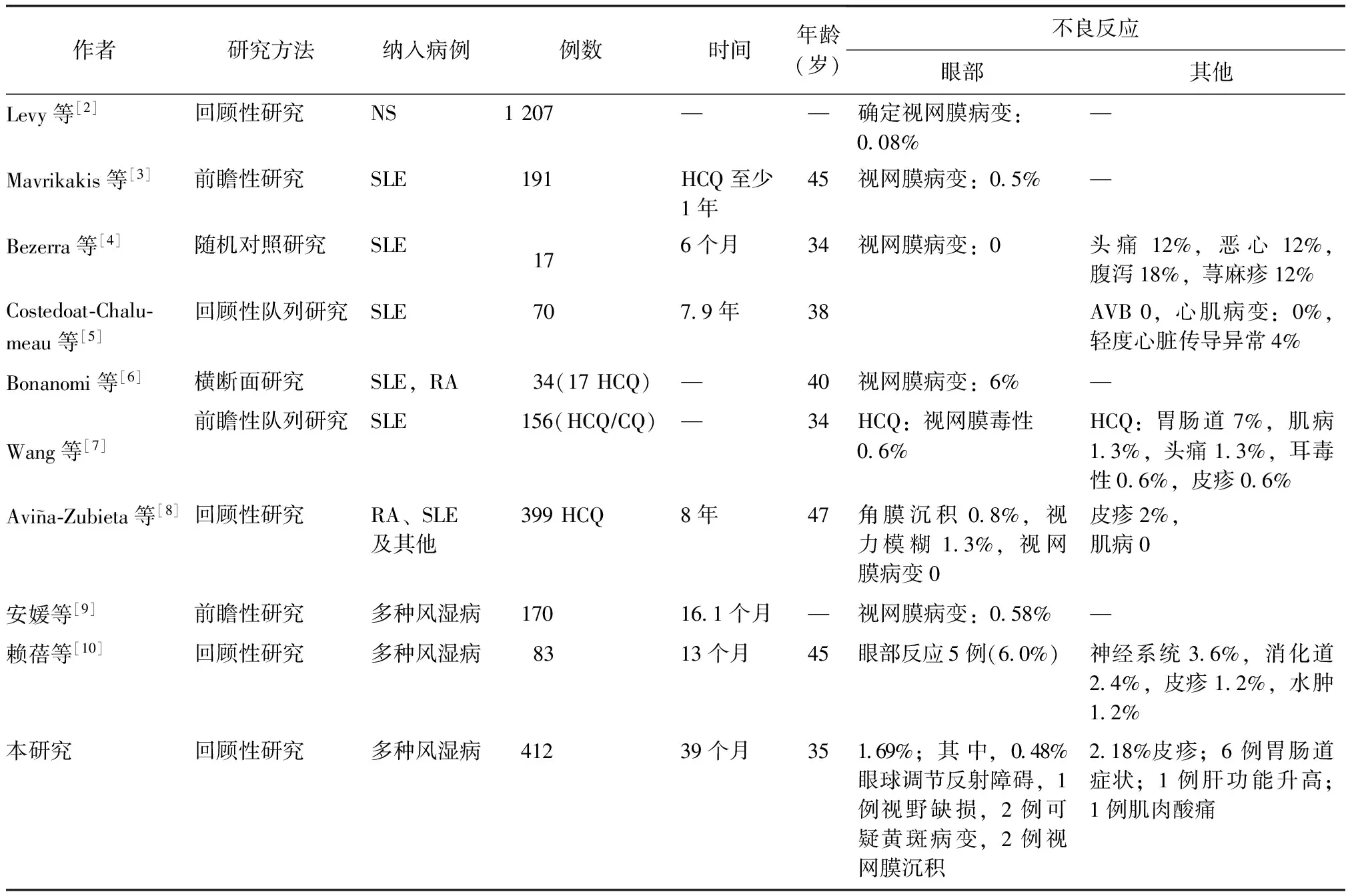
表1 羟氯喹不良反应国内外研究对比
RA:类风湿关节炎;SLE:系统性红斑狼疮;HCQ:羟氯喹;—:未涉及
本研究发现,长期使用HCQ的患者中0.48%发生眼球调节反射障碍,HCQ累计剂量为36.2~96 g。0.24%患者出现视野缺损,0.96%患者出现眼底异常表现或黄斑病变,上述视野缺损和眼底病变的患者HCQ的累计总量在294 g至1 350 g之间。结果与国外相似,HCQ的眼部不良反应发生率较低。
HCQ对皮肤的影响有皮疹、瘙痒症,皮肤黏膜色素变化,头发变白和脱发均有报道,停药后可恢复。HCQ可能造成神经肌肉的病变,包括有进行性无力,近端肌群萎缩的骨骼肌疾病或神经肌病的报道,停药后肌病恢复缓慢。本研究发现共9例患者出现皮肤不良反应,包括色素沉着、头发变白和脱发。其他系统不良反应包括:6例胃肠道症状;1例肝功能升高;1例肌肉酸痛。上述症状均于停药后消失。HCQ对中枢神经系统的影响可有头痛头晕、耳鸣、听力缺失、神经过敏和情绪不稳,甚至自杀行为。对心血管系统的影响罕有报道。对血液系统的影响,贫血、粒细胞缺乏、白细胞减少、血小板减少曾有报道,而骨髓抑制罕有报道。本文纳入研究的患者中枢神经系统、神经肌肉、血液系统受累均无一例发生。对肝脏的影响,有肝功能检测异常、暴发肝衰竭的个案报道,以上临床观察仅有1例出现ALT升高的不良反应,保肝治疗后ALT恢复正常。过敏反应有荨麻疹、血管性水肿和支气管痉挛均有报道,本文仅有1例发生过敏反应。需要说明的是,纳入本次临床观察的患者均服药超过6个月,而通常HCQ导致的过敏反应出现于短期服药阶段,因此服药后即出现过敏而停药的患者未纳入本研究。
本研究为回顾性研究,存在一定的局限性和不足之处:(1)纳入患者口服的HCQ,国内应用纷乐(国产)和赛能(进口)2种,2013年前开始治疗的患者绝大多数服用纷乐,2013年后患者部分服用纷乐,部分服用赛能,由于地域原因,部分患者不能长期口服同一品牌的HCQ,故本研究无法比较纷乐与赛能不良反应发生率的异同。(2)由于许多患者联合使用其他药物治疗,对于长期服用HCQ患者不能完全排除HCQ以外药物所致不良反应。为最大程度减少可能的参杂因素,本研究在调查问卷时已经尽可能询问其他药物的使用情况和耐受情况,基本排除联合药物的影响。
综上所述,本临床观察表明,HCQ是一种安全性和耐受性较好的慢作用抗风湿药物。长期服药仅少数患者发生眼部、皮肤、肌肉、胃肠道等不良反应。建议临床医务工作者,对长期服用患者应按照国际和国内的指南监测药物不良反应。
(本文图1、2见插页Ⅱ)
[1]张江林,黄烽.羟氯喹的药理作用及在风湿性疾病中的应用[J].解放军药学学报,2000,16:85-88.
[2]Lzvy GD,Munz SJ,Pmschal J.Incidence of hydmxychloroquine retinopathy in 1207 patients in a large multieenter outpatient practice[J].Arthritis Rheum,1997,40:1482-1486.
[3]Mavrikakis I,Sfikakis PP,Mavrikakis E.The incidence of irreversible retinal toxicity in patients treated with hydroxychloroquine:a reappraisal[J].Ophthalmology,2003,110:1321-1326.
[4]Bezerra E,Vilar M,da Trindade Neto P.Double-blind,randomized,controlled clinical trial of clofazimine compared with chloroquine in patients with systemic lupus erythematosus[J].Arthritis Rheum.2005,52:3073-3078.
[5]Costedoat-Chalumeau N,Hulot J,Amoura Z.Heart conduction disorders related to antimalarials toxicity:an analysis of electrocardiograms in 85 patients treated with hydroxychloroquine for connective tissue diseases[J].Rheumatology (Oxford),2007,46:808-810.
[6]Bonanomi M,Dantas N,Medeiros F.Retinal nerve fibre layer thickness measurements in patients using chloroquine[J].Clin Exp Ophthalmol,2006,34:130-136.
[7]Wang C,Fortin P,Li Y.Discontinuation of antimalarial drugs in systemic lupus erythematosus[J].Rheumatol,1999,26:808-815.
[9]安媛,何燕玲,贾园.长期应用羟氯喹治疗风湿免疫病眼部安全性的前瞻性研究[J].中华风湿病学杂志,2009,13:178-180.
[10] 赖蓓,张春媚,夏群.羟氯喹在风湿病治疗中眼部不良反应的初步调查[J].药物不良反应杂志2008,10:177-179.
[11] 张江林,黄烽.磷酸氯喹在风湿病治疗中的安全性[J].药物与临床,2002,17:66-68.
[12] Fries JF,Williams CA,Ramey D.The relative toxicity of disease-modifying antirheumatic drugs[J].Arthritis Rheum,1993,36:297-306.
[13] 史群,赵岩,李玲.羟氯喹治疗原发性干燥综合征前瞻性临床研究初探[J].中华风湿病学杂志,2008,12:258-260.
[14] 李春,刘恩生,穆荣,等.羟氯喹所致视网膜病变的文献分析[J].药物不良反应杂志,2010,12:21-25.
[15] Finbloom DS,Silver K,Newsome DA.Comparison of hydroxychloroquine and chloroquine use and the development of retinal toxicity[J].J Rheumatol,1985,12:692-694.
[16] Avina-Zubieta JA,Galindo-Rodriguez G,Newman S.Long-term effectiveness of anti- malarial drugs in rheumatic diseases[J].Ann Rheum Dis,1998,57:582-587.
[17] Wang C,Fortin PR,Li Y.Discontinuation of anti.malarial drugs in systemic lupus erythematosus[J].Rheumatol,1999,26:808-815.
[18] Mavrikakis I,Sfikakis PP,Mavrikakis E.The incidence of irreversible retinal toxicity in patients treated with hydroxyehloroquine:a reappraisal[J].Ophthalmology,2003,110:1321-1326.
[19] Elder M,Rahman AM,McLay J.Early paracentral visual field loss in patients taking hydroxychloroquine[J].Arch Ophthalmol,2006,124:1729-1733.
[20] Ingster-Moati I,Crochet M,Albuisson E.Electrore-tinogram “b” wave varies with the posology of the antimalarial treatment[J].J Fr Ophtalmol,2004,27:1007-1012.