干旱胁迫对彩叶草光合特性及叶片超微结构的影响
2015-04-02孟力力
孟力力, 张 俊, 闻 婧
(1.江苏省农业科学院园艺研究所,江苏 南京210014;2.江苏省农业科学院蔬菜研究所,江苏 南京210014)
彩叶草(Coleus blumei)原产于印度尼西亚,为唇形科鞘蕊花属多年生草本植物,叶对生,卵圆形,叶色丰富,花期夏秋季,圆锥花序,淡蓝或带白色,观赏价值高[1-2]。彩叶草具有消毒杀菌作用[2],可改善环境,是城市园林绿化中常用的观叶植物。
干旱是影响植物生长发育的重要环境因子之一,其危害程度在诸多非生物胁迫中占首位[4-6]。干旱胁迫可引起叶片气孔关闭、细胞失水[7-8],破坏植物体内的水分代谢[9],使Rubisco 降解和Calvin 循环中酶活性下降[10],导致光合器官损伤,从而抑制光合作用[11-12]。遭遇干旱胁迫后,华山新麦草[13]、黄栌[14]、丹参[15]的净光合速率下降;薄壳山核桃[16]和绢毛委陵菜[17]的细胞结构被破坏,叶绿体破坏溶解;大麦[18]的线粒体外形及膜受到破坏,内嵴部分消失。
彩叶草生长茂盛,需要较多水分,持续干旱下,彩叶草叶片萎蔫,基部叶片加速老化,严重影响其生长和观赏价值。因此本研究拟采用盆栽种植方法,模拟不同程度的土壤水分状况,研究干旱胁迫对彩叶草光合生理特性和细胞超微结构的影响,探索其对干旱环境的适应机理,为彩叶草的栽培应用及抗性品种选育提供科学依据。
1 材料与方法
1.1 试验材料
供试材料为彩叶草(C. blumei)品种红色天鹅绒,产自美国。
1.2 试验设计
试验于2013 年4 ~7 月江苏省农业科学院观光农业研究中心智能温室进行。4 月播种育苗,5 月中旬选取生长健壮、长势一致的幼苗移栽到塑料花盆中,塑料盆下直径18 cm,上直径28 cm,高26 cm,每盆装基质(泥炭土∶ 黄土∶ 珍珠岩=2∶ 2∶ 1)5 kg。每盆栽种1 株,常规栽培管理。1 个月后开始进行干旱处理。2013 年6 月初进行干旱胁迫,每盆充分灌溉,土壤水分自然消耗。试验共设4 个土壤水分处理:(1)对照,土壤水分含量为田间最大持水量的75% ~80%;(2)轻度胁迫,土壤水分含量为田间最大持水量的60% ~65%;(3)中度胁迫,土壤水分含量为田间最大持水量的45% ~50%;(4)重度胁迫,土壤水分含量为田间最大持水量的30% ~35%。每处理10 盆,每盆1 株。每天18∶ 00用称重法补充消耗水分。胁迫持续20 d 后进行各项指标测定。
1.3 测定指标和方法
1.3.1 彩叶草生长指标的测定 各处理随机选取3 株,测量株高和茎的最大直径,便携式叶面积仪YMJ-A(浙江托普仪器有限公司)测量最大叶面积。每个指标测定3 次取其平均值。
1.3.2 光强-光合响应曲线的测定 每个处理随机选取3 株,每株取2 片健壮的成熟叶片,试验当天将要测定的彩叶草提前1 h 时放到光下进行充分光适应。采用CIRAS-2 便携式光合记录仪(美国PP Systems 公司)测定。CO2由钢瓶供气,浓度设置为380 μmol/mol,大气温度为25 ~30 ℃,相对湿度为65% ±5%,采用人工LED 光源控制光合有效辐射强度(PAR)分别为1 600 μmol/(m2·s)、1 400 μmol/(m2·s)、1 200 μmol/(m2·s)、1 000 μmol/(m2·s)、 800 μmol/(m2·s)、 600 μmol/(m2·s)、 400 μmol/(m2·s)、 300 μmol/(m2·s)、 200 μmol/(m2·s)、 150 μmol/(m2·s)、 100 μmol/(m2·s)、 50 μmol/(m2·s)、0 μmol/(m2·s)13 个梯度下,每个光强梯度下测定2 min。利用光合仪自动记录如下气体交换参数:净光合速率(Pn)、气孔导度(Gs)、胞间二氧化碳浓度(Ci)、蒸腾速率(Tr)等,并计算气孔限制值Ls(Ls=1 -Ci/Cr,其中Cr为大气CO2浓 度)[19]和 水 分 利 用 效 率WUE(WUE = Pn/Tr[20])。绘制光强-光合响应曲线,求得光饱和点(LSP),并对曲线的初始部分进行线性回归,求得光补偿点(LCP)和表观光量子效率(AQY)。采用Duncan 检验法对各处理间的差异显著性在5%水平上进行检验。
1.3.3 叶片细胞透射电镜观察 取对照组和处理组相同部位叶龄一致的叶片,避开主脉,用双面锋利刀片切割成1 mm×2 mm 大小,迅速投入到4%戊二醛溶液中,利用针筒反复抽气使叶片沉入底部,固定24 h 后,用0.1 mol/L的磷酸缓冲液冲洗3 次,每次15 min。再用1%锇酸固定3 h,去离子水漂洗3 次,每次15 min。丙酮脱水20 min,再用环氧树脂包埋、聚合、切片、染色,在HitachiH-7650 透射电子显微镜(日立高新技术公司)下观察并照相。
2 结果
2.1 干旱胁迫对彩叶草生长指标的影响
由表1 可以看出,轻度胁迫对彩叶草的生长影响较小,与对照相比差异未达到显著水平;彩叶草株高、茎粗和最大叶面积均随着干旱胁迫程度的加深呈现显著下降趋势(P <0.05),中度、重度胁迫后彩叶草的株高、茎粗和最大叶面积分别比对照下降26.25%、39.84%、30.77%和50.76%、39.04%、56.94%。
2.2 干旱胁迫对彩叶草气体交换参数的影响
干旱影响植物的首要环节便是光合作用。干旱对彩叶草气体交换参数的影响如表2 所示,随着干旱胁迫程度的加深,Pn、Gs、Tr均呈下降趋势,在中度、重度胁迫下达到显著水平(P <0.05)。重度胁迫下的Pn为2. 67 μmol/(m2·s),仅为对照的29.12%。轻度和中度胁迫下的彩叶草WUE 升高,重度胁迫下则降低。由于重度胁迫下的彩叶草Pn降低趋势大于Tr,Ci呈现先降后升趋势。在轻度和中度胁迫下,彩叶草Ci降低,Ls升高,推测Pn降低的主要原因是气孔限制;而在重度胁迫下,Ci升高,Ls降低,推测Pn降低的主要原因是非气孔限制。

表1 干旱胁迫下彩叶草生长指标的变化Table 1 Growth parameters of Coleus blumei under drought stress

表2 不同水分处理对彩叶草叶片气体交换参数的影响Table 2 Effect of drought stress on gas-exchange parameters in C. blumei
2.3 干旱胁迫对彩叶草叶片光强-光合响应曲线的影响
利用光强-光合响应曲线可对干旱胁迫下彩叶草的光合作用状态作进一步分析。由图1 可见,在土壤水分轻度和中度胁迫下,彩叶草叶片光合速率的光响应过程与对照基本相同,即在有效辐射强度PAR <800 时,Pn随着PAR 的增强而明显升高,尤其在PAR<200 的范围内基本呈直线增加;当PAR≥800 时,对照的Pn随着PAR 的增强呈缓慢增加趋势,干旱胁迫的Pn则呈下降趋势。土壤干旱胁迫越严重,彩叶草叶片的Pn越低,PAR 为1 000 μmol/(m2·s)时,轻度、中度、重度胁迫3 个处理下的Pn分别比对照降低了15.16%、40.52%、74.71%,表明土壤干旱胁迫加剧导致彩叶草叶片光合生产力明显下降。
表3 为通过对光强响应曲线进行直线回归求得的干旱胁迫下的光合参数。可以看出,随着土壤干旱胁迫加剧,光补偿点LCP 呈升高趋势,在中度胁迫时与对照差异达到显著水平(P <0.05);光饱和点LSP 随着干旱胁迫加剧而逐渐降低,各处理之间及处理与对照间的差异均达到显著水平(P <0.05);最大光合速率Pmax呈下降趋势,各处理之间及处理与对照间达到显著水平(P <0.05)。表观光量子效率AQY 下降,各处理之间及处理与对照间达到显著水平(P <0.05)。与对照相比,3 种干旱胁迫处理下的LCP 分别增加33.24%、70.74%和113.92%,LSP 分别降低17.50%、41.59%和65.26%,Pmax分别降低19.72%、46.34% 和78.02%,AQY 分别降低15.16%、40.52%和74.71%。
2.4 干旱胁迫对彩叶草叶片细胞超微结构的影响

图1 彩叶草叶片净光合速率的光响应过程Fig.1 Light response of net photosynthetic rate (Pn)for C. blumei leaves

表3 干旱胁迫下彩叶草叶片光强-光合响应曲线参数值的变化Table 3 Changes of parameters of light response of C. blumei leaves under drought stress
正常水分供应下,彩叶草叶片的叶肉细胞饱满,细胞壁圆滑,叶绿体呈现椭圆形,结构规则,紧贴细胞壁;基粒类囊体小,基质片层整齐;淀粉粒大小均匀,呈现蚕蛹型,边缘清晰;线粒体内嵴小而少,细胞质浓(图2A、2B、2C)。轻度干旱胁迫下,叶肉细胞较饱满,个别叶绿体部分脱离细胞壁,绝大多数仍靠细胞壁,细胞壁稍厚;基粒类囊体部分膨胀,基质片层略扭曲,局部结构变模糊,出现点状嗜锇颗粒;淀粉粒变化不大;部分线粒体内嵴模糊、细胞质变浅(图2D、2E、2F)。中度干旱胁迫下,叶肉细胞出现质壁分离,内膜清楚但外膜变模糊,细胞壁增厚;基粒类囊体变少,大小不均匀,基质片层明显扭曲,分布不均匀,部分模糊;淀粉粒变形,部分边缘模糊,嗜锇颗粒增多;线粒体内嵴和外膜模糊(图2G、2H、2I)。重度干旱胁迫下,叶绿体膜部分断裂,叶绿体结构溶解;基粒类囊体减少,部分消失,基质片层模糊消失;淀粉粒畸形,边缘模糊,出现大量嗜锇颗粒;线粒体膨大部分破裂,内含物流出(图2J、2K、2L)。
3 讨论
植株的整体生长状况是其对外界胁迫尤其是干旱胁迫的综合反映,也是评价胁迫程度和植株抗旱能力的重要指标[21]。本研究发现彩叶草叶片的生长指标株高、茎粗、最大叶面积对土壤中度、重度干旱胁迫比较敏感,土壤轻度干旱胁迫下变化不显著。
植物生长的关键生理活动为光合作用,其强弱可反映植物的生长势和抗旱性。已有研究表明,植株对周围环境因子的变化越敏感,植株细胞超微结构的变化越明显、越剧烈[22]。作为细胞内承担能量转换代谢的细胞器,叶绿体和线粒体的状态可表示新陈代谢的程度[23]。本研究中,随着干旱胁迫程度的加深,彩叶草叶肉细胞中的叶绿体和线粒体的超微结构均发生变化,同时光合生理指标也相应变化。轻度和中度胁迫下,叶绿体基粒片层和基质片层部分扭曲、边缘略模糊,基质变稀,出现嗜锇颗粒,此时叶片气孔导度Ci、净光合速率Pn、蒸腾速率Tr显著下降,证明气孔关闭导致进入叶片的CO2减少,影响植株的光合作用。因此气孔限制是造成光合下降的主要原因。重度胁迫下,叶绿体部分消失,出现大量嗜锇颗粒,此时气孔导度Ci上升,气孔限制值Ls下降,光合速率降低原因由气孔限制为主变为非气孔限制为主;叶绿体结构受到破坏引起光抑制或光破坏[24-25]。这与前人对银水牛果[26]、华山新麦草[13]和绢毛委陵菜[27]的研究结论一致。
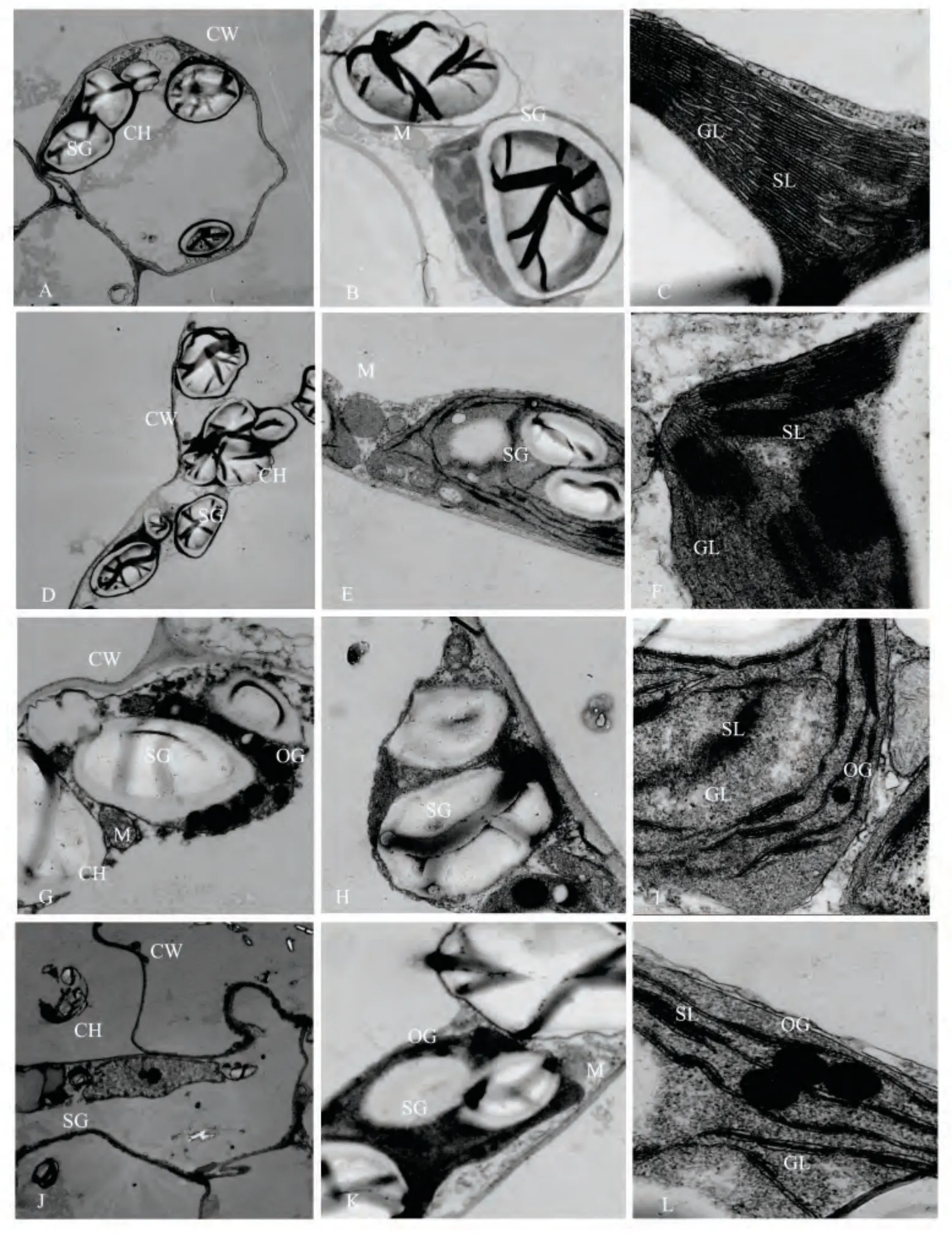
图2 干旱对彩叶草叶片细胞超微结构的影响Fig.2 Effects of drought stress on cell ultra-structure of C. blumei leaves
光补偿点LCP 作为反映植物需光特性的指标之一,可以表征光合作用对弱光利用程度的高低,即光补偿点越高,意味着植物光合作用对弱光的利用程度越低[14]。随着土壤干旱胁迫程度的加深,彩叶草光合作用的LCP 显著增加,降低了光合作用对弱光的利用程度。光饱和点LSP 可反映植物对强光的适应能力[28],即光饱和点越高,植物对强光的适应越好。随着土壤干旱胁迫程度的加深,彩叶草光合作用的LSP 显著下降,表明强光下产生了光抑制。光量子效率AQY 是反映植物光合作用对弱光的吸收和转化利用效率的指标[29]。本研究中,彩叶草的AQY 随着干旱胁迫程度的加深呈下降趋势,表明彩叶草光合作用对弱光的光能吸收和转换利用效率减弱,而且随着干旱胁迫程度的加深而降低明显。随着干旱胁迫程度的加深,光补偿点升高,光饱和点、最大净光合速率和表观量子效率下降,光抑制现象加重。
综上所述,适度的干旱胁迫可以提高叶片水分利用效率,从效益最大化的角度来说,彩叶草适宜的土壤水分应在轻度胁迫(土壤含水量为60% ~65%)范围。彩叶草的正常光饱和点LSP 在1 100 μmol/(m2·s)左右,而在夏天晴天的光合有效辐射大多在1 600 μmol/(m2·s)以上,远超过其饱和点,所以可适当遮阴或将彩叶草栽培于稀疏的林下,以减轻光抑制,降低叶片温度和蒸腾速率,从而提高光合速率和水分利用效率。
[1] 韦金河,孟力力,闻 婧,等. 氮磷钾配方施肥对彩叶草生长发育的影响[J]. 江苏农业学报,2013,28(6):1398-1402.
[2] 周厚高,游天建,王文通,等. 彩叶草的品种分类与园林应用[J]. 广东园林,2011(3):57-61.
[3] 刘 洋,王 飞,田治国,等. 8 种园林草本植物挥发性物质的抑菌效果研究[J]. 西北农林科技大学学报:自然科学版,2009,37(3):141-145.
[4] 靳 容,张爱君,史新敏,等. 干旱胁迫下钾对甘薯幼苗光合特性及根系活力的影响[J]. 江苏农业学报,2014,30(5):992-996.
[5] 李 鹏,刘济明,颜 强,等.干旱胁迫对小蓬竹繁殖和某些生理特性的影响[J].江苏农业科学,2014,42(8):181-184.
[6] 王华华,黄俊骏,杨丽丹. 大豆幼苗中抗坏血酸和谷胱甘肽对干旱胁迫的生理响应[J].江苏农业科学,2014,42(5):86-88.
[7] CORNIC G. Drought stress inhibits photosynthesis by decreasing stomatal aperture——not by affecting ATP synthesis[J]. Trends in Plant Science,2000,5(5):187-188.
[8] SHANGGUAN Z P,SHAO M A,DYCKMANS J. Nitrogen nutrition and water stress effects on leaf photosynthetic gas exchange and water use efficiency in winter wheat[J]. Environmental and Experimental Botany,2000,44(2):141-149.
[9] RANJBARFORDOEI A,SAMSON R,LEMEUR R,et al. Effects of osmotic drought stress induced by a combination of NaCl and polyethylene glycol on leaf water status,photosynthetic gas exchange,and water use efficiency of Pistacia khinjuk and P. mutica[J]. Photosynthetica,2002,40(2):165-169.
[10] FLEXAS J,MEDRANO H. Drought inhibition of photosynthesis in C3 plants:stomatal and non-stomatal limitation revisited[J]. Annals of Botany,2002,89:183-189.
[11] 徐大全. 光合作用气孔限制分析中的一些问题[J].植物生理学通讯,1997,33(4):241.
[12] GUO W,LI B,HUANG Y,et al. Effects of different water stresses on eco-physiological characteristics of Hippophae rhamnoides seedlings[J]. Acta Botanica Sinica,2002,45(10):1238-1244.
[13] 李 倩,王 明,王雯雯,等. 华山新麦草光合特性对干旱胁迫的响应[J]. 生态学报,2012,32(13):4278-4284.
[14] 刘 刚,张光灿,刘 霞. 土壤干旱胁迫对黄栌叶片光合作用的影响[J]. 应用生态学报,2010 (7):1697-1701.
[15] 罗明华,胡进耀,吴庆贵,等. 干旱胁迫对丹参叶片气体交换和叶绿素荧光参数的影响[J]. 应用生态学报,2010,21(3):619-623.
[16] 刘广勤,朱海军,周蓓蓓,等. 旱涝胁迫对薄壳山核桃光合特性和叶绿体超微结构的影响[J]. 江苏农业学报,2013,28(6):1429-1433.
[17] 吴建慧,郭 瑶,崔艳桃. 水分胁迫对绢毛委陵菜叶绿体超微结构及光合生理因子的影响[J]. 草业科学,2012,29(3):434-439.
[18] 陈健辉,李荣华,郭培国,等. 干旱胁迫对不同耐旱性大麦品种叶片超微结构的影响[J]. 植物学报,2011,46(1):28-36.
[19] BERRY J A,DOWNTON W J S. Environmental regulation of photosynthesis[J]. Photosynthesis,1982,2:263-343.
[20] NIJS I,FERRIS R,BLUM H,et al. Stomatal regulation in a changing climate:a field study using free air temperature increase(FATI)and free air CO2 enrichment (FACE)[J]. Plant,Cell &Environment,1997,20(8):1041-1050.
[21] LEVITT J. Responses of plants to environmental stresses. Volume II. Water,radiation,salt,and other stresses[M]. New York:Academic Press,1980:607.
[22] KRATSCH H A,WISE R R. The ultrastructure of chilling stress[J]. Plant,Cell & Environment,2000,23(4):337-350.
[23] SIMOVA-STOILOVA L,VASEVA I,GRIGOROVA B,et al.Proteolytic activity and cysteine protease expression in wheat leaves under severe soil drought and recovery[J]. Plant Physiology and Biochemistry,2010,48(2):200-206.
[24] FARQUHAR G D,SHARKEY T D. Stomatal conductance and photosynthesis[J]. Annual Review of Plant Physiology,1982,33(1):317-345.
[25] AKHKHA A,BOUTRAA T,ALHEJELY A. The rates of photosynthesis,chlorophyll content,dark respiration,proline and abscicic acid (ABA)in wheat (Triticum durum)under water deficit conditions[J]. International Journal of Agriculture and Biology,2011,13(2):215-221.
[26] 陈 静,秦 景,贺康宁,等. 水分胁迫对银水牛果生长及光合气体交换参数的影响[J]. 西北植物学报,2009,29(8):1649-1655.
[27] 吴建慧,郭 瑶,崔艳桃. 自然失水胁迫对绢毛委陵菜叶片超微结构的影响[J]. 东北林业大学学报,2011,39(11):53-55.
[28] 张其德,卢从明,匡廷云. 大气CO2浓度升高对光合作用的影响[J]. 植物学通报,1992,9(4):18-23.
[29] LLUSÍÀ J,PÑUELAS J,MUNNÉ-BOSCH S. Sustained accumulation of methyl salicylate alters antioxidant protection and reduces tolerance of holm oak to heat stress[J]. Physiologia Plantarum,2005,124(3):353-361.
