马铃薯StPYL1 和StPYL8 基因的分子克隆与表达分析
2015-04-02徐玉伟印敬明
徐玉伟, 印敬明, 白 潇, 史 珂, 杨 清
(南京农业大学生命科学学院,江苏 南京210095)
植物激素脱落酸(Abscisic acid,ABA)参与了多个植物生长发育过程,如促进叶、花、果脱落,侧芽生长,块茎休眠以及叶片衰老,抑制种子发芽,植株生长等[1]。作为“胁迫激素”,ABA 在植物应对生物胁迫与非生物胁迫过程中也起着关键作用[2-3]。在干旱和高盐胁迫下,植物体内ABA 的含量迅速增加,调节气孔关闭,减少蒸腾,保护光合作用,并调控大量相关基因的表达[4-5]。
ABA 信号转导是一个复杂的生物学过程,ABA 受体是ABA 信号通路最上游的信号调节因子,承担着识别ABA 信号和启动信号转导原初过程的使命[6]。在过去的研究中,一共发现了4 种ABA 受体,最先报道的是从蚕豆和拟南芥中分离的叶绿体蛋白ABAR/CHLH,该蛋白既是ABA 的受体(ABAR),同时也是镁螯合酶H 亚基(CHLH),参与叶绿素的合成和质体-核反向信号传导[7-8]。WRKY 类转录因子负调控ABA 信号,它能够抑制ABI5 等响应ABA 的基因在细胞中正常表达[9]。ABAR 通过下调WRKY 类转录因子的表达,消除其对ABI5 等基因的抑制作用,向下释放ABA 信号,但缺少其能与ABA 直接结合的结构证据[10]。第二种G 蛋白偶联受体GCR2,GCR2 是ABA 在细胞膜上的一种受体[11]。对将该蛋白定义为G 蛋白偶联受体及它在种子发芽和幼苗形态建成过程ABA 信号转导中的作用一直存有争议[1]。第三种G 蛋白偶联受体GTG1 和GTG2,是位于细胞膜上的一类ABA 受体,最近的药理学和遗传学证据表明GTG1 和GTG2 确实参与了ABA 信号转导[12]。尽管上述三种蛋白都被认为是ABA 受体,并在ABA 信号转导过程中起着重要作用,但是它们在生理和分子上与重要的信号转导因子如PP2C 和SnRK2 等之间的联系是不清楚的。2009年,Ma 和Park 两个独立的研究小组分别利用酵母双杂交和筛选突变体方法在拟南芥中筛选出一种新的ABA受体 PYR/PYLs/RCARs (Pyrabactin Resistance/Pyrabactin Resistance Likes,PYR/ PYLs,Regulatory Components of ABA Receptors,RCARs,后 面 统 称PYLs)蛋白[13-14]。在这种新发现的ABA 信号转导途径中有3 种核心组份:ABA 受体PYLs 蛋白、负调控因子2C 类蛋白磷酸酶PP2Cs(Type 2C protein phosphatases)和正调控因子SNF1 相关的蛋白激酶2 SnRK2s (Subfamily 2 of SNF1-related kinases),三者共同组成了一个双重负调控系统[13-15]。PYL 是一类含有START(STAR-RELATED LIPID-TRANSFER)特征区域的蛋白质,并且具有此结构域的蛋白质都含有疏水性的配体结合区,并通过该区域与ABA 结合。PYL 与ABA 结合后可抑制PP2C 活性,以阻止PP2C 脱去SnRK2 上的磷酸基团[16-18]。然后,有活性的SnRK2 可磷酸化下游转录因子,如ABFs/AREBs 等,通过它们进一步激活ABA应答基因[19-20]。在拟南芥中PYL 蛋白家族有14 个成员,被命名为PYR1 和PYL1 ~PYL13,它们广泛地分布于细胞质和细胞核内。PYL 可以直接与ABA 结合,但是每个PYL 家族成员与ABA 结合的能力以及对ABA 立体构型的选择性却不完全相同[21]。
目前,对PYL 的研究主要集中在拟南芥、大豆等有限的几种植物及其结构特征上[13-15,18,22],在马铃薯上鲜有相关报道。本研究根据拟南芥与大豆PYL 序列信息及马铃薯基因组数据库信息设计引物,从马铃薯栽培品种Désirée 幼苗叶片中克隆PYL 基因cDNA,分析该基因的结构特征、亲源关系以及在外源ABA 处理及两种逆境下的表达模型。
1 材料与方法
1.1 材料与试剂
试验材料为马铃薯(Solanum tuberosum L.)栽培品种Désirée,由南京农业大学生命科学学院植物分子生物学实验室保存。
Trizol 试剂、PCR 相关试剂、M-MLV 反转录试剂盒、DNaseI 试剂盒及克隆载体pMD-19T 均购自TaKaRa 公司;凝胶回收试剂盒购自Axygen 公司;引物合成由上海英骏生物技术有限公司完成;大肠杆菌DH5a 为本实验室保存。
1.2 基因克隆
首先采用Trizol 法从组培苗中提取总RNA,参照DNaseI 试剂盒说明消除微量DNA 污染,用反转录试剂盒(PrimeScriptTM1st Strand cDNA Synthesis Kit)合成cDNA 第1 链,作为后续PCR 扩增模板。然后根据已有拟南芥(Arabidopsis thaliana)和大豆(Glycine max)PYL 基因序列,及马铃薯基因组数据库,分别设计出扩增StPYL1 和StPYL8 cDNA 全长序列引物:StPYL1-F(5'-CCTTCCTCTCTCTATTTCTT-3')、StPYL1-R (5'-TCACCTGTGACTTACATCAC-3')、StPYL8-F(5'-GGTTAAAAAGTTGGAAATTT-3')和StPYL8-R(5'-ACAGGATACACCATACACGC-3'),进行PCR 扩增,扩增程序为:94℃5 min;94 ℃40 s,50 ℃30 s,72 ℃50 s,30 个循环;72 ℃10 min。PCR 产物在1%琼脂糖凝胶中电泳,按凝胶回收试剂盒说明书回收目的片段,然后将其连接到pMD19-T 载体,热激法转化大肠杆菌DH5a,经蓝白斑筛选和PCR 检测,阳性克隆送华大基因公司进行测序。
1.3 生物信息学分析
序列同源性比对由NCBI 的BLAST 程序(http://www.ncbi. nlm. nih. gov/blast/)进行。开放阅读框架预测由NCBI 的ORF finder (http://www.ncbi.nih.gov/gorf/gorf.html)程序完成。蛋白质一级结构(等电点、分子量)的预测由ProtParam (http://www.expasy. org/tools/protparam. html)完成。蛋白质二级结构预测由PSIPRED v3.3 Predict Secondary Structure (http://bioinf. cs. ucl. ac. uk/psipred/)完成。蛋白质序列区域(domains)分析由InterProScan 4 (http://www. ebi. ac. uk/Tools/pfa/iprscan/)完成。蛋白质三级结构预测由Swiss Model Server (http://swissmodel.expasy.org/)完成。系统进化树由Clustalx1.83 和MEGA5. 0 程序构建,采用邻接法(Neighbor Joining Method)作图,重复计算次数设为1000。氨基酸序列比对和一致性分析使用DNAMAN 5.2 软件。系统进化树和蛋白质二级结构预测结果编辑由ESPript 3(http://espript. ibcp. fr/ESPript/cgi-bin/ESPript.cgi)完成。
1.4 基因的表达分析
基因组织表达分析使用大棚内生长材料。在生长期分别取其茎、叶,经液氮速冻后,在-70 ℃保存,用于不同组织中基因的表达分析。在采收期分别取马铃薯的起始匍匐茎、延伸匍匐茎、膨大匍匐茎、初始块茎,液氮速冻后,置于-70 ℃保存,用于块茎形成过程中的基因表达分析。
外源ABA 处理、盐胁迫处理、PEG 模拟干旱处理的材料均来自于用MS 液体培养基培养45 d 左右的组培苗。外源ABA 处理:用20 mmol/L的ABA 喷施后0 h、6 h、12 h、24 h、48 h 和72 h 取叶样。盐胁迫:用含有200 mmol/L NaCl 的MS 培养0 h、6 h、12 h、24 h、48 h 和72 h 后取叶样。PEG 模拟干旱处理:用含有30% PEG-6000 的MS 培养0 h、6 h、12 h、24 h、48 h 和72 h 后取叶样。
采用半定量RT-PCR 进行基因表达分析,内参基因为EF-1α,引物分别为EF-1α-F:5'-ATTCAAGTATGCCTGGGTGCT-3' 和 EF-1α-R:5'-GTGGTGGAGTCAATAATGAGGAC-3',PCR 条件为:94 ℃预变性5 min;94 ℃40 s,55 ℃20 s,72 ℃20 s,24 个循环;72 ℃10 min。利用引物StPYL1 R/F、StPYL8 R/F 进行半定量RT-PCR 分别检测基因StPYL1 和StPYL8 在马铃薯不同组织中的表达。PCR 扩增条件为94 ℃预变性5 min;94 ℃40 s,50 ℃30 s,72℃50 s,28 个循环;72 ℃10 min。PCR 产物经1%琼脂糖凝胶电泳检测。
2 结果
2.1 StPYL1 和StPYL8 的克隆及序列分析
以马铃薯cDNA 第一链为模板,用引物StPYL1 R/F;StPYL8 R/F 分别进行RT-PCR 扩增,得到两个大小约750 bp 片段(图1)。测序显示,StPYL1 和StPYL8 长度分别为718 bp 和738 bp,基因StPYL1的ORF 长度为696 bp,编码一个由231 个氨基酸残基组成的蛋白,该蛋白的分子量为25 280,理论等电点为5.12;StPYL8 基因的ORF 长度为561 bp,编码一个由186 个氨基酸残基组成的蛋白,该蛋白的分子量为20 790,理论等电点为6.30。利用在线工具PSIPRED v3.3 分析蛋白质二级结构,发现StPYL1蛋白含有3 个α 螺旋、3 个β 折叠,StPYL8 蛋白含有2 个α 螺旋、4 个β 折叠(图2)。InterProScan 4 分析发现,StPYL1 和StPYL8 蛋白都含有START-like 结构域(图3),利用基于同源建模的分析工具SWISSMODEL 进行3D 结构预测,在提交序列进行模板识别后,从蛋白数据库(PDB)中选择3nef.1. A 为模板,运用自动同源建模方式,通过X-射线晶体衍射比较发现,StPYL1 与拟南芥PYL1 基因编码ABA 受体蛋白3nef(AtPYL1)相似性为73.98%[18]。同样的方法,以3oqu.1.A 为模板建模,通过X-射线晶体衍射比较发现,StPYL8 与拟南芥PYL9 基因编码ABA 受体蛋白3oqu(AtPYLP)相似性为78.79%[22](图4)。

图1 马铃薯StPYL1(A)和StPYL8(B)基因cDNA 扩增条带Fig.1 Agarose gel electrophoresis of amplification product of StPYL1(A)and StPYL8(B)cDNA from potato


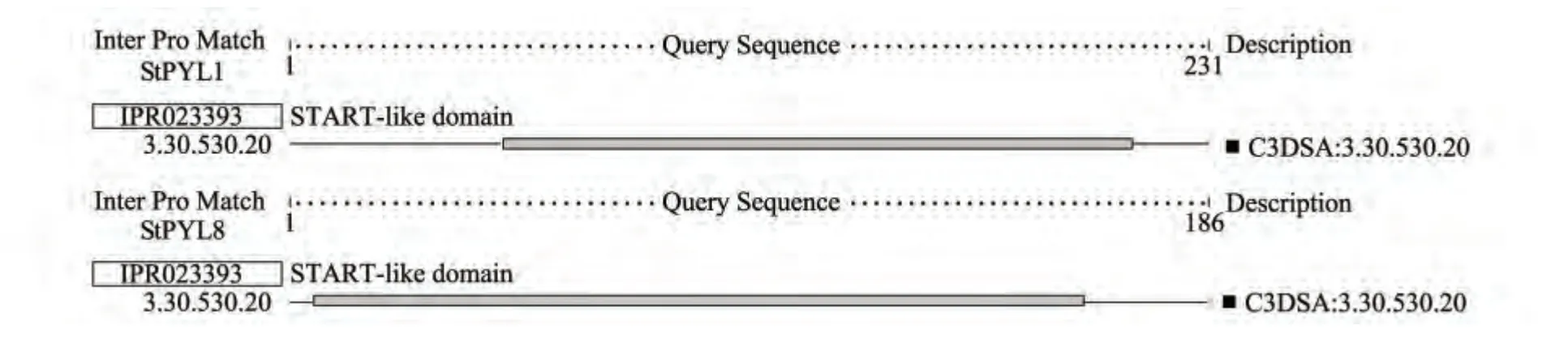
图3 马铃薯StPYL1 和StPYL8 结构域分析Fig.3 Analysis of StPYL1 and StPYL8 domains

图4 StPYL1(A)、StPYL8(C)与AtPYL1(B)、AtPYL9(D)三级结构模型Fig.4 Tertiary structure models of StPYL1(A),StPYL8(C),AtPYL1(B)and AtPYL9(D)
StPYL1 与StPYL8 蛋白一致性是37. 02%,StPYL1 与其他23 种PYL 的氨基酸序列相似性为33% ~62%,其中与拟南芥AtPYL1 同源性最高。StPYL8 与其他23 种PYL 的氨基酸序列相似性为37% ~72%,其中与苜蓿MtPYL9 同源性最高(图2)。进化分析结果显示,24 种PYL 蛋白具有相同的进化起源,StPYL1 与苜蓿MtPYR1 进化亲缘关系最近,StPYL8 与拟南芥AtPYL8 的进化亲缘关系最近。在拟南芥中,PYL 家族被分成3 个亚家族,根据这种分类标准,StPYL1 和StPYL8 分别属于亚家族Ⅲ、亚家族Ⅰ[14-15](图5)。
2.2 基因StPYL1 和StPYL8 组织表达分析
利用半定量RT-PCR 方法检测了马铃薯植株不同部位的StPYL1 和StPYL8 mRNA 水平。在茎、叶中,均能检测到StPYL1 和StPYL8 表达,但是,StPYL1 在茎中表达较为强烈,且略强于StPYL8,在叶中有微弱表达;而StPYL8 在叶中的表达水平高于其在茎的表达水平,且强于StPYL1 在叶中表达水平。在块茎分化与发育过程中,StPYL1 和StPYL8均有不同程度的表达,然而,整个发育过程中StPYL8 表达强于StPYL1;StPYL1 在起始匍匐茎中表达略强于延伸匍匐茎、膨大匍匐茎和初始块茎;StPYL8 在起始匍匐茎、膨大匍匐茎和初始块茎中表达量大于延伸匍匐茎(图6)。
2.3 基因StPYL1 和StPYL8 对外源ABA、盐胁迫与干旱胁迫的表达响应
外源ABA 处理以后,StPYL1 与StPYL8 表达量均上调,一段时间后达到峰值,随后逐渐下降。30%PEG-6000 处理后,随着时间变化,StPYL1 表达量变化不明显,StPYL8 表达量逐渐增加,24 h 达到峰值,随后表达量逐渐下降。200 mmol/L NaCl 处理后,StPYL1 表达量没有发生明显变化,StPYL8 基因上调表达,48 h 表达量达到峰值,随后下降(图7)。
3 讨论

图5 StPYL1 和StPYL8 的系统发育分析Fig.5 Phylogenetic analysis of StPYL1 and stPYL8

图6 StPYL1 和StPYL8 的组织表达分析Fig.6 Expression analysis of StPYL1 and StPYL8 in different tissues
植物内源激素ABA 具有广泛的生物学功能,参与植物生长发育各个阶段以及植物应对环境胁迫的分子调控过程。大量的研究结果表明,PYL、PP2C和SnRK2 这3 种信号组份在ABA 信号转导途径中相互联系,共同组成一个双重负调控系统,通过调节下游的作用元件而形成一条完整的ABA 信号通路[13-14,23]。根据PYL 蛋白家族在拟南芥中的分类,本试验克隆得到的StPYL1 和StPYL8 两个基因分别属于Ⅲ类和Ⅰ类。进化分析发现StPYL1 与Mt-PYR1、StPYL8 与AtPYL8 有较近的亲缘关系。结构域预测发现StPYL1 与StPYL8 都含有START-like结构域,这与已知的PYL 蛋白结构特点相一致[13-15,18,22]。3D 结构预测分析表明,StPYL1 与At-PYL1、StPYL8 与AtPYL9 结构相似性较高。上述分析结果都证明StPYL1 和StPYL8 可能是ABA 受体蛋白。

图7 ABA、干旱和NaCl 处理对StPYL1 和StPYL8 基因表达影响Fig.7 StPYL1 and StPYL8 genes expressions in potato exposed to ABA,drought and NaCl treatments
在组织表达特性上,StPYL1 和StPYL8 在同一组织中表达量有所差异,在叶片中,StPYL1 有微弱表达,而StPYL8 表达较为强烈;在茎中,StPYL1 表达强于StPYL8。这点与拟南芥AtPYR1 和AtPYL8基因在茎和叶中的表达特征相似[24]。在拟南芥中还发现,PYR1,PYL1,PYL2,PYL4,PYL5 和PYL8 等基因在叶片和茎中表达集中在维管束组织,值得一提的是,维管束是许多植物逆境应答的传导通道,并且免疫学研究结果证实维管束薄壁组织细胞中含有大量的NCED3,ABA2 和AAO3 等ABA 合成相关酶[24-25]。在马铃薯块茎形成过程中,StPYL1 表达水平变化不明显,且表达量较低;相对而言,StPYL8 表达量较高,并且不同块茎发育时期,表达量有所变化。表明基因StPYL8 可能参与了马铃薯的块茎发育过程但机理尚需要进一步研究。
马铃薯幼苗经过外源ABA 处理后,StPYL1 与StPYL8 表达量增加,表明二者均受外源ABA 诱导。研究发现,外源ABA 处理拟南芥幼苗,随时间延长,PYR1、PYL1、PYL4、PYL5、PYL6、PYL8 表达量逐渐下调,PYL2、PYL3 表达量逐渐上调,PYL7、PYL9 表达量上调至峰值后逐渐下降[26]。StPYL1 与AtPYR1、AtPYL1;StPYL8 与AtPYL8 氨基酸序列一致性较高,但是它们在不同物种中受ABA 诱导表达特征的不同之处值得深入探讨。干旱和盐胁迫处理后,StPYL1 表达量没有发生显著性的变化,StPYL8 表达量上调,表明StPYL8 参与了上述逆境调控。与野生型相比较,拟南芥pyr1/pyl1/pyl2/pyl4/pyl5/pyl8 6突变体植株生长迟缓、植株矮小,气孔开放度明显增大,叶片气体交换速度加快,干燥环境下失水较快[27]。基因AtPYL8 受盐胁迫诱导表达,并且PYL8过表达植株对盐胁迫和甘露醇渗透胁迫表现的更加敏感,相对于野生型植株,RAB18、P5CS1、RD29A 和RD29B 等已知的ABA 应答基因在过表达植株中表达量显著增加[28]。上述结果都证明PYL 基因参与了植物应激反应,在逆境调控中发挥着重要作用[29]。在马铃薯中StPYL1 与StPYL8 虽同为ABA受体蛋白,但是参与环境胁迫响应的调节方式可能不同。
在对拟南芥的研究中发现,pyr1/pyl1/pyl2/pyl4/pyl5/pyl8 6 突变体对ABA 超不敏感,PYL9、PYL5 和PYL8 的过表达植株在种子萌发、营养生长、基因表达和气孔运动等多种生理过程中都表现出对ABA 更加敏感,且植株的耐旱能力显著增强[13,28-30],这些都表明PYL 在ABA 信号转导中的起着重要作用。
[1] CUTLER S R,RODRIGUEZ P L,FINKELSTEIN R R,et al.Abscisic acid:emergence of a core signaling network[J]. Annu Rev Plant Biol,2010,61:651-679.
[2] 王少先,彭克勤,萧浪涛,等. 逆境下ABA 的积累及其触发机制[J]. 植物生理学通讯,2003,39(5):413-417.
[3] 吴耀荣,谢 旗. ABA 与植物胁迫抗性[J]. 植物学通报,2006,23(5):511-518.
[4] ADIE BAT,PEREZ-PEREZ J,PEREZ-PEREZ M M,et al. ABA is an essential signal for plant resistance to pathogens affecting JA biosynthesis and the activation of defenses in Arabidopsis[J].Plant Cell,2007,19(5):1665-1681.
[5] DING Z H,LI S M,AN X L,et al. Transgenic expression of MYB15 confers enhanced sensitivity to abscisic acid and improved drought tolerance in Arabidopsis thaliana[J]. J Genet Genomics,2009,36(1):17-29.
[6] 张大鹏. 始于质体/叶绿体的ABA 信号通路[J]. 植物学报,2011,46(4):361-369.
[7] SHEN Y Y,WANG X F,WU F Q,et al. The Mg-chelatase H subunit is an abscisic acid receptor[J]. Nature,2006,443(7113):823-826.
[8] WU F Q,XIN Q,CAO Z,et al. The magnesium-chelatase H subunit binds abscisic acid and functions in abscisic acid signaling:new evidence in Arabidopsis[J]. Plant Physiol,2009,150(4):1940-1954.
[9] SHANG Y,YAN L,LIU Z Q,et al. The Mg-chelatase H subunit of Arabidopsis antagonizes a group of WRKY transcription repressors to relieve ABA-responsive genes of inhibition[J]. Plant Cell,2010,22(6):1909-1935.
[10] ANTONI R,RODRIGUEZ L,GONZALEZ-GUZMAN M,et al.Review News on ABA transport,protein degradation,and ABFs/WRKYs in ABA signaling[J]. Curr Opin Plant Biol,2011,14(5):547-553.
[11] LIU X,YUE Y,LI B,et al. AG protein-coupled receptor is a plasma membrane receptor for the plant hormone abscisic acid[J]. Science,2007,315(5819):1712-1716.
[12] PANDEY S,NELSON D C,ASSMANN S M. Two novel GPCRtype G proteins are abscisic acid receptors in Arabidopsis[J].Cell,2009,136(1):136-148.
[13] MA Y,SZOSTKIEWICZ I,KORTE A,et al. Regulators of PP2C phosphatase activity function as abscisic acid sensors[J]. Science,2009,324(5930):1064-1068.
[14] PARK S Y,FUNG P,NISHIMURA N,et al. Abscisic acid inhibits type 2C protein phosphatases via the PYR/PYL family of START proteins[J]. Science,2009,324(5930):1068-1071.
[15] SUN L,WANG Y P,CHEN P,et al. Transcriptional regulation of SlPYL,SlPP2C,and SlSnRK2 gene families encoding ABA signal core components during tomato fruit development and drought stress[J]. J Exp Bot,2011,62(15):5659-5669.
[16] YOSHIDA R,UMEZAWA T,MIZOGUCHI T,et al. The regulatory domain of SRK2E/OST1/SnRK2.6 interacts with ABI1 and integrates abscisic acid (ABA)and osmotic stress signals controlling stomatal closure in Arabidopsis[J]. J Biol Chem,2006,281(8):5310-5318.
[17] FUJII H,CHINNUSAMY V,RODRIGUES A,et al. In vitro reconstitution of an abscisic acid signaling pathway[J]. Nature,2009,462(7273):660-664.
[18] MELCHER K,NG LM,ZhOU X E,et al. A gate–latch–lock mechanism for hormone signalling by abscisic acid receptors[J].Nature,2009,462(7273):602-608.
[19] KOBAYASHI Y,MYRATA M,MINAMI H,et al. Abscisic acidactivated SNRK2 protein kinases function in the gene-regulation pathway of ABA signal transduction by phosphorylating ABA response elementbinding factors[J]. Plant J,2005,44(6):939-949.
[20] FURIHATA T,MARUYAMA K,FUJITA Y,et al. Abscisic aciddependent multisite phosphorylation regulates the activity of a transcription activator AREB1[J]. Proc Natl Acad Sci,2006,103(6):1988-1993.
[21] SZOSTKIEWICZ I,RICHTER K,KEPKA M,et al. Closely relatedreceptor complexes differ in their ABA selectivity and sensitivity[J]. Plant J,2010,61(1):25-35.
[22] ZHANG X,JIANG L,WANG G,et al. Structural insights into the abscisic acid stereospecificity by the ABA receptors PYR/PYL/RCAR[J]. PLoS One,2013,8(7):1-10.
[23] 胡 帅,王芳展,刘振宁,等. PYR/PYL/RCAR 蛋白介导植物ABA 的信号转导[J]. 遗传,2012,34(5):560-572.
[24] GONZALEZ-GUZMAN M,PIZZIO G A,ANTONI R,et al. Arabidopsis PYR/PYL/RCAR receptors play a major role in quantitative regulation of stomatal aperture and transcriptional response to abscisic acid[J]. Plant Cell,2012,24(6):2483-2496.
[25] ENDO A,SAWADA Y,TAKAHASHI H,et al.Drought induction of Arabidopsis 9-cis-epoxycarotenoid dioxygenase occurs in vascular parenchyma cells[J]. Plant Physiol,2008,147(4):1984-1993.
[26] KILIAN J,WHITEHEAD D,HORAK J,et al. The AtGenExpress global stress expression data set:protocols,evaluation and model data analysis of UV-B light,drought and cold stress responses[J]. Plant J,2007,50(2):347-363.
[27] NG L M,MELCHER K,TEH B T,et al.Abscisic acid perception and signaling:structural mechanisms and applications[J]. Acta Pharmacol Sin,2014,35(5):567-584.
[28] SAAVEDRA X,MODREGO A,RODRIGUEZ D,et al. The nuclear interactor PYL8/RCAR3 of Fagus sylvatica FsPP2C1 is a positive regulator of abscisic acid signaling in seeds and stress[J]. Plant Physiol,2010,152(1):133-150.
[29] LENG P,YUAN B,GUO Y,et al. The role of abscisic acid in fruit ripening and responses to abiotic stress[J]. J Exp Bot,2014,65(6):4577-4588.
[30] SANTIAGO J,RODRIGUES A,SAEZ A,et al. Modulation of drought resistance by the abscisic acid receptor PYL5 through inhibition of clade A PP2Cs[J]. Plant J,2009,60(4):575-588.
