鸭坦布苏病毒囊膜蛋白抗原表位的串联表达与抗原性分析
2015-04-02韩凯凯黄欣梅赵冬敏刘宇卓谢星星安凤娇
韩凯凯, 李 银, 黄欣梅, 赵冬敏, 刘宇卓, 谢星星, 安凤娇
(江苏省农业科学院兽医研究所,农业部兽用生物制品工程技术重点实验室,国家兽用生物制品工程技术研究中心,江苏 南京210014)
2010 年春季以来,上海、浙江、江苏等地相继爆发一种导致鸭、鹅产蛋急剧下降的新发疾病。发病鸭、鹅主要表现为高热、运动障碍、食欲下降、产蛋下降甚至停止,死亡率可达5 % ~10%[1];该病典型的病理变化表现为卵巢出血、萎缩、破裂,患病后期出现神经症状,倒地震颤,最终衰竭死亡;该病传播迅速、波及面广,几乎席卷了整个水禽养殖密集地区,给中国鸭鹅养殖业造成了巨大损失[2]。目前已经证明引起该病的病原为坦布苏病毒(Tembusu virus,TMUV)[3]。
坦布苏病毒属于黄病毒科(Flaviviridae)不分节段的单股正链RNA 病毒,含有单一的开放读码框,编码结构蛋白(C、prM 和E)和非结构蛋白(NS1、NS2A、NS2B、NS3、NS4A、NS4B 和NS5)。其中,E 蛋白是坦布苏病毒的囊膜蛋白,由500 个氨基酸组成,它在病毒的吸附、融合、细胞趋向性、病毒毒力和诱导保护性免疫反应中起重要作用[4]。在黄病毒属病毒E 蛋白研究中,发现其携带有可以产生中和抗体的B 细胞表位,当中和抗体与E 蛋白结合后就可以阻断病毒与细胞上相应受体的结合,或者阻止病毒与细胞膜发生融合。Li 等[5]构建了含有日本脑炎病毒E 基因T、B 细胞表位的多表位基因,利用Balb/c 小鼠评价构建的DNA 疫苗和重组蛋白疫苗的免疫效力,结果显示,所构建的DNA 疫苗和重组蛋白质疫苗都能诱导产生针对日本脑炎病毒的特异性体液免疫和细胞免疫应答。Wei 等[6]运用生物信息学技术从日本脑炎病毒E 蛋白序列中选取6 个B细胞表位和2 个T 细胞表位,串联入原核表达载体中,所表达的蛋白免疫小鼠后,能够诱导机体产生极高水平的中和抗体。
本研究通过生物信息学技术,对鸭坦布苏病毒E 蛋白序列进行分析,筛选6 段B 细胞表位和2 段T 细胞表位,将以上8 条多肽进行拼接,人工合成串联表位基因并进行表达及抗原性分析,为建立鸭坦布苏病血清学诊断方法及制备高效合成肽疫苗奠定基础。
1 材料与方法
1.1 试验材料
坦布苏病毒分离株(JS804)由作者实验室分离保存;E. coli DH5α、E. coli BL21(DE3)菌株由作者实验室保存;pMD18-T 载体购自大连宝生物有限公司,原核表达载体pET-32a(+)由本实验室保存;坦布苏病毒阳性血清、阴性血清均由作者实验室制备。
1.2 主要试剂
限制性内切酶、Ex Taq 酶、T4 DNA Ligase、蛋白质相对分子质量标准等购自大连宝生物工程有限公司;DAB 底物显色试剂盒购自武汉博士德生物技术有限公司;辣根过氧化物酶(HRP)标记山羊抗兔IgG 购自北京中杉金桥生物技术有限公司;质粒小量提取试剂盒、PCR 产物纯化试剂盒购自Axygen 生物科技有限公司;其余试剂均为国产分析纯。基因序列合成、引物合成和测序由南京金斯瑞生物科技有限公司完成。
1.3 方法
1.3.1 鸭坦布苏病毒E 蛋白抗原表位的筛选 以鸭坦布苏病毒囊膜蛋白(Envelope,E)基因序列为基础,采用生物信息学技术,Chou-Fasman 法、Garnier-Robson 法和Karplus-Schulz 法预测蛋白质的二级结构;按Kyte-Doolittle 方案、Emini 方案和Jameson-Wolf 方案综合考虑二级结构、亲水性、抗原指数等因素,筛选出6 段B 细胞表位与2 段T 细胞表位。
1.3.2 多表位串联基因的构建与人工合成 以筛选出的6 段B 细胞表位多肽氨基酸序列与2 段T 细胞表位多肽氨基酸序列为依据,在两个不同表位间分别引入柔性氨基酸Gly-Ser(甘氨酸-丝氨酸)作为柔性肽,串联构成一个连续的阅读框,基因密码子的选择兼顾大肠杆菌的偏爱性,将稀有氨基酸密码子进行替换,并在DNA 序列的两端加上EcoR I 和Sal I酶切位点,DNA 全长由南京金斯瑞生物科技有限公司合成,新基因命名为TEM,其DNA 序列所编码的氨基酸序列见表1。将TEM 连接至pMD18-T中,命名为pMD18-T-TEM。
1.3.3 重组表达载体的构建 用EcoR I 和Sal I分别对pMD18-T-TEM、pET32a 质粒进行双酶切,分别回收载体片段与目的基因片段,用T4 DNA 连接酶将目的基因片段连接到原核表达载体pET32a上,然后转化至DH5α 感受态细胞中,构建pET32a-TEM,将酶切鉴定正确的重组质粒送南京金斯瑞生物科技有限公司测序。
1.3.4 串联基因的表达及产物的纯化 将测序正确的pET32a-TEM/DH5a 菌液提取质粒,转入E.coli BL21(DE3)感受态细胞,取150 μl 涂布于含Amp(100 μg/ml)的LB 琼脂平板中,37 ℃培养过夜,挑取单个菌落于含Amp 的LB 液体培养基中振荡培养过夜。然后按1∶ 100 比例扩大振荡培养,待OD 值达到0.6 左右时,加入IPTG 至终浓度为0.8 mmol/L,37 ℃振荡培养5 h,SDS-PAGE 电泳检测表达产物。反复冻融表达菌体3 次,超声波破碎菌体,对破碎后的菌液4 ℃10 000 r/min 离心20 min,分离裂解液的上清液和沉淀,SDS-PAGE 电泳分析重组蛋白的表达形式。采用洗涤包涵体的方法在变性条件下去除杂蛋白,将变性的纯蛋白在不同尿素浓度下透析逐步复性。经SDS-PAGE 电泳检测纯化重组蛋白,最后用核酸蛋白仪测定纯化的重组蛋白浓度。
1.3.5 原核表达产物的Western blot 分析 重组蛋白经SDS-PAGE 电泳后,于半干式转移电泳仪以恒压1 V/cm2转移60 min,取出硝酸纤维素膜,TBST漂洗,5%脱脂牛奶封闭1 h 后,TBST 漂洗,加入兔抗坦布苏病毒阳性血清,孵育1 h,TBST 漂洗,再加入HRP 标记的羊抗兔IgG,TBST 漂洗,将NC 膜放入HRP-DAB 显色液中,出现条带后立即用双蒸水终止显色,观察结果。
1.3.6 动物免疫 6 周龄雌性BALB/c 小鼠分为3组,每组10 只,第1 组和第2 组分别免疫pET32a-TEM、pET32a 原核表达的蛋白(每只100 μg),蛋白首先与等量弗氏完全佐剂混合并乳化,通过皮下多点注射法初次免疫,14 d 后用弗氏不完全佐剂乳化抗原进行二次免疫,二次免疫14 d 后进行三次免疫,抗原乳化方法、抗原剂量同上,每次免疫前需要采血,第3 组皮下注射100 μl PBS 作为对照。三次免疫10 d 后眼球采血,分离血清,获得阳性血清。ELISA 方法检测各组小鼠的血清效价。
2 结果
2.1 鸭坦布苏病毒E 蛋白抗原表位的筛选
应用DNAStar 软件对鸭坦布苏病毒囊膜蛋白(Envelope,E)基因进行分析。理论上应该选取亲水性大于0,抗原性大于0,表面可及性大于1 的序列。同时根据预测结果,对该基因的二级结构、亲水性、抗原性、表面可及性等因素进行综合分析,筛选出6 段B 细胞表位与2 段T 细胞表位(表1)。
2.2 坦布苏病毒多表位串联基因TEM 的构建与人工合成
将筛选好的坦布苏病毒多表位基因用柔性氨基酸的核苷酸序列串联得到多表位基因TEM,由南京金斯瑞生物科技有限公司合成。

表1 TEM 的氨基酸序列Table 1 The amino acids sequences of TEM
2.3 pET32a-TEM 重组质粒的构建
用EcoR I 和Sal I 分别对pMD18-T-TEM、pET32a 质粒进行双酶切,构建重组表达质粒pET32a-TEM。为确认该片段插入质粒,对重组质粒进行了双酶切鉴定。结果如图1 所示,获得约5 900 bp 和500 bp 的两条片段,分别与pET32a 和TEM 的基因片段大小相符,表明重组质粒的构建获得成功。

图1 重组质粒pET32a-TEM 的酶切鉴定Fig.1 Identification of recombinant plasmid by enzyme digestion
2.4 TEM 基因片段的原核表达纯化及可溶性鉴定
将重组质粒pET32a-TEM 转化入大肠杆菌BL21 中,经IPTG 诱导培养后,对表达蛋白进行了电泳鉴定和表达形式的检测。在SDS-PAGE 图谱中,与未诱导的空质粒所表达蛋白带比较,经诱导的重组质粒表达产物约为38 000。可溶性分析结果显示,融合蛋白以包涵体的形式存在,通过镍柱纯化,得到较为纯净的蛋白(图2)。
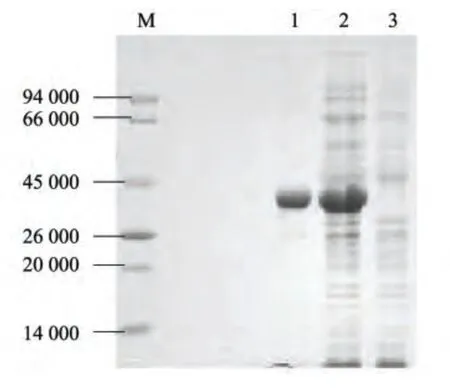
图2 融合蛋白特性分析Fig.2 Characteristics of recombinant protein
2.5 Western blotting 分析
为确定融合蛋白中TEM 多肽的免疫原性,用纯化的坦布苏病毒抗原免疫小鼠,并用免疫印迹检测在免疫小鼠血清中是否存在相应抗体。结果表明,免疫小鼠血清中有与融合蛋白结合的抗体,而空载体诱导对照无此特异性反应带(图3)。

图3 融合蛋白Western blotting 检测结果Fig.3 Identification of the prokaryoticly expressed protein by Western blotting
2.6 抗体检测
免疫前后各组特异性IgG 消长情况如图4 所示,免疫前,三个组特异性IgG 抗体水平相近;首次免疫后,pET32a-TEM 重组蛋白免疫组小鼠的特异性抗体IgG 开始升高,在首次免疫后14 d,重组蛋白免疫组特异性抗体IgG OD 值极显著地高于PBS 对照组(P <0.01);在试验的28 d,免疫组特异性抗体IgG OD 值达到峰值;三次免疫后,重组蛋白免疫组特异性抗体IgG OD 值有所下降,但仍显著高于空载体蛋白组和PBS 对照组。重组蛋白免疫组血清特异性抗体IgG 水平从首免后14 d 一直到试验结束均显著地高于空载体蛋白组和PBS 对照组(P <0.05)。
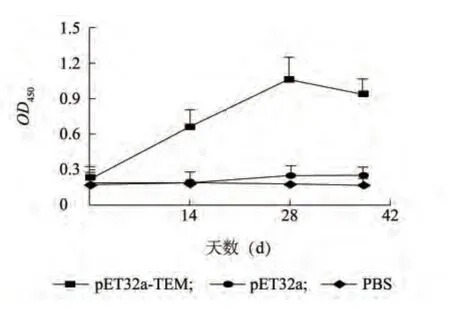
图4 免疫鼠特异性抗体IgG 消长情况Fig.4 The growth and decline of specific antibody IgG in immuned mouse
3 讨论
抗原表位是抗原分子中免疫细胞识别、与免疫细胞表面抗原受体结合、诱导特异性免疫应答的最基本结构和功能单位,每一种表位决定一种抗原特异性。与传统的保护性抗原单独表达相比,串联表达技术有其自身的优点和特殊性,将抗原表位进行串联既纯化了抗原性,又减少了无关干扰序列的影响。目前,表位串联这种手段已经广泛应用于诊断抗原、免疫原的制备[7-8]。将串联技术与基因合成及融合表达技术结合起来,在目的分子中加入一些柔性氨基酸作为连接肽,还可以改良蛋白质性质,最大限度地保证各表位原有的天然构象,不因融合串联而影响其功能。通常用的连接肽为Gly-Ser(即表达甘氨酸和丝氨酸的序列),因为这两个氨基酸最简单,对目的蛋白影响最小,甘氨酸是分子质量最小、侧链最短的氨基酸,不会形成空间位阻,可增加侧链的柔性;丝氨酸是亲水性最强的氨基酸,可增加串联肽段的亲水性。在先前研究中,Kulkarni 等[9]通过生物信息学技术构建了日本脑炎病毒E 基因和NS1基因的多表位疫苗,体外免疫Balb/c 小鼠能够产生特异性中和抗体,同时发现通过调整、优化其空间构象,能获得更高的免疫保护力。刘志国等[10]在西尼罗病毒表位疫苗研究中发现构建的西尼罗病毒多表位基因重组质粒DNA 免疫小鼠后,能够在小鼠体内诱导产生保护性中和抗体,效价达到1∶ 50,并可显著提高细胞免疫水平。
坦布苏病毒是在我国首次发现的对水禽致病的新型黄病毒,传播迅速、对鸭鹅危害大,已给中国水禽业造成巨大的经济损失,由于坦布苏病毒在中国爆发时间短,所以在该病毒的致病机理、跨物种传播机制及疫苗研制方面还存在很多迫切需要解决的难题。E 蛋白是黄病毒的囊膜蛋白,也是主要的结构蛋白,同时研究结果表明,E 蛋白是体外中和作用的主要靶点和病毒特异性抗体的作用位点,具有中和活性,能够刺激机体产生抗体引发特异性免疫。在本研究中,首先通过生物信息学软件分析预测,筛选出坦布苏病毒E 蛋白可能的抗原表位,为使重组后的8 个表位蛋白不会形成空间位阻,且都能保持各自的活性,在每个表位后面引入1 个Gly-Ser 连接肽,能使目的蛋白具有较好的稳定性与生物活性。送生物试剂公司合成后,选用pET32a 作为原核表达载体,在大肠杆菌中成功表达了坦布苏病毒E 蛋白主要抗原表位基因融合蛋白,通过融合蛋白与抗坦布苏病毒阳性血清进行Western blotting 检测,结果表明人工合成的TEM 蛋白可以被坦布苏病毒多克隆抗体识别,具有良好的抗原性,采用融合蛋白免疫小鼠后的免疫原性检测结果也证明了这一点。本试验证明所合成的串联多肽TEM 是一个良好的坦布苏病毒抗原,这个结果为研究更加简单有效的坦布苏病毒亚单位疫苗提供了依据。
[1] YUN T,YE W,ZHANG N,et al. Identification and molecular characterization of a novel flavivirus isolated from Pekin ducklings in China[J]. Vet Microbiol,2012,157:311-319.
[2] HUANG X,HAN K,ZHAO D,et al. Identification and molecular characterization of a novel flavivirus isolated from geese in China[J]. Research in Veterinary Science,2013,94:774-780.
[3] YAN P,ZHAO Y,ZHANG X,et al. An infectious disease of ducks caused by a newly emerged Tembusu virus strain in mainland China[J].Virology,2011,417 (1):1-8.
[4] 朱丽萍,颜世敢.鸭坦布苏病毒研究进展[J]. 中国预防兽医学报,2012,34(1):79-82.
[5] LI P,CAO R B,ZHENG Q S,et al. Enhancement of humoral and cellular immunity in mice against Japanese encephalitis virus using a DNA prime-protein boost vaccine strategy [J]. Vet J,2010,183 (2):210-216.
[6] WEI J C,HUANG Y Z,ZHONG D K,et al. Design and evaluation of a multi-epitope peptide against Japanese encephalitis virus infection in BALB/c mice[J]. Biochem Bioph Res Co,2010,396 (4):787-792.
[7] 贾 莹,李 岩,尹 鑫,等. 牛病毒性腹泻病病毒NS3 表位串联蛋白表达及抗体间接ELISA 方法的建立[J].畜牧兽医学报,2011,42 (8):1120-1125.
[8] 鲁 丹. 禽传染性支气管炎多基因串联表位抗原的构建表达与ELISA 方法初探[D]. 雅安:四川农业大学,2010.
[9] KULKARNI R,SAPKAL G,MAHISHI L,et al. Design and characterization of polytope construct with multiple B and T(H)Epitopes of Japanese encephalitis virus[J]. Virus Res,2012,166(1-2):77-86.
[10] 刘志国,朱晓光,刘伯华,等. 西尼罗病毒多表位基因免疫保护研究[J]. 中国人兽共患病学报,2008,24 (4):285-289.
