CaM 与ZmCCaMK 相互作用参与BR 诱导的玉米叶片抗氧化防护
2015-04-02张阿英
管 莉, 张阿英
(南京农业大学生命科学学院,江苏 南京210095)
油菜素内酯(Brassinosteroids,BR)作为一种新型甾醇类植物激素,参与并调节植物生长发育以及对胁迫响应过程[1-3]。许多研究结果表明,BR 可以通过提高植物的抗氧化防护酶活性来增强植物对胁迫的耐受能力[4-5],活性氧、促分裂原活化蛋白激酶(Mitogen activated protein kinase,MAPK)[5-6]、钙调素依赖的蛋白激酶(Calcium-calmodulin dependent protein kinase,ZmCCaMK)等都参与BR 诱导的抗氧化防护,然而关于BR 诱导植物抗氧化防护的详细机理还不十分清楚。
近些年一些研究结果表明,钙调素(Calmodulin,CaM)也参与了植物对多种环境刺激和胁迫的响应机制,如盐胁迫、干旱胁迫等[7-8]。Desikan等[9]研究发现外源H2O2可以诱导CaM 基因的表达。外源脱落酸(Abscisic acid,ABA)、H2O2或者水分胁迫都可以显著提高玉米叶片中CaM 含量,而且CaM 抑制剂试验结果也表明CaM 参与ABA 诱导的抗氧化防护[10]。但CaM 是否参与BR 诱导的抗氧化防护过程还不清楚。因此,本试验以玉米农大108 为材料,研究CaM 在BR 诱导的抗氧化防护中的作用,并且进一步研究CaM 和ZmCCaMK 在BR诱导的抗氧化防护过程中的关系,以期深入了解BR诱导抗氧化防护机制,为进一步了解植物在抗逆过程中的响应机理提供一定的理论依据。
1 材料和方法
1.1 材料和试剂
玉米农大108 购自中国种子公司,瞬时表达载体 pXZ-ZmCCaMK 由本实验室马芳芳构建,ZmCCaMK抗体由金斯瑞公司制备。
PEG4000、甘露糖醇、三氟乙酸、KI、2-(N-吗啉)-乙磺酸(MES)、N-(6-氨基己烷基)-5-氯-1 萘-黄胺[N-(6-aminohexyl)-5-chloro-1-naphthalene sulphonmide hydrochloride,W7]和三氟拉嗪(trifluoperazine,TFP)为Sigma 公司产品;离析酶R-10、纤维素酶R-10 为日本Yakult Honsha 公司产品;反转试剂盒、定量试剂盒、ELISA 购自TaKaRa 公司;RNA 干扰试剂盒购自Promega 公司。
1.2 试验方法
1.2.1 植株培养和处理 将玉米幼苗置于光照恒温箱中(昼夜温度28 ℃/22 ℃,每天光照14 h,相对湿度60%)培养7 d。然后,挑选长势一致的玉米幼苗,参照Ma 等的方法[11],用CaM 拮抗剂W7(200 μmol/L)、TFP(100 μmol/L)预处理4 h,再用BR 处理30 min,取第2 片叶子并置于液氮中备用。另外,将玉米种子置于蛭石-泥炭土(1∶ 1)中,并在暗培养箱中培养,当第2 片叶高出第1 片叶10 ~15 cm 时,从基部剪取第2 片叶,用于玉米原生质体的提取。
1.2.2 dsRNA 的体外转录合成 参照Ma 等的方法[11]合成ZmCCaMK 的dsRNA。
1.2.3 玉米原生质体的分离和转化 参照Zhu 等的方法[4],提取玉米原生质体。玉米原生质体的转化是采用聚乙二醇(40% PEG4000)融合法。将高纯度的重组质粒100 μg ubi-YFP-ZmCCaMK (以空载ubi-YFP 为对照)或者150 μg dsRNA (以双蒸水为对照)加入到1 ml 原生质体中,再加入1. 1 ml PEG 溶液(0.6 mol/L 甘露 醇,40% PEG4000,0.1 mol/L CaCl2),轻轻混匀,25 ℃静置13 ~15 min;加入4.4 ml W5 溶液(125 mmol/L CaCl2,154 mmol/L NaCl,5 mmol/L KCl,2 mmol/L MES,pH 5.7)混匀,1 000 g 离心3 min,弃上清;加1 ml 培养液(0.6 mol/L 甘 露 醇,4 mmol/L MES,4 mmol/L KCl,pH5.7),25 ℃培养过夜;用10 nmol/L BR 处理30 min 后,收集玉米原生质体,以测定CaM 含量。
1.2.4 叶片总RNA 的提取及cDNA 的制备 将0.1 g 玉米叶片用液氮充分研磨,并溶于RNA 提取试剂Trizol 中,然后参照Ding 等的方法[12]进行总RNA 的提取及RNA 浓度和纯度的检测。最后,将提取得到的RNA 按照反转试剂盒的说明将RNA 反转录成cDNA。
1.2.5 定量RT-PCR 及数据处理 应用Applied Biosystems 7500 Real-Time PCR System 对ZmCCaMK基因进行相对定量RT-PCR 分析:采用SYBR ®Premix Ex TaqTM试剂盒,以ZmACTIN 为内参引物。ZmCCaMK (DQ403196)的引物序列:5'-CTCAAGCCCGAGAACTGCC-3' 和5'-TGGCAGCCGAGACATCC-3';ZmACTIN (J01238)的引物序列:5'-GTTTCCTGGGATTGCCGAT-3' 和 5'-TCTGCTGCTGAAAAGTGCTGAG-3'。反应体系和反应程序参照试剂盒说明。每个样品重复3 次,取平均值,用2-△△Ct的方法计算待测基因的相对表达量,其中,基因在各处理0 min 时的相对表达量设定为1.0。
1.2.6 免疫沉淀和激酶凝胶反应 将处理后的叶片用液氮研磨成粉末,加入1 ml 蛋白质提取液[100 mmol/L 4-羟乙基哌嗪乙磺酸(HEPES)pH 7. 5,5 mmol/L乙二胺四乙酸(EDTA),5 mmol/L 乙二醇双(2-氨基乙基醚)四乙酸(EGTA),10 mmol/L 二硫苏糖醇,10 mmol/L Na3VO4,10 mmol/L NaF,50 mmol/L β-磷酸甘油,1 mmol/L 苯甲基磺酰氟(PMSF),5 μg/ml亮抑酶肽(Leupeptin),5 μg/ml 抑肽酶(Aprotinin),5%甘油],4 ℃,12 000 g 离心0.5 h,取上清,采用Bradford 方法[13]计算蛋白质含量,分装并冻于-70 ℃待用。免疫沉淀和激酶凝胶反应步骤参照Ma 等的方法[11]。将得到的X 光片用Quantity One软件进行量化处理,将对照点设定为1.0,其余各处理点的相对值由处理点的数值除以对照的值。
1.2.7 酶联免疫法(ELISA)测定CaM 含量 收集过夜培养后的原生质体,加入2 倍体积的预冷提取液(50 mmol/L Tris-HCl,pH 8.0,1 mmol/L EGTA,0.5 mmol/L PMSF,20 mmol/L NaHSO4,0.15 mol/L NaCl),涡旋震荡2 min(可用超声波破碎);4 ℃12 000 g 离心0.5 h,参照ELISA 试剂盒(TaKaRa 公司产品)方法测定原生质体中CaM 含量,钙调素含量以μg/mg表示(以蛋白质计)。
1.2.8 H2O2含量的测定 H2O2含量的测定参照张超强等的方法[14]。0.5 g 的玉米叶片,加入预冷的4 ml 三氟乙酸研磨,12 000 g 离心30 min;取0.5 ml上清液,加入等体积10 mmol/L磷酸缓冲液和2 倍体积的1 mol/L KI,在390 nm 处测定吸光值,H2O2含量以ng/g 表示(以鲜质量计)。
1.2.9 抗氧化酶的活性测定 超氧化物歧化酶(SOD)和抗坏血酸过氧化物酶(APX)的活性测定均参照Zhang 等的方法[5]。
1.2.10 数据分析 每个处理重复5 次,数据统计采用SPSS 软件,用Ducan’s 法分析差异显著性。
2 结果
2.1 外源BR 诱导对玉米叶片叶肉细胞原生质体CaM 含量的影响
为了研究外源BR 对玉米叶片原生质体中CaM含量的影响,用10 nmol/L BR 处理分离得到的玉米叶片原生质体,并测定CaM 含量。结果(图1)表明:与对照相比,外源BR 处理显著提高了玉米叶片原生质体中CaM 含量,CaM 含量在BR 处理30 min时达最大值,增加了2.8 倍,随后开始下降,到60 min 时下降到正常水平。

图1 10 nmol/L 油菜素内酯(BR)处理不同时间后玉米叶片叶肉细胞原生质体钙调素(CaM)含量的变化Fig.1 Time course of calmodulin(CaM)content in maize mesophyll protoplasts treated with 10 nmol/L brassinosteroids (BR)
2.2 CaM 参与BR 诱导的抗氧化防护
为了确定CaM 是否参与BR 诱导的抗氧化防护过程,玉米植株预先用CaM 拮抗剂处理4 h,再用10 nmol/L BR 处理30 min(水处理为对照),测定抗氧化防护酶SOD、APX 的活性以及H2O2含量的变化。结果(图2)显示CaM 拮抗剂几乎完全抑制了BR 诱导的玉米叶片中抗氧化防护酶SOD、APX 的活性,这表明CaM 参与了BR 诱导的玉米叶片的抗氧化防护。
2.3 CaM 对BR 诱导的ZmCCaMK 基因表达以及激酶活性、H2O2含量的影响
为研究CaM 和ZmCCaMK 在BR 诱导的抗氧化防护过程中的关系,首先用CaM 拮抗剂W7 和TFP 预处理玉米幼苗,再通过荧光定量PCR 技术测定玉米叶片中ZmCCaMK 基因表达量,同时用凝胶激酶反应测定ZmCCaMK 的激酶活性。结果表明:CaM 抑制剂的预处理能显著降低BR 诱导的ZmCCaMK 基因表达和激酶活性增加,而W7 和TFP 本身对其没有影响(图3)。此外,CaM 拮抗剂W7 和TFP 预处理也显著抑制了BR 诱导的H2O2积累。这些结果说明CaM 参与BR 诱导的ZmCCaMK 活化及H2O2积累。

图2 CaM 拮抗剂TFP 和W7 预处理对BR 诱导的抗氧化防护酶SOD 和APX 的影响Fig.2 Effects of pretreatment with CaM antagonists of TFP and W7 on BR-induced antioxidant enzymes SOD and APX

图3 钙调素拮抗剂预处理对BR 诱导的玉米叶片中ZmCCaMK 基因表达和激酶活性、H2O2含量的影响Fig.3 The effects of pretreatment with CaM antagonists on ZmCCaMK expression and the activities of ZmCCaMK,and the content of H2 O2
2.4 瞬时表达和瞬时沉默ZmCCaMK 基因对BR诱导的原生质体中CaM 含量的影响
采用原生质体瞬时表达及瞬时沉默体系,瞬时表达及瞬时沉默ZmCCaMK 基因,并经BR 处理30 min,以转化空载为对照,然后用酶联免疫法测定样品中CaM 含量。结果(图4)表明:瞬时表达ZmCCaMK 基因后,CaM 含量明显增加,并且BR 处理后仍有部分增加;瞬时沉默ZmCCaMK 基因后,CaM 含量明显减少,且BR 处理也仅有略微增加。说明ZmCCaMK 也参与调节玉米叶片中BR 诱导的CaM含量。
3 讨论
植物在整个生长发育过程中会受到各种不良环境的影响,如盐胁迫、干旱胁迫等,这些非生物胁迫主要是干扰植物细胞中活性氧(Reactive oxygen species,ROS)产生和清除之间的平衡,从而导致植物细胞遭受氧化胁迫。在正常条件下,ROS 的生成和清除处在一定的平衡状态,不会对细胞造成损伤,但当处于环境胁迫时,植物体内ROS 急剧积累而使细胞受到氧化胁迫[15]。然而植物在长期的进化中为了生存,在受到环境胁迫时,可以通过改变细胞代谢及诱导多种防御机制来响应环境胁迫[16]。越来越多的研究结果表明,植物激素BR 在这一过程中起着十分重要的作用。Zhang 等[5]的研究结果表明BR 能诱导超氧化物歧化酶(SOD)、抗坏血酸过氧化物酶(APX)等抗氧化防护酶活性上调,提高清除ROS 的能力,从而缓解干旱胁迫对植物造成的氧化损伤。Liu 等[17]的研究结果表明BR 可以诱导抗氧化防护酶活性上调,从而减轻低温对高山离子芥造成的氧化损伤。但对BR 诱导的抗氧化防护机理的研究报道较少。本研究发现,BR 可以显著提高玉米叶片叶肉细胞原生质体的CaM 含量,同时CaM 拮抗剂试验结果表明,CaM 参与了BR 诱导的抗氧化防护酶活性的提高以及H2O2的积累。这表明BR诱导的CaM 影响H2O2的积累,进而提高了抗氧化防护酶SOD 和APX 活性。
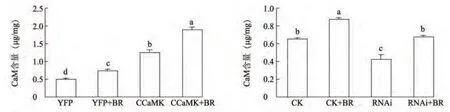
图4 瞬时表达及瞬时沉默ZmCCaMK 对BR 诱导的原生质体CaM 含量的影响Fig.4 The content of CaM exposed to BR treatment in the protoplasts transiently expressing or transiently silencing ZmCCaMK
CaM 和ZmCCaMK 都参与BR 诱导的抗氧化防护过程。为研究在BR 信号通路中它们之间的相互关系,本研究首先进行了抑制剂试验,结果表明CaM 参与BR 诱导的ZmCCaMK 活化。为进一步研究CaM 和ZmCCaMK 在BR 信号转导中的关系,我们借助玉米原生质体瞬时表达及瞬时沉默体系瞬时表达及瞬时沉默ZmCCaMK 基因,发现ZmCCaMK也参与并调控玉米叶片中BR 诱导下CaM 的含量变化。这表明BR 可以诱导CaM,进而激活ZmCCaMK,同时ZmCCaMK 也可以反过来影响BR 诱导的CaM 含量。近年来越来越多的研究结果表明,CaM 和H2O2等信号分子之间存在一个交叉对话机制[10,18],因此推测CaM 和ZmCCaMK 在BR 诱导的抗氧化防护过程中可能存在这一个交叉对话机制。
综上所述,CaM 在BR 诱导的抗氧化防护过程中具有重要的作用,并且CaM 和ZmCCaMK 之间存在一个交叉对话机制,这对于深入研究BR 调控植物的抗逆应答反应机制提供了理论依据。
[1] 阮英慧,董守坤,刘丽君,等. 干旱胁迫下油菜素内酯对大豆花期生理特性的影响[J].作物杂志,2011,6:33-37.
[2] 曹云英,赵 华. 高温胁迫下油菜素内酯对水稻幼苗的保护作用[J].中国水稻科学,2007,21(5):525-529.
[3] 张林青. 油菜素内酯对盐胁迫下番茄幼苗生理指标的影响[J]. 北方园艺,2013 (1):1-3.
[4] ZHU Y,ZUO M X,LIANG Y L,et al. MAP65-1a positively regulates H2O2amplification and enhances brassinosteroid-induced antioxidant defence in maize[J]. Journal of Experimental Botany,2013,64(12):3787-3802.
[5] ZHANG A Y,ZHANG J,YE N H,et al. ZmMPK5 is required for the NADPH oxidase-mediated self-propagation of apoplastic H2O2in brassinosteroid-induced antioxidant defence in leaves of maize[J]. Journal of Experimental Botany,2010,61(15):4399-4411.
[6] XIA X J,WANG Y J,ZHOU Y H,et al. Reactive oxygen species are involved in brassinosteroid-induced stress tolerance in cucumber[J]. Plant Physiology,2009,150(2):801-814.
[7] 张云霞,石 勇,王瑞刚,等. 初始盐胁迫下ABA 与CaM 对胡杨叶片气体交换的调控[J]. 林业科学,2008,44(1):57-64.
[8] 谷俊涛,郭秀林. 水分胁迫下钙,钙调素对小麦幼苗生长及过氧化物酶同工酶的影响[J]. 华北农学报,2001,16(3):62-67.
[9] DESIKAN R,SOHEILA A H,HANCOCK J T,et al. Regulation of the arabidopsis transcriptome by oxidative stress [J]. Plant Physiology,2001,127(1):159-172.
[10] HU X L,JIANG M Y,ZHANG J H,et al. Calcium–calmodulin is required for abscisic acid-induced antioxidant defense and functions both upstream and downstream of H2O2production in leaves of maize (Zea mays)plants[J]. New Phytologist,2007,173(1):27-38.
[11] MA F F,LU R,LIU H Y,et al. Nitric oxide-activated calcium/calmodulin-dependent protein kinase regulates the abscisic acid-induced antioxidant defence in maize[J]. Journal of Experimental Botany,2012,63(13):4835-4847.
[12] DING Y F,CAO J M,NI L,et al. ZmCPK11 is involved in abscisic acid-induced antioxidant defence and functions upstream of ZmMPK5 in abscisic acid signalling in maize[J]. Journal of Experimental Botany,2013,64(4):871-884.
[13] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72(1):248-254.
[14] 张超强,杨颖丽,王 莱,等. 盐胁迫对小麦幼苗叶片H2O2产生和抗氧化酶活性的影响[J]. 西北师范大学学报:自然科学版,2007,43(1):71-75.
[15] FRYER M J,ANDREWS J R,OXBOROUGH K,et al. Relationship between CO2assimilation,photosynthetic electron transport,and active O2metabolism in leaves of maize in the field during periods of low temperature[J]. Plant Physiology,1998,116(2):571-580.
[16] BOHNERT H J,JENSEN R G. Strategies for engineering waterstress tolerance in plants[J]. Trends in Biotechnology,1996,14(3):89-97.
[17] LIU Y J,ZHAO Z G,SI J,et al. Brassinosteroids alleviate chilling-induced oxidative damage by enhancing antioxidant defense system in suspension cultured cells of Chorispora bungeana[J].Plant Growth Regulation,2009,59(3):207-214.
[18] HU X L,WANG W,LI C Q,et al. Cross-talks between Ca2+/CaM and H2O2 in abscisic acid-induced antioxidant defense in leaves of maize plants exposed to water stress[J]. Plant Growth Regulation,2008,55(3):183-198.
