SSR 分子标记在糯高粱种质资源遗传多样性分析中的应用
2015-04-02倪先林赵甘霖刘天朋胡炯凌陈国民汪小楷丁国祥
倪先林, 赵甘霖, 刘天朋, 胡炯凌, 李 元, 陈国民, 汪小楷, 丁国祥
(四川省农业科学院水稻高粱研究所,四川 泸州646000)
高粱起源于非洲,是高光效的C4 作物,具有抗旱、抗涝、耐盐碱、耐瘠薄等多重抗逆性和适应性,是热带干旱和半干旱地区的重要粮食作物和饲料作物,是世界5 大粮食作物之一[1-2]。
根据籽粒淀粉的性质不同,高粱可分为粳型和糯型。糯高粱品种是酿造名优白酒的优质原料,是中国南方名酒的主要原料。近年来,随着中国酒业和饲料行业的发展,高粱的供需矛盾日益突出,导致目前高粱生产能力不足,这对中国高粱育种工作者们提出了迫切的要求,并使中国的高粱育种向专用化品种方向发展。
种质资源遗传多样性是育种的基础。遗传多样性的研究对作物种质资源的收集、保存、评价和利用均具有十分重要的意义[3]。高粱起源于非州,其基因组较小,比水稻稍大,但远小于玉米,是禾本科类作物基因组结构、功能和进化研究的又一重要模式作物,并日益受到重视。高粱杂种优势强,是最早实现杂种优势利用的作物之一。育种实践证明,亲本间的遗传差异是产生杂种优势的根本原因,亲本间的亲缘关系较远,杂种表现强优势的可能性较大。因此,全面、系统地研究糯高粱种质的遗传多样性,明确糯高粱资源的亲缘关系和遗传差异,对于减少亲本选配的盲目性及提高育种效率具有重要意义,但传统的形态学等研究方法易受环境和经验影响,分子标记技术具有标记数量多、不受时空和经验限制、能显著提高选择效率等优点,是检测种质资源的有效工具,已被广泛应用于高粱遗传多样性研究、遗传图谱的构建、基因/QTL定位、核心种质筛选、杂种优势的利用等各方面[4-9]。
国内外学者在高粱尤其是甜高粱的遗传多样性方面做了大量研究。Ali 等[10]、赵香娜等[11]和冯国郡等[12]分别利用SSR 标记进行了甜高粱遗传多样性研究;余传涨等[13]用自行开发的SSR 标记对部分甜高粱和籽粒高粱品种进行了遗传多样性分析;Fang 等[14]利用ISSR 标记对高粱、杂交高粱、甜高粱、苏丹草、黑高粱和假高粱6 种不同高粱属植物进行了遗传关系研究;Zhang 等[15]利用SSR 标记,以69 份国外品种为对照,对12 个地区的184 份中国高粱地方品种进行了遗传多样性分析。由于国内野生糯高粱资源相对匮乏,分布不均,且大部分为常规品种,不能充分利用,导致目前少有针对糯高粱方面的分析报道。本研究以从各地收集和自育而来的29 份糯高粱种质资源为材料,利用SSR 标记检测其遗传多样性,试图明确这些糯高粱种质资源的亲缘关系和遗传差异等,从而避免育种实践中亲本选配的盲目性,为杂交糯高粱新品种的选育及杂种优势利用提供理论指导。
1 材料与方法
1.1 材料
供试的29 份糯质高粱资源包括9 个不育系和20 个恢复系,分别来自四川、河南、河北、山西、湖南、北京等地市省份,具体材料列于表1。

表1 供试高粱材料Table 1 Sorghum varieties used in this study
1.2 高粱DNA 提取及SSR 分子标记来源
每个材料随机选取适量种子在培养箱中发芽培养7 d,剪取幼苗叶片采用CTAB 法提取糯高粱基因组DNA[16]。
根据网上信息和文献中已公开发表的高粱微卫星引物序列[13],选用60 对分布在高粱染色体10 个连锁群上的SSR 引物对供试材料进行PCR 扩增(http://sorgblast3.tamu. edu/Sorghum Genome/Mapping),所有SSR 引物由上海生工生物工程技术有限公司合成。
1.3 SSR 标记分析
PCR 反应体系总体积为20.0 μl,包括10.0 mmol/L dNTP 0.5 μl、10 × Buffer 2.0 μl、25.0 mmol/L MgCl22.0 μl、引物2.0 μl、5 U Taq 酶0.2 μl、模板DNA 2.0 μl、超纯水11.3 μl。PCR 扩增程序为94 ℃变性5 min;94 ℃变性50 s,55 ℃(根据引物Tm 值确定)退火50 s,72 ℃延伸55 s,循环35次;72 ℃延伸10 min。扩增产物用3%琼脂糖凝胶进行电泳分离,经EB 染色后在Bio-Rad 凝胶成像系统下成像。
1.4 数据统计与分析
每检测到1 条多态性带视为1 个等位基因,根据PCR 扩增结果,在相同迁移位置有带时记为1,无带时记为0,缺失记为9。利用NTSYSpc 2.10 软件中的Qualitative date 计算任意2 个品种间的遗传相似系数(GS),计算公式为:GS =2Nij/(Ni+Nj)。其中,Nij为材料i 和j 共有的扩增片段总数,Ni为材料i 中出现的扩增片段数目,Nj为材料j 中出现的扩增片段数目。
SSR 位点的多态性信息含量(Polymorphism index contents,PIC),PIC =1-Σ(pi)2,式中pi为第i个多态位点上的基因频率[17]。有效等位基因位点数(Effective number of alleles,E),E =1/Σ(pi)2,式中,pi为第i 个多态位点上的基因频率,n 为检测的位点数[18]。
数据处理和统计分析在EXCEL 2003 和NTSYS-pc2.10[19]系统下进行。根据所得的遗传相似系数,采用算术平均数非加权成组法(UPGMA)进行聚类分析,并绘制树状图。
2 结果与分析
2.1 SSR 标记分析
从60 对SSR 引物中筛选出扩增带清晰且多态性较好的25 对进行统计分析,结果(表2)显示,25对多态性引物分布于高粱9 个连锁群上,共检测到59 个等位基因,其中有效等位基因数为45.2 个,涉及25 个SSR 位点。平均每个位点检测到的等位基因数为2.28 个,变化范围2 ~4 个,每对引物检测到的有效等位基因数平均为1.81 个。大部分引物只检测出了2 个等位基因,引物Xtxp265 检测出的等位基因数最多,为4 个。根据每个等位基因出现的频率计算引物位点的多态信息含量(PIC),25 个引物的平均多态信息含量为0.34,变化范围0.17(Xtxp58)~0.62(Xtxp265)。25 个位点检测出的等位基因数与多态信息含量指数大小不太一致,但两者表现出极显著正相关关系(r =0.571 9**),说明引物检测到的等位变异数越多,其PIC 值就可能越大。3560R 变是3560R 的一个自然黄化突变体,引物Xtxp265 在两者之间检测出了差异,能将两者区分开来,说明引物Xtxp265 可能与3560R 的黄化突变基因有关。
2.2 遗传变异分析
29 份糯高粱种质之间的遗传相似系数范围为0.20(L402A/3560R 变)~0.95(7R/9R),平均为0.60(图1);7R 和9R 之间的遗传相似系数最大,说明这两个种质之间的亲缘关系最近,L402A 和3560R 变之间的遗传相似系数最小,说明两者的亲缘关系最远。不育系之间的遗传相似系数变幅为0.46 ~0.90,平均为0.70;恢复系之间的遗传相似系数变幅为0.37 ~0.95,平均为0.70。不育系、恢复系的平均遗传相似系数均较大,说明不育系和恢复系各自群体内的亲缘关系较近,遗传多样性较小。不育系和恢复系之间的遗传相似系数变幅为0.20(L402A/3560R 变)~0.64(18A/泸恢1),平均为0.44(表3);不育系18A 与恢复系之间的平均遗传相似系数最大,为0.54,L402A 与恢复系之间的平均遗传相似系数最小,为0.37;恢复系58R 与不育系之间的平均遗传相似系数最大,为0.53,3560R变与不育系之间的平均遗传相似系数最小,为0.35。不育系和恢复系的180 个遗传相似系数中,有142 个小于0.50,占78.9%,说明不育系和恢复系之间的亲缘关系较远,遗传多样性较大。不育系和恢复系之间的平均遗传相似系数比不育系和恢复系群内的小,说明本研究中的遗传多样性主要来自于类群间,这有利于强优势杂交糯高粱新组合的配制。
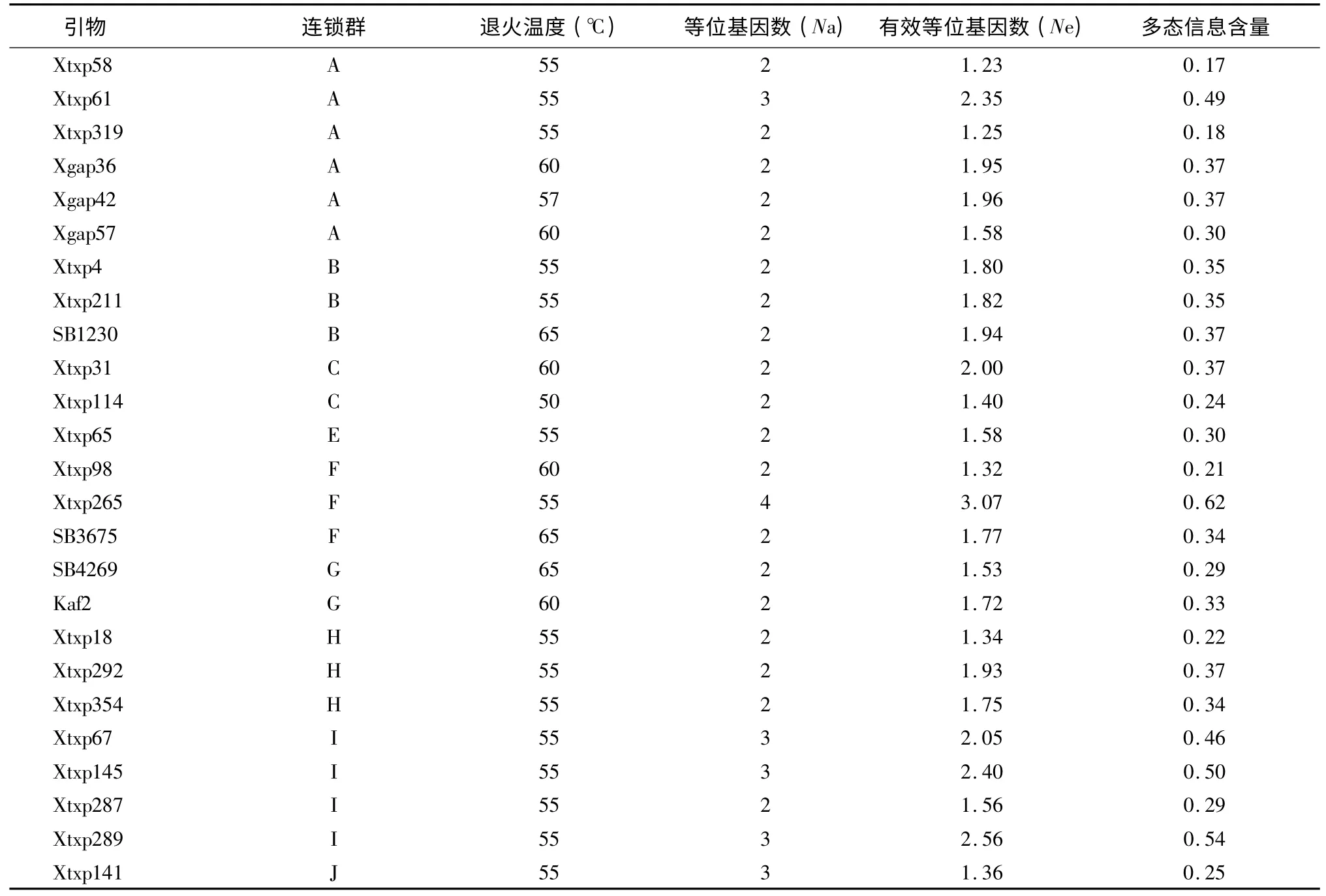
表2 25 对SSR 引物在29 份糯高粱资源中检测到的等位基因数目及多态信息含量Table 2 Allele numbers and PIC values for 25 loci detected in 29 glutinous sorghum accessions
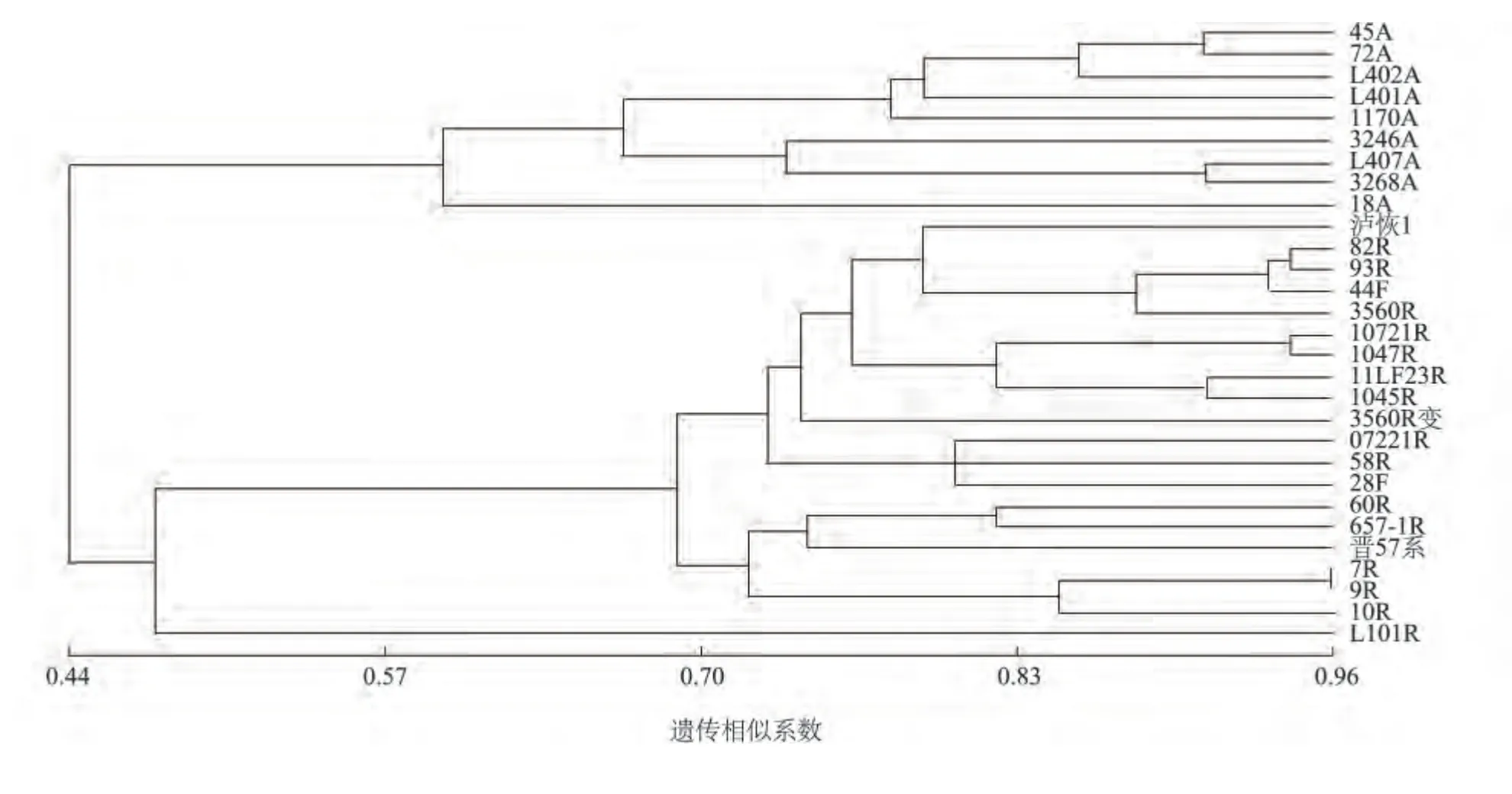
图1 基于SSR 标记的29 份糯高粱种质资源的聚类图Fig.1 Phylogenetic tree of 29 glutinous sorghum accessions based on SSR data

表3 29 份糯高粱材料之间的遗传相似系数Table 3 The genetic similarity coefficients among 29 glutinous sorghum accessions
2.3 聚类分析
利用SSR 标记遗传相似系数矩阵,按UPGMA方法对29 份糯高粱种质资源进行聚类分析,在遗传相似系数0.48 处将供试材料明显地划分为2 大类(图1)。45A 等9 个不育系材料聚为一类,属于不育系类群,除18A 与3246A 之间的遗传相似系数较小外,类群内其余不育系间的遗传相似系数都大于0.50,表明不育系类群的遗传多样性较小。泸恢1等20 个材料聚为第二类,属于恢复系类群,类群内遗传相似系数为0.37 ~0.95,其中遗传相似系数大于0.50 的占93.7%,说明恢复系之间的遗传多样性也相对较小。
在遗传相似系数0.59 处,不育系类又可分为3个亚类,45A、72A、L402A、L401A、1170A 为第I 亚类。第II 亚类包括3246A、L407A 和3268A 3 个不育系,这3 个材料都来自辽宁,且籽粒均为白色。18A 为第III 亚类,其株高最矮、千粒质量小、生育期短,与其他不育系有明显的不同。恢复系类也可划分为3 个亚类,第I 亚类包括泸恢1 等16 个材料,所有品种的粒色分为橙红色和红色两种;1047R 和11LF23R 的亲本之一为10721R,三者聚在一起。3560R 变为3560R 的一个黄化突变体,两者之间的亲缘关系较近,聚在一个亚类,但聚类分析表明两者之间仍存在一定的遗传差异;第2 亚类包括60R、657-1R、晋57 系、7R、9R、10R 6 个品种,其中,60R来自河南,657-1R 来自北京,晋57 系来自山西,三者的生育期都较短,穗型较紧,其余材料来自辽宁。L101R 与其他恢复系的平均遗传相似系数最小,亲缘关系最远,为第3 亚类,其生育期最迟、株高较高、千粒质量大、籽粒为白色,与其他恢复系的农艺性状表现出明显的不同。不同地理来源的品种聚在了一起,说明糯高粱品种的亲缘关系与地理来源关系不大。虽然SSR 标记在本研究中得出的遗传相似系数较大,但仍能准确地将本试验中的材料划分为2大类,且能将亲缘关系较近的材料区别开来,说明SSR 标记能有效地应用于糯高粱种质资源的亲缘关系鉴定和遗传多样性分析中。
3 讨论
种质资源遗传多样性是育种的基础,通过遗传多样性的研究可以从整体上把握该物种的资源,为使用者提供重要信息。以往的学者常用植物学性状来研究高粱的遗传多样性,如株高、穗长、生育期、枝梗数等[20-21],随着生物技术的发展,高粱遗传多样性的检测逐渐深入到分子水平。利用分子标记技术可以从DNA 水平将作物种质有效区分开来,可以更准确地检测种质资源遗传多样性,明确系谱不清、来源不明的高粱种质的遗传背景,从而更有针对性地组配亲本,提高育种效率,为杂交高粱育种提供理论指导。
Zhang 等[15]利用32 个高粱核基因组多态性SSR 位点,以69 份国外品种为对照,对12 个地区的184 份中国高粱地方品种进行了遗传多样性分析,比较发现中国高粱的遗传多样性明显低于国外高粱,中国高粱与国外高粱之间遗传分化明显,而中国高粱地方品种地区间和类型间分化极弱。主成分分析(PCA)能够明显区分中外高粱种质但不能将中国高粱按地区或类型分开。Ali 等[10]用SSR 标记分析了72 个甜高粱材料,得到的聚类结果与已知的家谱和遗传背景信息相吻合。赵香娜等[11]用SSR 标记对国内外206 份甜高粱种质进行了遗传多样性分析,得到的遗传变异关系与农艺性状反映的遗传变异关系不尽一致。徐影等[22]用RAPD 标记和SSR标记分析了20 份甜高粱的遗传多态性,2 种分子标记的单独聚类分析结果表现出一定差异,但两种趋势大致相近,联合数据分析结果与单一分子标记结果揭示的品种亲缘关系趋势大致相近,但不完全一致,且SSR 标记结果与联合标记结果更加相近,2 种分子标记联合数据的聚类分析结果与杂交种系谱亲本来源调查结果和生物学特征观测结果基本一致。表明SSR 标记在糯高粱种质资源遗传多样性研究中的有效性。
本研究结果表明,29 份糯高粱种质间的遗传相似系数变化范围为0.20 ~0.95,平均为0.59,25 个引物的平均多态信息含量为0.34,不仅具有相同等位位点的引物的多态信息含量不同,而且多态信息含量与等位位点数目不尽一致,表明本研究中所用的29 个糯高粱材料的变异程度较高,遗传多样性相对较高。不育系和恢复系各自群内的平均遗传相似系数均较大,而不育系和恢复系之间的平均遗传相似系数较小,说明本研究中的遗传多样性主要来源于类群间。不育系和恢复系之间的遗传相似系数小,表明2 个类群间的遗传差异较大,有可利用的性状优势,这有利于糯高粱新品种的选育和杂种优势利用。
聚类分析将29 份糯高粱种质明显地划分为不育系和恢复系两大类,与其系谱关系相吻合。大部分聚在1 个亚类的品种在农艺性状上都具有一定的共性和相似性,如恢复系7R 和9R 之间的遗传相似系数为0.95,2 个材料在株高、粒色、生育期等农艺性状上的表现基本一致,差异较小。聚类分析表明,不同地理来源的品种聚在了一起,这可能是由于一些品种长期适应不同地域生态条件的结果,同时说明亲缘关系与地理来源关系不大,这与其他研究者的结果一致[23]。此外,本研究中的部分SSR 标记能将亲缘关系较近的品系区分开来,如Xtxp265 能将3560R 和3560R 变鉴别开来,表明该SSR 标记能作为核心引物在糯高粱种质资源鉴定中应用。多态性信息量(PIC)值反映了某一对SSR 引物对品种的区分能力,是衡量基因变异程度高低的指标。本研究中25 个引物检测到的平均多态信息含量为0.34,相对较低,这可能与所选用的糯高粱种质资源的遗传基础有关,也可能与所选用的SSR 标记有关,本研究中所选用的引物类型比较单一,主要为Xtxp型,其他类型的引物较少,多态性引物也主要分布在连锁群A、F 和H 上,其他连锁群上的较少。因此,要准确地鉴定亲缘关系较近的亲本之间的遗传关系,应尽可能在覆盖高粱全基因组的基础上选择一些多态性好、类型丰富的引物,同时尽量增加样本数量。
中国的野生糯高粱资源大部分为地方品种,存在株高偏高、抗性较差、产量低等缺点,难以进一步利用。因此,糯高粱种质资源的遗传多样性研究对糯高粱种质资源的的保护、创新和利用具有重要意义,对糯高粱杂种优势育种具有重要的实践意义。
[1] 新 楠,罗 峰,李 贺,等.播期对天津地区甜高粱主要性状的影响[J].江苏农业科学,2014,42(8):90-92.
[2] 郭晓丽,时丽冉,王广才,等.干旱胁迫对不同高粱品种生理特性的影响[J].江苏农业科学,2014,42(2):91-93.
[3] 董玉琛. 生物多样性及作物遗传多样性检测[J].作物品种资源,1995(3):1-5.
[4] MENZ M A,KLEIN R R,UNRUH N C,et al. Genetic diversity of public inbreds of sorghum determined by mapped AFLP and SSR markers[J]. Crop Sci,2004,44(4):1236-1244.
[5] MENZ M A,KLEIN R R,MULLET J E,et al. A high-density genetic map of Sorghum bicolor (L.)Moench based on 2926 AFLP,RFLP,and SSR markers[J]. Plant Mol Biol,2002,48(5-6):483-499.
[6] 徐吉臣,WEERASURIYA Y M,BENNETZEN J L. 高梁(Sorghum bicolor)分子图谱的构建及寄生草(Striga asiatica)萌发诱导物基因的定位[J].遗传学报,2001,28(9):870-876.
[7] ARUNA C,BHAGWAT V R,MADHUSUDHANA R,et al. Identification and validation of genomic regions that affect shoot fly resistance in sorghum[Sorghum bicolor (L.)Moench][J]. Theor Appl Genet,2011,122 (8):1617-1630.
[8] JORDAN D R,EMMA S,MACE R G,et al. Molecular mapping and candidate gene identification of the Rf2 gene for pollen fertility restoration in sorghum[Sorghum bicolor (L.)Moench][J]. Theor Appl Genet,2010,120(1):1279-1287.
[9] 王黎明,焦少杰,姜艳喜,等.142 份甜高粱品种的分子身份证构建[J].作物学报,2011,7(11):1975-1983.
[10] ALI M L,RAJEWSKI J F,BAENZIGER P S,et al. Assessment of genetic diversity and relationship among a collection of US sweet sorghum germplasm by SSR markers[J]. Mol Breeding,2008,21:497-509.
[11] 赵香娜,岳美琪,刘 洋,等.国内外甜高梁种质遗传多样性的SSR 分析[J].植物遗传资源学报,2010,11(4):407-412.
[12] 冯国郡,叶 凯,李桂英,等.新疆甜高粱种质资源遗传多样性的SSR 分析[J].植物遗传资源学报,2012,13(4):549-554.
[13] 余传涨,翟国伟,邹桂花,等. 41 个高粱品种遗传多样性的SSR 标记检测[J].江苏农业学报,2010,26(2):248-253.
[14] FANG X E,CHEN Q,YIN L P,et al. Application of ISSR in genetic relationship analysis of sorghum species[J]. Acta Agron Sin,2008,34(8):1480-1483.
[15] ZHANG H,WANG J C,WANG D J,et al.Assessment of genetic diversity in Chinese sorghum landraces using SSR markers as compared with foreign accessions[J]. Acta Agronomica Sinica,2011,37(2):224-234.
[16] SAMBROOK J,FRITSCH E F,MANIATIS T. Molecular cloning a laboratory manual[M]. Third edition. New York:Cold Spring Habour Laboratory Press,1989.
[17] SMITH J S C,CHIN E C L,SHU H,et al. An evolution of the utility of SSR loci as molecular markers in maize (Zea mays L.):comparisons with data from RFLPs and pedigree[J]. Theoretical and Applied Genetics,1997,95:163-173.
[18] KIMURA M,OHTA T. Mutation and evolution at the molecular lever[J].Genetics,1973,73(Suppl):19-35.
[19] ROLHF F J. NTSYS-pc version 1.80[CP/DK]. Setauket,NY:Distribution by Exeter Software,1993.
[20] 高彦东,陈 悦. 42 份高粱亲本的聚类分析[J]. 杂粮作物,2001,21(3):14-15.
[21] 赵香娜,李桂英,刘 洋,等. 国内外甜高粱种质资源主要性状遗传多样性及相关性分析[J]. 植物遗传资源学报,2008,9(3):302-307.
[22] 徐 影,詹秋文,董书军,等. 20 份甜高粱遗传多态性的RAPD和SSR 分析[J].华北农学报,2013,28(1):12-18.
[23] 岳文娣,魏利斌,张体德. 芝麻种质资源SSR 标记遗传多样性与群体结构分析[J].作物学报,2012,38(12):2286-2296.
