辐射花粉授粉技术诱导黄瓜单倍体
2015-04-02NguyenHacHien陈劲枫
苏 芃, Nguyen Hac Hien, 管 苇, 崔 利, 陈劲枫
(南京农业大学园艺学院,作物遗传与种质创新国家重点实验室,江苏 南京210095)
黄瓜(Cucumis sativus L.)属于葫芦科黄瓜属,是一种重要的世界性蔬菜作物[1-4]。黄瓜遗传基础狭窄,种内变异率仅为3% ~8%,加上长期的定向选择和大量杂种F1代的广泛应用,使得多数地方品种资源趋于绝迹,导致现代黄瓜育种面临着资源危机[5-7]。目前简单的常规育种手段已不能满足黄瓜新品种的选育及抗病育种的需求,单倍体培养被育种家认为是缩短育种周期、提高选择效率、获得遗传材料和有用突变体的一个重要途径[8]。通过单倍体诱导技术可以快速获得纯系(单倍体和双单倍体),进而可以加快黄瓜的育种进程。
辐射花粉授粉结合胚拯救技术是一种获得黄瓜单倍体的重要手段,Sauton[9]首次采用辐射花粉授粉结合胚拯救技术获得甜瓜单倍体。在黄瓜上,也有研究报道通过辐射花粉诱导单倍体成功。
本试验系统的研究了辐射剂量、花粉供体基因型、母本基因型对诱导黄瓜单倍体植株再生率的影响,旨在摸索出一套高效的辐射花粉授粉诱导黄瓜单倍体的技术体系,为黄瓜种质创新提供一个可靠的技术平台。
1 材料和方法
1.1 材料
本试验所用黄瓜材料来源于南京农业大学园艺学院。母本基因型:南抗1 号(F1)、津绿(F1)、博美(F1)、EC1(自交系)、5211(自交系)、CC3(自交系)、11535F(Poinsett97 ×CC3 G)、11514F(PO2 G×Beit Anpha)、11536F(Poinsett97 × PO2 G)、11568(EC1 ×津绿G)、12211S(长春密刺×10406S-93)、12331S(NC-76 × 二早子)、12523S(PO2 × 平望黄瓜)、12524S(PO2 ×SWCC8)、12548S(PO2 ×Marketmore 2000(401))、12549S(PO2 ×7011A)、12551S(PO2 × Poinset 97)、12552S(PO2 × L8)、12553S(PO2 × 白 玉)、12361S (PO2 G × Poinsett 97)、12359S(627 G ×P01)。试验地点在南京农业大学江浦实验基地,花粉供体基因型:5211(自交系)、CC3(自交系)和南抗一号(F1)。
辐射源:江苏省农业科学院辐射中心60Coγ 源。辐射剂量为:150 Gy、250 Gy、350 Gy,剂量率为2.62 Gy/min。基本培养基:MS 培养基+30 g/L蔗糖+8 g/L琼脂粉,pH 值为5.8。继代培养基:MS 培养基+30 g/L蔗糖+8 g/L琼脂粉+0.2 mg/L 6-BA,pH 值为5.8。生根培养基:1/2MS 培养基+30 g/L蔗糖+8 g/L琼脂粉+0.2m g/L 6-BA,pH 值为5.8。
1.2 方法
1.2.1 花粉辐射与授粉 在开花前1 d 采集黄瓜花粉供体材料的雄花,装入防水袋,在江苏省农业科学院进行60 Coγ 射线辐射(辐射剂量梯度为150 Gy、250 Gy、350 Gy)处理后,将雄花放在铺有湿润滤纸的培养皿中常温保存。当天下午选择第2 d 开花的雌花进行夹花隔离。第2 d上午用辐射过的雄花进行授粉,每3 朵雄花授1朵雌花,授粉后的雌花套袋隔离至坐果。第1 d采集5211 的雄花进行150 Gy 辐射剂量辐射,第2 d 用辐射处理过的雄花对当天开花的雌花做授粉处理。
1.2.2 胚胎拯救及幼苗培养 授粉2 ~3 周后采收果实,在超净工作台上,用75%的乙醇对果实表面消毒,将果实刨开分离种子接种到不添加任何激素的MS 固体培养基上进行胚拯救培养,待胚长至肉眼可见时剥去种皮进一步培养。随后,对部分黄绿色的小胚接种于继代培养基上直接成苗培养。
1.2.3 驯化移栽 当胚长成小植株后将其转接至生根培养基上,生根培养12 d 后,将再生植株炼苗3 d后移栽到营养钵中。
1.2.4 再生植株倍性鉴定 待植株长成后,进行染色体计数[10],确认植株倍性。
1.2.5 数据统计分析 统计不同基因型和不同辐射剂量下黄瓜植株再生诱导率。植株再生率=植株再生数/种子数×100%单倍体再生率=单倍体植株数/种子数×100%二倍体再生率=二倍体植株数/种子数×100%
2 结果与分析
2.1 花粉供体基因型对单倍体诱导率的影响
2.1.1 花粉供体基因型对植株再生率影响 花粉经150 Gy 剂量下辐射处理时,花粉供体为5211 时植株再生率最高,为3.92%,显著高于 CC3(0.42%)及南抗一号(0.32%)作为花粉供体时的再生率,表明花粉供体基因型对植株再生率有影响;在辐射剂量250 Gy 辐射处理花粉时,基因型对植株再生率也有影响;但是在使用350 Gy 辐射剂量辐射处理花粉时,植株再生率都较低(表1)。
2.1.2 花粉供体基因型对单倍体诱导率影响 不同花粉供体基因型对单倍体植株诱导率的影响显著(P <0.05)。5211 经150 Gy 剂量辐射处理的单倍体植株诱导率最高,为1.96%,显著高于150 Gy 剂量处理下CC3(0.21%)及南抗一号(0.19%)的单倍体植株诱导率,南抗一号单倍体植株诱导率最低。5211 经250 Gy 剂量辐射处理诱导单倍体植株再生率也最高(1.64%),而CC3 在250 Gy 剂量处理下单倍体植株诱导率最低(0.11%)。以上研究结果都不同于G. Caglar、Ficcadenti[11-12],他们的研究结果表明相同辐射剂量处理条件下花粉供体的基因型对单倍体诱导率没有影响。

表1 不同花粉供体基因型及辐射剂量对植株再生率的影响Table 1 Effect of different genotypes and gamma ray doses on the rate of plants regeneration
2.1.3 花粉供体基因型对二倍体再生率影响 经150 Gy 辐射处理后再生后代中仍有二倍体出现,其比例为5211(1.96%)>CC3(0.21%)>南抗一号(0.13%)。
以上结果表明150 Gy 辐射剂量条件下植株再生率和单倍体再生率5211 >CC3 >南抗一号,说明使用5211 作为花粉供体辐射后授粉诱导较易获得单倍体,而南抗一号较难作为花粉供体用于获得单倍体。此外随着植株再生率的增加,单倍体植株再生率也增加。
2.2 辐射剂量对植株再生率的影响
对相同基因型不同辐射剂量处理诱导的植株再生率比较分析,结果表明,150 Gy 辐射剂量处理下总体上植株再生率高于250 Gy 及350 Gy 辐射剂量处理下的植株再生率。
2.3 母本基因型对单倍体诱导率的影响
从表2 看出,供体花粉辐射剂量为150 Gy、花粉供体基因型为5211 时,不同母本基因型单倍体的诱导率存在很大差异,其中6 个基因型没有诱导出再生植株,占基因型总量的60%,其他基因型单倍体诱导率为0.26 ~0.54。
3 讨论
在甜瓜中不同正反交组合单倍体植株的再生率有显著差异[12];黄瓜上,有研究结果表明亲本的基因型对单倍体再生率没有影响[13]。本研究发现,亲本基因型对植株再生率影响显著。本试验发现150 Gy 辐射剂量下,不同花粉供体植株再生率为5211 >CC3 >南抗一号,说明5211 作为辐射花粉供体诱导较易获得单倍体,而南抗一号作为花粉供体较难获得单倍体。由于试验场地有限,所以每株留瓜3 ~4个,比常规多留1 ~2 个种瓜,且越晚授粉的种瓜由于营养缺乏导致发育良好的种子数较少,从而导致单倍体再生率较低,本研究得到的单倍体植株再生率最高为1.96%。
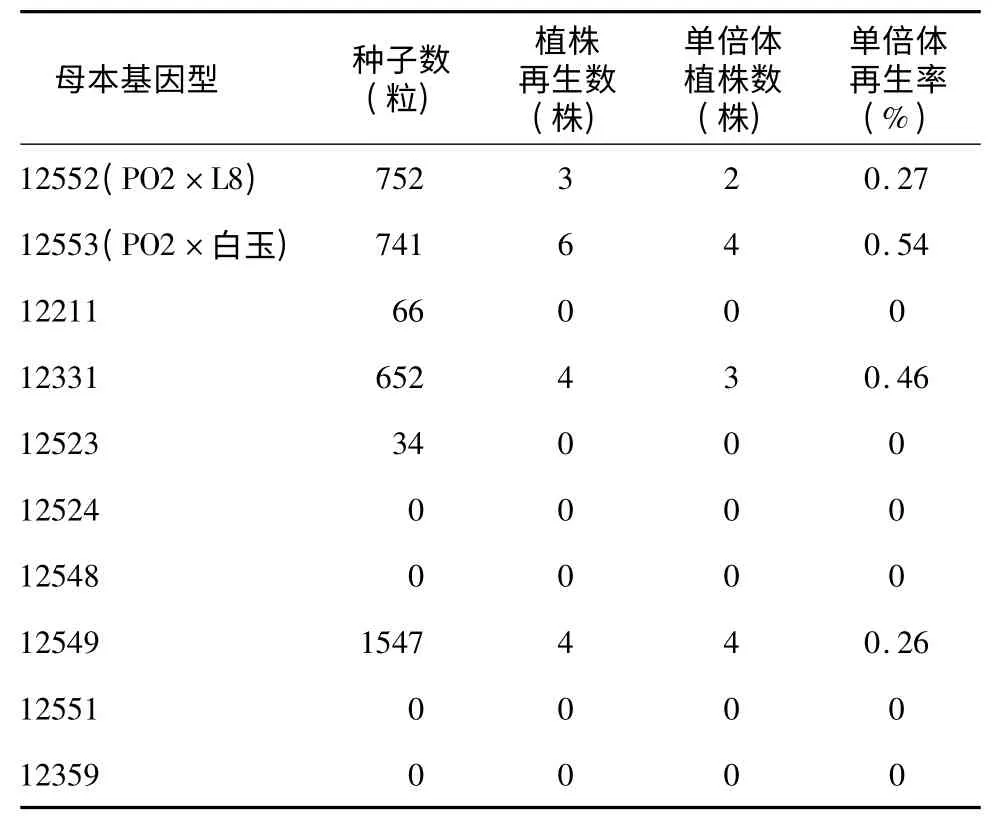
表2 母本基因型对单倍体诱导率的影响Table 2 The effects of genotype on haploid induction efficiency
本试验对10 个母本基因型黄瓜诱导研究中,6个基因型没有诱导出再生植株,占基因型总量的60%;4 个基因型诱导出再生植株,占基因型总量的40%,单倍体诱导率为0.26 ~0.54,说明不同母本基因型单倍体的诱导率存在较大的差异。
研究认为60Coγ 射线辐射花粉授粉是诱导葫芦科作物产生单倍体的有效辐射源[13]。辐射剂量的选择是诱导产生单倍体的关键因素之一。有研究结果表明,合适的辐射剂量选择和植物的倍性及花粉粒的大小有关,倍性越高或花粉粒越小越耐辐射[14-15]。黄瓜、西瓜常用的推荐辐射剂量为200 ~300 Gy[11,16]。但 是Ficcadenti[12]在 黄 瓜 上 采 用100 ~300 Gy 剂量,结果表明150 Gy 单倍体再生率最高。本研究结果也证实了150 Gy 为最佳辐射剂量。
[1] 吴传万,杜小凤,顾大路,等. 植物源药肥对温室黄瓜生长发育和土壤环境的影响[J]. 江苏农业学报,2014,30(1):92-99.
[2] 张黎杰,周玲玲,李志强,等.菌渣复合基质栽培对目光温室黄瓜生长发育和产量品质的影响[J]. 江苏农业科学,2014,42(3):109-111.
[3] 费雨兰,王 晶,沈 佳,等.不同砧木嫁接对黄瓜长势及果实品质的影响[J].江苏农业科学,2013,41(12):147-149.
[4] 刘 琴,王 艳,徐 健,等. 枯草芽孢杆菌Bs-1013 的抑菌活性及其包衣对黄瓜发芽生长的影响[J]. 江苏农业科学,2013,41(11):117-119.
[5] KENNARD W C,POTTER K,DIJKHUIZEN A,et al. Linkages among RFLP,RAPD,isozyme,disease resistance,and morphological markers in narrow and wide crosses of cucurnber[J]. Theoretical and Applied Genetics,1994,89:42-48.
[6] BRADENN J M,STAUB J E,WYE C,et al. Towards an expanded and integrated linkage map of cucumber (Cucumis sativus L.)[J].Genome,2001,44:111-119.
[7] 李加旺,张文珠,何忠魁. 黄瓜资源筛选与育种研究及其发展趋势[J]. 天津农业科学,1999,5(4):36-38.
[8] 张献龙. 植物生物技术[M]. 北京:科学出版社,2004:35-69.
[9] SAUTON. A,DUMAS DE VAULX R. Obtention de plantes haplöids chezle melon (Cucumis melon L.)aprèsgynogènèse induite pardu pollen irradiè[J]. Agronomie,1987,7:141-148.
[10] 陈劲枫,钱春桃.利用几种园艺作物卷须制片鉴定染色体数目的研究[J]. 园艺学报,2002,29(4):378-380.
[11] CAGLAR. G,ABAK K. Progress in the production of haploid embryos,plants and doubled haploids in cucumber (Cucumis sativus L.)by gamma irradiated pollen in Turkey[J]. Acta Horticulturae,1999,492:317-320.
[12] FICCADENTI N,VERONESEP,SESTILIS,et al. Influece of genotype on the inductuin of haploidy in Cucumis melo L. by using irradiated pollen[J].J Genet&Breed,1995,49:359-364.
[13] FARIS N M. The effectof gamma irradiation dose on cucumber(Cucumis sativus L.)haploid embryo production[J]. Acta Physiologiae Plantarum,1999,21(4):391-396.
[14] VISSER T,OSST E H. Pollen and pollination experminentsIII the viability of apple and pear pollen as affected by irradiation and storage[J]. Euphytuca,1981. 30:65-70.
[15] DENISSEN,CJM DENIJS A P M. Effects of gamma irradiation on in vitro pollen germination of different Cucumis species[J]. Euphytica,1987,36:651-658.
[16] SARI N AK. Induction of parthenogenetic haploid embryos after pollination by irradiated pollen in watermelon[J]. Hortscience,1994,29(10):1189-1190.
