颅脑损伤动物模型制备及脑组织中神经生长因子、脑源性神经营养因子变化的实验研究
2015-04-02郭新荣王瑞辉
郭新荣,王瑞辉,李 娜,吴 涛
颅脑损伤(traumatic brain injury,TBI)已成为危害公民的健康问题、威胁人类生命和生存质量的主要原因之一,已引起越来越多医学研究者的重视。TBI动物模型的制备对颅脑损伤的研究具有重要意义,随着对TBI受伤机制不断深入的研究,对TBI的模型复制要求也越来越高,需要寻找可控制性、重复性、稳定性更好的模型制备方法。本研究利用电子颅脑损伤仪(eCCI)制备TBI大鼠动物模型并对其进行评价,报告如下。
材料与方法
1 动物及分组
本实验所需动物由西安交通大学实验动物中心提供(动物批号:20121023)。雌性SD大鼠65只,体重220~240g,适应性饲养3d后,随机分为5组:空白组(A组,10只)、模型1组(B组,15只)、模型2组(C组,15只)、模型3组(D组,15只)和假手术组(E组,10只)。考虑到造模动物死亡率较高,因此B、C、D组各15只。
2 实验仪器及物品
戊巴比妥钠、硫酸庆大霉素、红霉素软膏、多聚甲醛、生理盐水;微型磨钻;手术器械若干;大鼠脑立体定位仪(ST-3ND,成都仪器厂);全自动脱水机(ZT-12J,湖北省孝感市亚光医用电子技术有限公司);包埋机(JB-L6,武汉俊杰电子有限公司);切片机(JJQ-P2016J,湖北省孝感市亚光医用电子技术有限公司);水浴锅;毫针、棉签、乙醇、一次性手套等耗材。
3 模型打击设备
电子颅脑损伤仪(eCCI)是由美国弗吉尼亚联邦大学设计研制的专门针对TBI模型研究的打击设备。其主要组件有:坚固的铝框、动物平台、控制器和撞击头,可以和各种型号的立体定位仪搭配使用;由控制器控制撞击的速度,撞击头的组件部分含有感应器,可以决定速率、撞击深度及撞击位置。
4 造模具体方法
术前禁食8h。实验时腹腔内注射2%的戊巴比妥钠(75mg/kg)进行麻醉,俯卧位固定于脑立体定向仪上。消毒皮肤,正中切开,剥离骨膜,暴露右顶骨,用微型磨钻在冠状缝后3mm、中线左旁2.5mm处[1]钻一直径为2mm的骨窗,保持硬膜完整。将大鼠移置到eCCI操作台上,调试好机器参数(B组:打击速度3m/s、深度3mm;C组:打击速度4m/s、深度3mm;D组:打击速度5m/s、深度3mm),对模型组动物全部进行打击,撞击杆撞击硬膜,使脑组织产生瞬间形变。打击后向切口内滴注4万U硫酸庆大霉素4~5滴,骨蜡封闭骨窗。缝合头皮,外涂抹红霉素软膏。B、C、D组动物均完成造模后,放回笼中,单独喂养。E组动物只开颅,不进行打击。
5 模型评价方法
利用光镜、电子显微镜检测损伤周围脑组织,免疫组化法检测脑组织中神经生长因子(NGF)、脑源性神经营养因子(BDNF)蛋白含量的变化。
结 果
1 光镜检测
A组和E组脑组织皮层细胞分布清晰致密、排列均匀、胞体饱满,无坏死区,无纤维素渗出,胞核呈蓝色、轮廓清楚,神经元染色正常。B组:受伤皮质可见出血、大量红细胞逸出、炎性细胞浸润。C组:脑组织出血较多,间质严重水肿,脑组织坏死、结构疏松、血管周围间隙增宽。D组:脑组织出血面积较大、细胞肿胀明显、神经细胞呈筛状排列、神经元变性,神经胶质细胞相对增多,可见嗜神经细胞现象及泡沫细胞;部分血管扩张,出现血管周围水肿,有较多凋亡细胞出现(图1)。
2 电镜结果
电镜下A组和E组的大鼠脑组织表现为:神经元整体结构完整清晰,线粒体、核糖体、粗面内质网等细胞器含量丰富,线粒体大量存在于胞质内、具有清晰可见的内外膜结构、嵴排列整齐,内质网排列规律整齐、含量较丰富;而颅脑损伤后,受损神经元的整体结构遭到不同程度的破坏,细胞膜受到损伤,线粒体超微结构被严重破坏(如嵴断裂、外膜变薄、气球样变、出现大量断裂的膜碎片等),粗面内质网数量减少、扩张、肿胀、泡状样改变、核蛋白体往往脱落于胞浆内,细胞收缩变圆变小、失去微绒毛、与邻近细胞脱离,胞浆浓缩。模型各组比较,随打击强度(速度)增大,脑组织受损越严重、病理变化越明显(图2)。
3 脑组织中NGF、BDNF蛋白表达
NGF蛋白免疫组化反应阳性产物表现为棕黄色颗粒状或者点状沉积,主要分布在神经细胞内,以小颗粒为主、部分呈现为聚集分布。A组和E组大鼠损伤脑组织大脑皮质神经元胞浆中NGF呈弱阳性反应。模型各组损伤后脑组织损伤区大脑皮质神经元胞浆中NGF呈强阳性反应,表达明显增多,且随损伤打击速度的增加也依次更多(图3)。
BDNF蛋白免疫组化反应阳性产物表现为棕黄色颗粒状或者点状沉积,主要分布在神经细胞内,以小颗粒为主、部分呈现为聚集分布。A组和E组BDNF免疫组化阳性细胞在大脑皮质部均有少量表达。B、C、D组免疫阳性细胞数目依次增多,免疫阳性物质依次增加(图4)。
4 统计处理及分析
免疫组化图片采用陕西中医学院分子生物与免疫组化实验中心Motic Images Advanced 3.0图像分析系统,检测NGF、BDNF免疫阳性表达物情况,在400倍光镜下随机选择5个相邻视野,计算阳性表达细胞数,取5个视野的平均值。各组所获得的数值用均值±标准差(¯x±s)来表示,采用SPSS17.0软件包进行数据分析,在正态检验和方差齐性检验后,采用单因素方差(One-Way ANOVA)分析,方差齐,组间两两比较采用LSD比较,如方差不齐,用Tamhane’s T2检验。
5 光镜下计算机图像分析结果见表1。
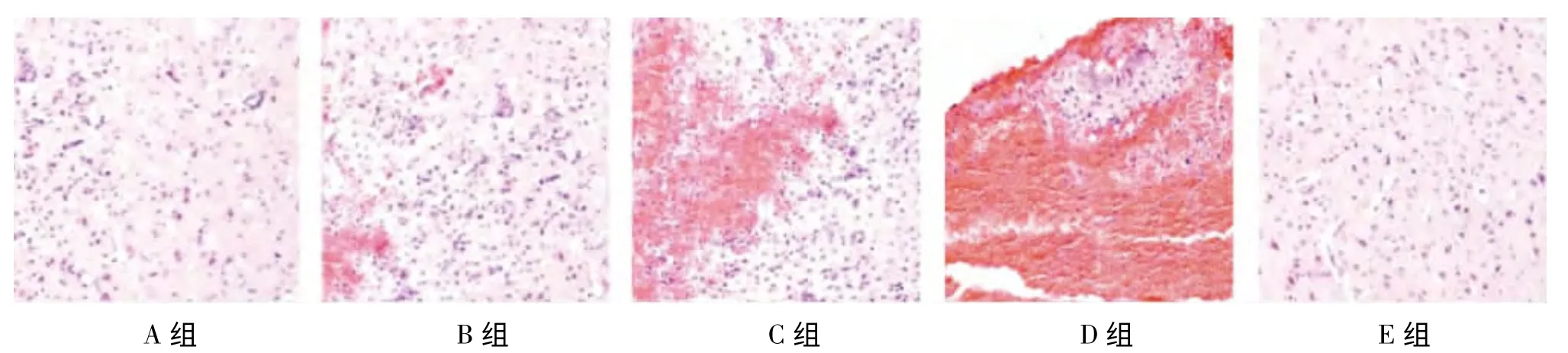
图1 光镜下各组大鼠脑组织出血量情况(×200)
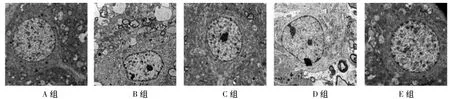
图2 电镜下大鼠脑组织超微结构(×8000)

图3 光镜下各组脑组织皮层NGF的表达(×200)
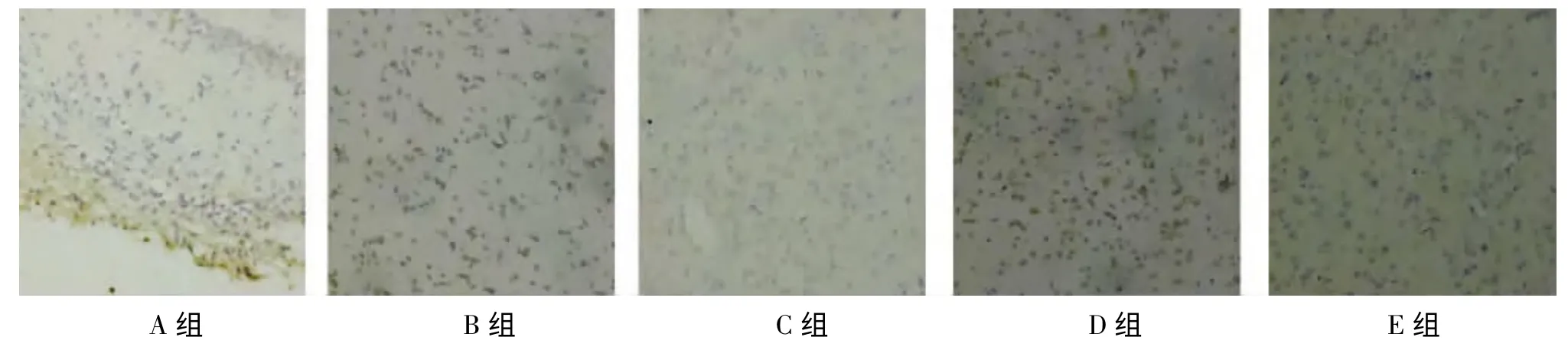
图4 光镜下各组脑组织皮层BDNF的表达(×200)
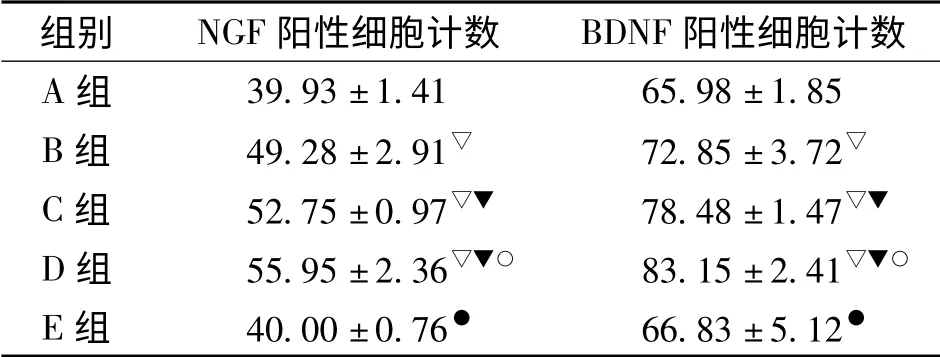
表1 各组SD大鼠脑皮层NGF、BDNF蛋白表达的比较(n=8,¯x±s)
讨 论
生理情况下中枢神经系统(CNS)中神经元的发育、活性、神经递质和激素的水平调节神经营养因子(neurotrophin,NTF)的表达;但TBI发生后,在缺氧、低糖、缺血等条件下可导致皮质和海马NGF和BDNF表达升高;很多研究也证明NTF的反应是防止神经细胞死亡的自身保护机制。NTF能够促进周围及中枢神经元的分化、生长及存活。已经发现的NTF包括NGF、BDNF和神经营养因子Ⅲ、Ⅳ/Ⅴ、Ⅵ等,本研究选择NGF、BDNF作为研究TBI模型制备的观测指标。
NGF是最早发现的典型的神经营养因子,研究最为广泛、深入。NGF在神经细胞的发育、轴突的生长及递质的合成和细胞的凋亡等多个环节中发挥着重要的调控作用,NGF能够促进外周及中枢神经元的分化、生长和存活,在维持大脑正常的生理功能中发挥着极其重要的调节作用[2]。脑损伤后,早期反应基因激活,炎性因子表达上调,从而诱导NGF的表达。Lee等[3]的实验表明NGF与许多中枢和周围神经系统病变密切相关,在学习、记忆、神经细胞损伤后的恢复中起重要的调节作用。Dekosky等[4]研究发现创伤性脑损伤中NGF蛋白在大脑皮质明显增加,其mRNA于伤后1d增加5倍,认为NGF在神经损害后神经再生和修复中起保护作用。近年研究证实[5],NGF能选择性地作用于中枢神经系统,能保护轴突受损的胆碱能神经元免于死亡,还能诱导神经纤维定向生长,控制神经细胞存活的数量和分化,维持成熟神经元的存活,参与受损神经元的修复。病理情况下,NGF还能保护神经元避免损伤,促进受损细胞的存活。BDNF是Heldt等[6]于1982年从猪脑中纯化提取获得的,结构上与神经生长因子相关,是一种小分子二聚体蛋白质,多分布在大脑和海马,在脑内对中枢神经系统的多种类型神经元的生长、发育、分化和再生都具有显著作用并终身维持其功能。BDNF是一种脑保护因子,对神经元起重要保护作用,有利于脑损伤的修复。
本研究为了评价利用eCCI制备的TBI模型效果,进行了组织形态学检测显示造模效果,并进一步使用免疫组化法检测脑组织中NGF、BDNF蛋白表达变化,结果显示空白组和假手术组大鼠损伤脑组织大脑皮质神经元胞浆中NGF、BDNF均呈弱阳性反应,模型各组损伤后脑组织损伤区大脑皮质NGF、BDNF呈强阳性反应,表达明显增多,且随损伤打击速度的增加也依次增强,组间比较有统计学意义,表明利用eCCI制备TBI大鼠动物模型,大鼠脑皮质NGF、BDNF蛋白的含量确有变化且变化和打击的速度有密切的关系。本造模方法具有控制性好、损伤程度能区分、重复性好的优点,同时操作简便,是一种较好的TBI动物模型制备方法,可以广泛应用于TBI的实验研究。
[1]诸葛启钏 主译.大鼠脑立体定位图谱[M].3版.北京:人民卫生出版社,2005:23.
[2]Mobley WC,Rutkowski JL,Tennekoon GI,et al.Choline acetyl-transferase activity in striatum of neonatal rats increased by nerve growth factor[J].Science,1985,229(4710):284.
[3]Lee TH,Kato H,Chen ST,et al.Expression of nerve growth factor and trk A after transient focal cerebral ischemia in rats[J].Stroke,1998,29(9):1687-1697.
[4]Dekosky ST,Goss JR,Miller PD,et al.Upregulation of nerve growth fractor following cortical trauma[J].Exp Neurol,1994,130(2):173-177.
[5]Carpentier PA,Palmer TD.Immune influence on adult neural stem cell regulation and function[J].Neuron,2009,64(1):79-92.
[6]Heldt SA,Stanek L,Chhatwal JP,et al.Hippocampusspecific deletion of BDNF in adult mice impairs spatial memory and extinction of aversive memories[J].Mol Psychiatry,2007,12(7):656-670.
