柠檬酸钙复合材料促进骨腱愈合的实验研究
2015-04-02陈庆玉周英勇赵志蓉
安 涛,陈庆玉,李 苏,周英勇,赵志蓉,彭 磊
骨腱损伤为临床常见运动损伤性疾病,前交叉韧带(ACL)、肩袖、跟腱及髌韧带等与骨接触点损伤最为常见。目前对骨腱损伤行重建手术治疗已成为临床共识,但术后骨腱结合点常不牢固、断裂,致重建手术失败,研究示肩袖损伤术后失败率为20%~94%[1],前交叉韧带为10%~25%[2]。研究表明术后早期骨腱结合处为移植物-骨隧道复合体的薄弱环节[3],因此,肌腱与骨附着部位早期愈合的质量为肌腱移植重建术成败的关键。
目前,促进骨腱愈合研究众多,含生长因子介质填充[4]、重组骨形态发生蛋白(BMP-2)填充等,羟基磷灰石、磷酸三钙[5]等骨移植材料促进骨腱愈合短期效果尚可,但吸收困难、降解性差,疗效不明确。本研究采用可注射型海藻酸钠-明胶-柠檬酸钙复合材料,同时经过反复实验得出各成分最佳比例,并在合适动物实验模型中将复合材料注入骨腱间隙中,研究此种材料对骨腱愈合的作用,为临床治疗骨腱损伤提供新方法。
材料与方法
1 材料
1.1 实验动物 健康成年雄性日本大耳白兔48只,体重3.0~3.5kg,平均(3.3±0.2)kg,温州医科大学实验动物中心提供。
1.2 试剂与仪器 海藻酸钠干粉(美国Sigma公司),明胶干粉(河北绿岛公司),柠檬酸钙(天津市登峰化学试剂厂),电钻(BOSCH电钻,德国罗伯特博世有限公司),钻头(上海医疗器械公司),电子天平(LIBRORAEG-XT220A型,美国)、离心机(京立,LD5-2A,北京),全自动组织切片机(LEICA RM2145,德国)、深低温冰箱(MDF-382E型,SANYO公司)、超净工作台(CA-920-3,上海上净净化设备有限公司)、光学显微镜(Olympus,日本),万能材料力学实验机(Zwick/Roell BTC-FR020TN.A50,德国),显微镜及其摄像机(OLYMPUS B×40显微镜,JVC TK-C1381摄像机)。
2 实验方法
2.1 可注射型柠檬酸钙复合材料的制备 根据文献[6]及前期实验结果,称取明胶1.5g放入20mL生理盐水中,高压灭菌消毒。海藻酸钠1.0g,高压灭菌消毒后备用。无菌间内,在超净台内用生理盐水25mL溶解海藻酸钠1.0g。再将明胶液与海藻酸钠溶液混匀,得到海藻酸钠与明胶质量比为2∶3的胶状液体,静置后,低速离心,使小气泡消失。超净台内抽取上述混合液4mL,加入柠檬酸钙粉末3.0g(最佳质量比,海藻酸钠∶明胶∶柠檬酸钙=2∶3∶70),得到凝固性能最佳,又可良好注入的复合材料。使用时在注射器内搅拌均匀混合成糊状,在5min内使用完毕。
2.2 实验动物模型的建立 腹腔注射10%水合氯醛麻醉(3.5mL/kg),生效后双后肢备皮,仰卧位将动物固定手术台上,常规消毒铺无菌巾单。采用Nakase动物实验模型[7](图1a)。在髌韧带外侧约1cm位置上下各延长约1cm,仔细钝性分离软组织,暴露趾长伸肌腱,向上、下钝性分离,在其止点-股骨外侧髁将其切断,游离的肌腱末端采用4-0缝线行编织缝合(图1b)。然后将胫前肌筋膜切开,将胫前肌向两侧分离,在胫骨干骺端近端垂直于胫骨长轴用电钻钻取直径约2.5mm的孔洞,已经缝合好的肌腱游离末端穿过骨隧道,在胫骨皮质骨嵴垂直胫骨长轴钻取直径为约0.2mm的孔洞,穿过Prolene缝线末端,缠绕固定(取材时已证明固定效果良好)(图1c、d)。将上述制备的可注射型海藻酸钠-明胶-柠檬酸钙采用5mL注射器及19号针头注入右侧骨腱隧道中(以实验动物右侧肢为实验侧,左侧为对照侧),对照侧注射相同剂量的海藻酸钠-明胶共混体。再次聚维酮碘溶液消毒,肌注160万U青霉素预防感染,并予以宽松无菌敷料包扎。术后1周内每天手术刀口聚维酮碘涂抹消毒,肌注80万U青霉素。

图1 实验动物模型建立。a.趾长伸肌腱动物模型;b.游离的肌腱末端Prolene编织缝合;c.采用克氏针行骨隧道造模;d.Prolene线末端胫骨嵴悬吊固定
2.3 标本的获取及检查
分别于术后2、4、6、8、10、12周空气栓塞处死各组动物8只后立即进行取材,取4只骨腱标本,剔除较长的肌腱、周围肌肉、韧带筋膜及其他附着物,沿骨腱界面纵轴切开,在10%中性甲醛溶液固定,用10%的甲酸溶液脱钙、石蜡包埋,沿骨腱界面纵轴面切片,厚度4μm,行HE染色。采用上述方法进行HE染色后,每组随机取2张切片,光镜下每张切片取3个视野(×200),用Image-Pro Plus 8.0图像分析软件观察测量各时间点各组标本中移植肌腱周围每1mm2的新生骨绝对面积。
其余4只保留较长肌腱,游离的趾长伸肌腱末端与胫骨干骺端分别固定于万能材料实验机上,测试前将固定于末端趾长伸肌腱与胫骨前端骨嵴的缝线线结切除,保留胫骨干骺端内侧端的固定,以使负荷作用于骨腱界面,使胫骨干骺端骨腱界面组织成为唯一测试的力,期望断裂点位于胫骨干骺端骨隧道内或是骨腱隧道开口处,行最大拉脱负荷实验(maximum pull-out test),按5mm/min速度加载负荷,最大加载负荷为500N,测试时保持室温(20±2)℃,湿度65%,测试骨腱界面的抗拉脱强度,通过Zwick/Roell软件描记位移-负荷曲线。观察趾长伸肌腱的断裂部位或者是否从骨隧道内拉出,记录断裂负荷或拉脱负荷,此时的力为最大负荷。
3 统计学方法
对实验数据采用SPSS 18.0软件进行统计学处理,配对t检验及独立样本t检验进行统计学分析。以P<0.05为统计学上差异有显著性意义,P<0.01表示差异显著。
结 果
1 组织学观察
柠檬酸钙组2周在柠檬酸钙复合材料周围出现大量成骨细胞;4周时有骨岛出现,骨腱间出现大量Sharpey纤维,骨腱间连接紧密且出现大量软骨细胞;6周时骨腱间出现更为密集且排列有序的Sharpey纤维,并且在骨腱结合处夹杂大量成骨细胞和部分软骨细胞;8周时骨腱间Sharpey纤维集结成束,界面间可见更多的新生骨,组织中含有大量成骨细胞,移植肌腱与新生骨紧密结合形成纤维软骨连接;10周时骨腱结合处大量的新生骨形成,其间绝大部分可见连续性纤维软骨连接,成纤维细胞明显减少,并有少量钙化软骨形成;12周出现大量的钙化软骨,结合处几乎全部有新骨生成及纤维软骨形成,形成直接连接,出现潮线,类似正常的骨腱止点。
而对照侧4周时仅出现少量Sharpey纤维,10周时出现的Sharpey纤维排列才较为密集,12周时骨腱间才仅见少量新骨生成,骨腱间才可见少部分肌腱与周围骨组织呈纤维软骨连接(图2)。
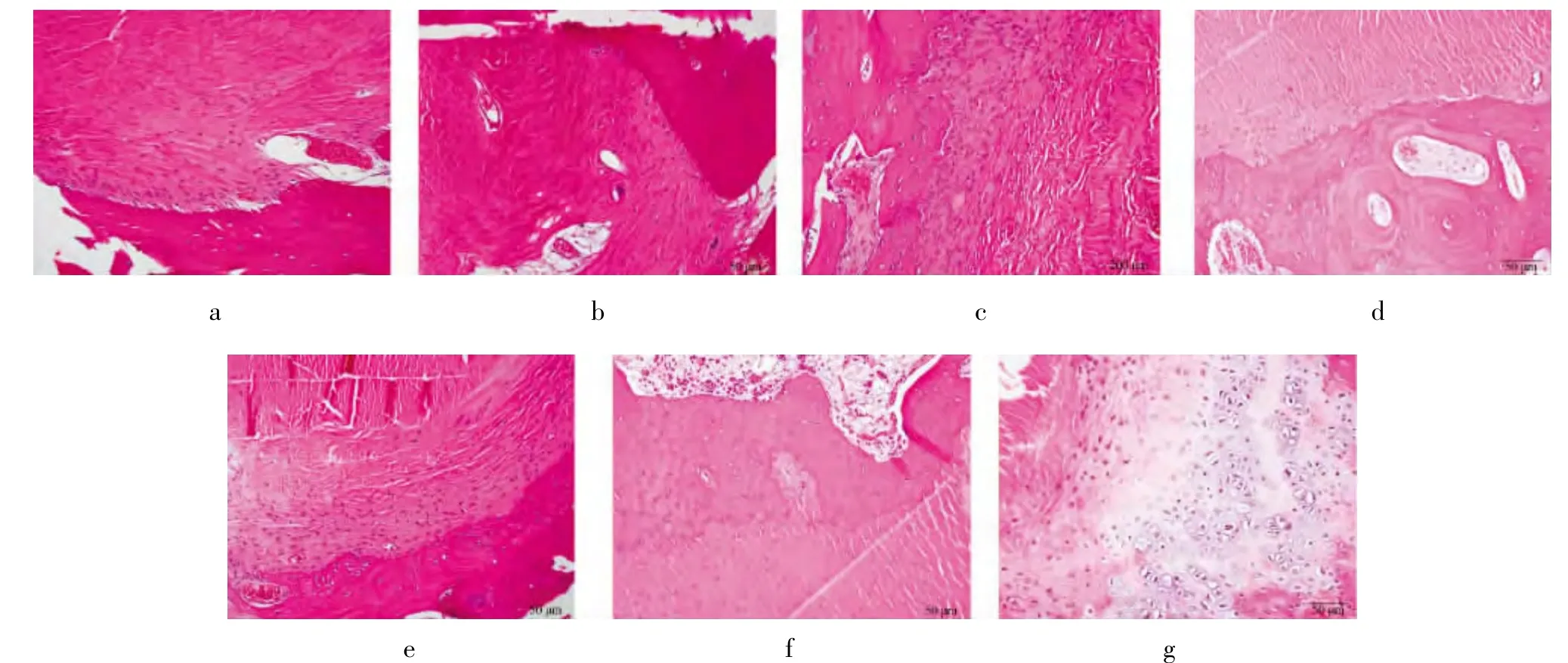
图2 各组各时间点组织学观察结果。a.4周对照组(HE ×100);b.4周实验组(HE ×100);c.10周对照组(HE ×100);d.10周对照组(HE ×100);e.12周对照组(HE ×100);f.12周对照组(HE ×100);g.4周实验组骨腱间可见大量软量细胞增生
2 成骨面积分析
从表1可以看出,肌腱周围新生骨面积在柠檬酸钙实验组明显比对照组多,在各个时间节点具有差异性,并且这种差异性随着时间的延长逐渐减少,这说明柠檬酸钙对新生骨形成具有促进作用,这种促进作用在早期较为明显。
3 生物力学实验测试
在6周内无论实验侧还是对照侧,拉出部位均在胫骨干骺端隧道内;其余时间点断裂部位或拉出部位在各组不完全相同(表2)。实验侧和对照侧在各时间节点生物力学检查其抗拉脱强度不同,实验侧在2、4、6周时间节点与对照侧相比具有更大的抗拉脱强度(P<0.01),8周以后伴有少部分为韧带实质部断裂而非拉脱(pull-out)。以上表明,柠檬酸钙对骨腱愈合具有促进作用,能增加骨腱的抗拉脱强度,但柠檬酸钙对骨腱抗拉脱的贡献主要在早期(表3)。

表1 移植肌腱新生骨面积(mm2)

表2 柠檬酸钙组重建韧带拉脱或断裂部位

表3 生物力学实验强度(N)
讨 论
笔者课题组前期已证实柠檬酸钙为一种优良的骨生物材料[8-11]:(1)对成骨细胞有正性作用:明显促进成骨细胞、骨髓基质干细胞增殖、分化;(2)良好骨传导活性:促进兔股骨原位骨缺损良好修复;(3)良好降解性:小鼠肌袋实验中,6周全部降解,明显促进肌肉内骨形态发生蛋白(BMP)所致异位成骨;(4)促进异位成骨性:大量促进大鼠跟腱切断术所致异位成骨,新生骨长入跟腱中,骨腱结合紧密,出现大量软骨细胞。据此,笔者推断柠檬酸钙极有可能成为良好的天然骨腱修复材料促进剂。柠檬酸钙粉末较难填充于骨腱隧道中,且易导致分布不均,局部浓度过高导致毒性。海藻酸钠分子链上含有大量的羟基和羧基,在Ca2+等二价离子存在的条件下,可形成交联的海藻酸钠钙聚合物,表现为凝胶状态[12],具有很好的机械强度,便于成形。明胶具有亲水性强、成膜性好、侧链基团反应活性高、典型的两性电解质特征等诸多优良的物理与化学性质,能溶于热水,冷却后冻成凝胶状物。因此,本研究拟采用海藻酸钠与明胶作为可注射复合材料的固形剂。
韧带或者腱的止点根据其结构不同可以分为直接止点(纤维软骨止点)和间接止点(纤维止点)。直接止点多位于干骺端,有纤维组织、纤维软骨、钙化软骨、骨组织典型的四层结构,纤维软骨和钙化软骨之间有嗜碱性染色的潮线[13]。正常骨腱止点为典型末端结构,即为上述的直接止点,这类止点存在平行的胶原纤维和纤维软骨,其线性垂直的结构可以有效传递拉力。因此,在骨腱重建术后,移植肌腱在骨髓道内最理想的愈合方式应与正常的骨腱止点类似。在本实验中,对照侧4周时仅出现少量Sharpey纤维,10周时出现的Sharpey纤维排列才较为密集,12周时骨腱间才仅见少量新骨生成,骨腱间可见少部分肌腱与周围骨组织呈纤维软骨连接。实验组骨腱间4周时有骨岛出现,骨出现大量Sharpey纤维和大量软骨细胞;8周时移植肌腱与新生骨紧密结合形成纤维软骨连接;10周时骨腱绝大部分可见连续性纤维软骨连接,并有少量钙化软骨形成;12周出现呈钙化软骨,结合处几乎全部有新骨生成及纤维软骨形成,形成直接连接,出现潮线,类似正常的骨腱止点。实验组Sharpey纤维、纤维软骨、钙化软骨出现明显早于对照侧,且骨腱间间隙实验组比同期对照组明显减小,说明可注射型海藻酸钠-明胶-柠檬酸钙对骨腱愈合具有明显的促进作用,对骨腱间的愈合更易形成直接连接,使其更接近正常状态下骨腱结合部位的组织学结构特点。
研究表明:5mmol/L的Ca2+浓度为最佳钙离子成骨浓度[14],而柠檬酸钙释放的Ca2+浓度为5.1mmol/L,理论上符合最佳成骨浓度要求,可有效促进成骨。Ca2+也可刺激分泌类胰岛素样生长因子(IGF-1/2)等促分裂因子,促进胶原矿化,促进成骨细胞及肌腱细胞生长[15-16]。Ca2+促进分泌的BMP可促进、诱导骨生成及纤维结缔组织增生,使骨组织向肌腱内长入形成直接愈合,同时BMP在肌腱内可诱导成骨,加速损伤肌腱愈合[17]。骨腱愈合过程比较复杂,基本过程是骨腱愈合界面纤维组织形成连接,新骨形成,骨向肌腱内长入,局部塑型改造。柠檬酸钙组肌腱周围新生骨面积明显比对照组多,在各个时间节点具有差异性,这说明柠檬酸钙对新生骨形成具有促进作用。生物力学实验提示术后6周内,实验侧骨腱愈合抗牵拉强度明显高于对照侧,能增加骨腱的抗拉脱强度,说明柠檬酸钙对骨腱愈合具有促进作用。因此可以推断,可注射型柠檬酸钙对骨腱愈合的促进作用可能通过促进新生骨形成,新生骨进而长入移植肌腱组织,从而增强骨腱愈合的强度。
本实验动物模型为关节外动物模型,没有打开关节腔,与国内外广泛采用的ACL重建术动物模型不同,无关节液、滑液等的影响,毕竟关节内与关节外的生理环境具有较大的差异,柠檬酸钙凝胶在关节内动物模型中是否具有同样作用,需进一步研究。
[1]Galatz LM,Ball CM,Teefey SA,et al.The outcome and repair integrity of completely arthroscopically repaired large and massive rotator cuff tears[J].JBone Joint Surg(Am),2004,86-A(2):219-224.
[2]Vergis A,Gillquist J.Graft failure in intra-articular anterior cruciate ligament reconstructions:a review of the literature[J].Arthroscopy,1995,11(3):312-321.
[3]Chen CH.Strategies to enhance tendon graft-bone healing in anterior cruciate ligament reconstruction[J].Chang Gung Med J,2009,32(5):483-493.
[4]Sasaki K,Kuroda R,Ishida K,et al.Enhancement of tendon-bone osteointegration of anterior cruciate ligament graft using granulocyte colony-stimulating factor[J].Am JSports Med,2008,36(8):1519-1527.
[5]Huangfu X,Zhao J.Tendon-bone healing enhancement using injectable tricalcium phosphate in a dog anterior cruciate ligament reconstruction model[J].Arthroscopy,2007,23(5):455-462.
[6]夏扬.海藻酸钠一明胶共混体系为载体的可注射式组织工程骨的研究[D].中国协和医科大学博士研究生毕业论文,2008.
[7]Nakase J,Kitaoka K,Matsumoto K,et al.Facilitated tendon-bone healing by local delivery of recombinant hepatocyte growth factor in rabbits[J].Arthroscopy,2010,26(1):84-90.
[8]Zhang W,Wang W,Chen QY,et al.Effect of calcium citrate on bone integration in a rabbit femur defect[J].Asian Pacific J Tropical Med,2012,15(4):310-314.
[9]Ying XZ,Cheng SW,Wang W,et al.Effect of boron on osteogenic differentiation of human bone marrow stromal cells[J].Biol Trace Elem Res,2011,144(1-3):306-315.
[10]Wang W,Chen QY,Li XC,et al.Enhancement of bone formation with a synthetic matrix containing bone morphogenetic protein-2 by the addition of calcium citrate[J].Knee Surg Sports Traumatol Arthrosc,2013,21(2):456-465.
[11]Cheng SW,Wang W,Lin ZQ,et al.Effects of extracellular calcium on viability and osteogenic differentiation of bone marrow stromal cells in vitro[J].Human Cell,2013,26(3):114-120.
[12]郑洪河,张虎成,夏志清,等.海藻酸钠溶液的粘度性质与流变学特征[J].河南师范大学学报(自然科学版),1997,25(2):55-59.
[13]Francois RJ,Braun J,Khan MA.Entheses and enthesitis:a histopathologic review and velevance to spondycoarthritides[J].Curr Opin Rheumatol,2001,13(4):255-264.
[14]Maeno S,Niki Y,Matsumoto H,et al.The effect of calcium ion concentration on osteoblast viability,proliferation and differentiation in monolayer and 3D culture[J].Biomaterials,2005,26(23):4847-4855.
[15]Sugimoto T,Kanatani M,Kano J,et al.IGF-I mediates the stimulatory effect of high calcium concentration on osteoblastic cell proliferation[J].Am J Physiol,1994,266(5 Pt 1):E709-716.
[16]Honda Y,Fitzsimmons R,Baylink DJ,et al.Effects of extracellular calcium on insulin-like growth factor II in human bone cells[J].J Bone Miner Res,1995,10(11):1660-1665.
[17]Forslund C.BMP treatment for improving tendon repair.Studies on rat and rabbit Achilles tendons[J].Acta orthop Scand,2003,74(308):1-30.
