腹腔镜辅助结直肠癌手术并发症的临床调查研究
2015-03-27邱绪文王祖斌
邱绪文,王祖斌
(松滋市人民医院,湖北 荆州,434200)
结直肠癌是消化系统常见的恶性肿瘤之一,仅次于胃癌,居于恶性肿瘤发病率的第三位,近年其发病率有升高趋势[1]。其发生发展影响因素较多,如遗传因素、饮食习惯及慢性炎症等都可能诱发结直肠癌。临床检查结合患者体检及影像学、内窥镜等手段,诊出率较高,可达90%以上。结直肠癌的治疗以手术切除为主,并结合放化疗。随着微创技术的发展,腹腔镜技术越来越广泛的应用到手术当中,目前腹腔镜辅助结直肠癌手术是治疗结直肠癌的常用成熟技术[2],自1991年腹腔镜首次成功引入结直肠癌手术以来,腹腔镜辅助结直肠癌手术取得了较大进展,但手术伴随的并发症对患者的治疗结果具有至关重要的作用。腹腔镜辅助结直肠癌手术虽然一定程度上提高了疗效,但其带来的并发症也不容忽视。本研究通过选取2012年4月至2014年4月我院收治的腹腔镜辅助结直肠癌手术患者为研究对象,对其并发症进行调查分析,旨在探讨其发生原因及风险因素,并提出预防对策,提高治疗效果。现报道如下。
1 资料与方法
1.1 临床资料 随机选取2012年4月至2014年4月我院收治的腹腔镜辅助结直肠癌手术患者118 例为研究对象,其中男65 例,女53 例;34~78 岁,平均(62.8 ±11.7)岁。术前患者均经组织病理学及肠镜检查确诊为结直肠癌。其中升结肠癌7 例,降结肠癌5 例,结肠肝曲癌4 例,结肠脾曲癌4例,回盲部癌8 例,乙状结肠癌26 例,直肠癌64 例。病理检查显示:高分化癌17 例,中分化癌59 例,低分化癌42 例。按肿瘤结直肠癌Dukes 分期分类:A 期15 例,B 期53 例,C期42 例,D 期8 例。患者无术前急性出血、穿孔及肠梗阻等症状,并排除感染、心肺功能障碍及凝血障碍等影响手术、结果观测的疾病患者。
1.2 手术方法 均按照结直肠癌手术规范施术,遵循全直肠系膜切除(total mesorectal excision,TME)原则施行根治手术,D 期行姑息性手术。术前予以流质食物并配合缓泻剂进行清肠处理。采用气管插管与静脉复合麻醉,左半结肠、右半结肠切除时,患者取仰卧人字形体位,头高脚低,Dixon 术、Miles 术及乙状结肠癌等手术时,患者取头低脚高。脐上做1 cm切口,穿刺10 mm Trocar,建立CO2气腹,压力维持在13 mmHg,置入腹腔镜探查。分别于平脐中线、髋前穿刺5 mm、10 mm Trocar。用超声刀切开腹膜,分离肠系膜下动脉,并将肿瘤肠管周围血管、韧带等分离结扎,游离结肠,将脐部穿刺孔延长5 cm,用塑料保护膜保护切口,提取横结肠,采用直线切割闭合器切除肿瘤肠管,并放置吻合器进行衔接吻合,吻合成功后,闭合残端,放置腹腔引流管,于盆底引流,检查有无活动性出血,并清点器械,切除气腹并逐层关闭腹腔。术中、术后密切监视患者体征,术后予以抗感染预防治疗。
1.3 收集指标 记录患者年龄、性别、身体质量指数、合并症、肿瘤大小、分期及手术完成情况,并观察术后并发症发生情况,包括术后出血、感染、吻合口漏及梗阻等。
1.4 统计学处理 所有数据采用SPSS 16.0 软件进行相关分析,采用logistic 回归进行多因素分析,计量资料采用t 检验,以(±s)表示,计数资料采用χ2检验,P <0.05 为差异有统计学意义。
2 结 果
2.1 并发症发生情况 118 例腹腔镜辅助结直肠癌手术患者中22 例发生并发症,发生率为18.6%。其中盆腔感染1 例,泌尿系统感染2 例,切口感染5例,气腹征2 例,低蛋白血症2 例,吻合口漏6 例,肠梗阻4 例,术后出血3 例;3 例患者同时出现两种以上并发症。
2.2 并发症相关单因素分析 单因素分析结果见表1。影响术后并发症的因素有年龄、体重指数、合并糖 尿 病,P 值 分 别 为0. 032、0. 004、0. 017,P<0.05,而患者性别、肿瘤大小、Dukes 分期及手术时间等对手术并发症的发生影响不显著。
2.3 logistic 多因素分析 在单因素分析的基础上进行logistic 多因素回归分析,结果见表2。结果显示年龄、体质量指数、合并糖尿病是腹腔镜辅助结直肠癌手术并发症发生的独立危险因素,其中年龄的OR 在4.942,可信区间为1.643~17.512,体质量指数OR 在6.426,可信区间在1.851~21.639,合并糖尿病OR 在5.413,可信区间在1.349~20.478,见表2。
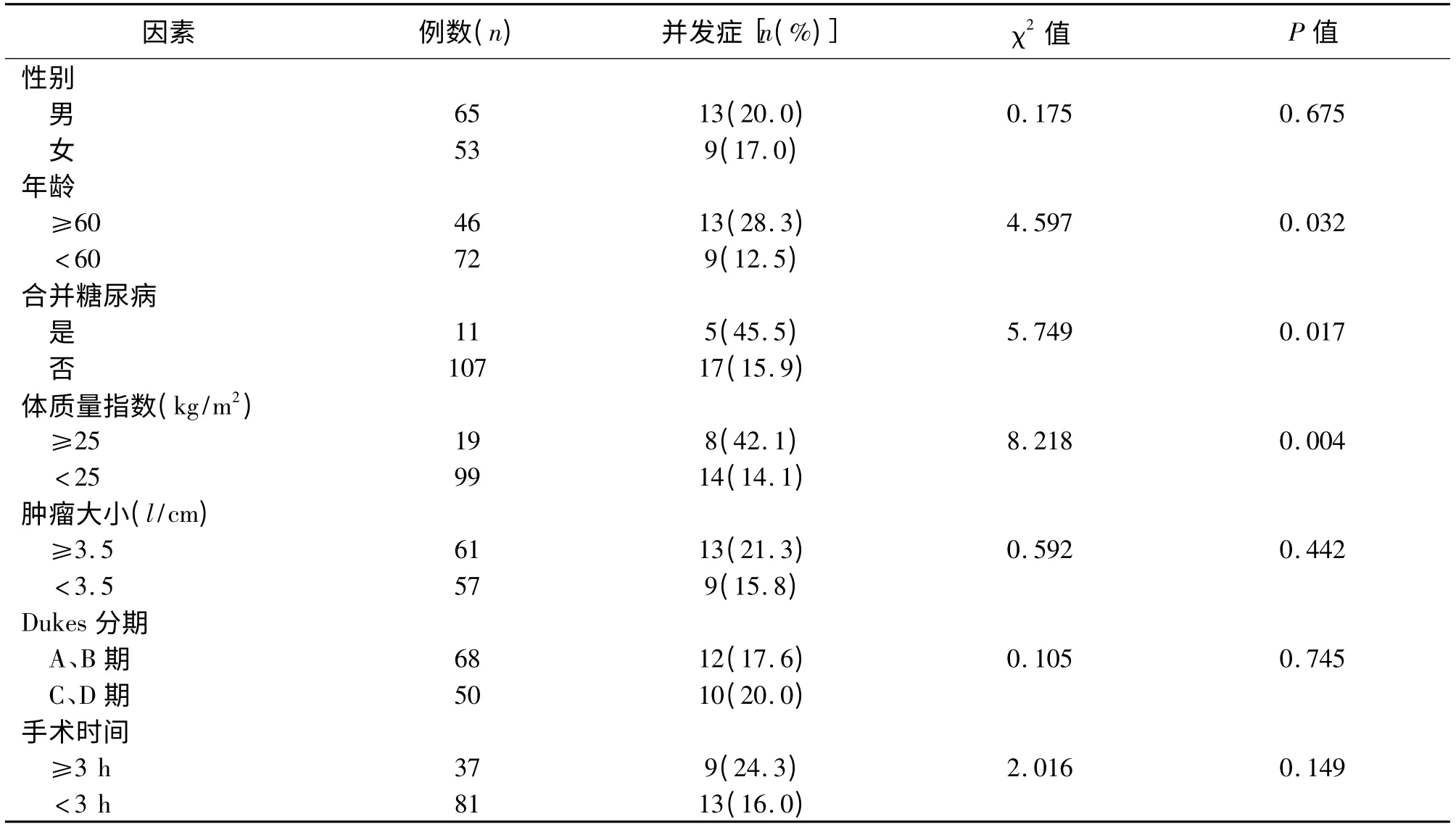
表1 并发症相关单因素分析结果

表2 并发症logistic 多因素回归分析
3 讨 论
随着微创技术的发展,腹腔镜越来越广泛地应用到临床手术治疗中,目前腹腔镜辅助结直肠癌手术是治疗结直肠癌的常用成熟技术,与传统开腹手术相比,其安全性、疗效均有一定提高,腹腔镜辅助结直肠癌创伤小、切口小,减轻了患者的身体负担,术后康复快,因此已成为结直肠癌的主流术式[3]。但临床手术并发症也是影响治疗效果的一大因素。因此,对腹腔镜辅助结直肠癌手术并发症的调查分析对临床治疗具有重要作用。腹腔镜辅助结直肠癌手术较常见的并发症主要有感染,包括切口感染、盆腔感染、泌尿系统感染、肺部感染、吻合口出血、吻合口漏、低蛋白血症及肠梗阻,还有腹腔镜特有的气腹征、穿刺损伤等[4]。而影响并发症发生的因素较多,患者年龄、性别及身体状况、病情严重程度等均可能产生影响,具体了解哪些因素是腹腔镜辅助结直肠癌手术并发症的高危因素,对进一步预防与治疗具有重要作用。
本研究通过随机选取我院近两年收治的118 例腹腔镜辅助结直肠癌手术患者为研究对象,对其临床资料进行回顾性分析。结果显示,118 例腹腔镜辅助结直肠癌手术患者,共22 例发生并发症,发生率为18.6 %。其中3 例同时出现两种并发症,分别为切口感染合并吻合口漏,泌尿系统感染合并术后出血,术后出血合并吻合口漏,吻合口漏并发症发生率最高,占总患者的5. 1%,其次为切口感染,占4.2%,肠梗阻、术后出血比例分别为3. 4% 与2.5%,气腹征、其他感染也有发生,但比例相对较低。研究报道,吻合口漏是结直肠癌术后较严重的并发症之一,主要原因为吻合口张力过大,吻合器吻合不当,术前准备不充分,吻合口血运障碍及患者自身的愈合能力低等。对患者年龄、性别、合并症、肿瘤大小、Dukes 分期、手术时间及体重指数等可能影响并发症的因素进行单因素分析,结果发现患者年龄、体重指数及合并糖尿病是影响手术并发症的主要因素(P <0.05),其他因素影响不显著。对显著影响的因素进行logistic 回归分析,年龄、体重指数、合并糖尿病是独立危险因素,这与国内外较多文献报道一致[5]。随着年龄的增长,身体各机能逐渐衰退,自身免疫、修复系统功能降低,创伤愈合能力差,因此大于60 岁的患者并发症发生率较高,这与Kapritsou 等[6]的研究结果一致。体重指数≥25 kg/m2的患者多为肥胖人群,脂肪较多影响身体代谢,容易导致“三高”症状,肥胖患者腹部脂肪堆积,影响手术操作视野,增大手术操作误差,因此术后并发症发生率也较高[7-8],这与O'Connor 等[9]报道的超重患者较普通患者、消瘦患者并发症发生率高等研究结果相符。本研究结果显示患者合并糖尿病更容易发生并发症,这与国外研究报道一致。糖尿病是一种复杂性疾病,对机体的正常代谢可产生较大影响,容易导致内分泌失调、代谢紊乱等,进而影响各脏器功能,从而产生较多并发症,这与Law 等[10]的研究结果一致。
综上所述,在预防、处理腹腔镜辅助结直肠癌手术并发症时应考虑并发症的高危因素,对于老年患者、肥胖患者、糖尿病患者应密切监视手术及术后状态,严格无菌操作,并及时更换切口药物、冲洗切口,加强围手术期监控,对独立危险因素加强防范,进一步降低并发症发生率。
[1]Son HJ,Lee HY,Park JW,et al.Cost-comparison of laparoscopic and open surgery for mid or low rectal cancer after preoperative chemoradiotherapy:data from a randomized controlled trial[J].World J Surg,2013,37(12):214-219.
[2]Weeks JC,Nelson H,Gelber S,et al.Short term quality of life outcomes following laparoscopic assisted colectomy vs open colectomy for colon cancer:a randomized trial. Clinical Outcomes of Surgical Therapy (COST)Study Group[J]. JAMA,2002,287(3):321-328.
[3]Canda AE,Terzi C,Gorken IB,et al.Effects of preoperative chemoradiotherapy on anal sphincter functions and quality of life in rectal cancer patients[J].Int J Colorectal Dis,2010,25(21):197-204.
[4]涂胜利,叶兆云,周思川,等.造瘘相关并发症及其影响相关因素分析[J].中华胃肠外科杂志,2003,6(3):157-160.
[5]洪建莎,张策萌,杨柳温,等.腹部联合脏器切除的主要并发症及防治[J].中国药物杂志,2005,15(17):2158-2160.
[6]Kapritsou M,Korkolis DP,Konstantinou EA.Open or laparoscopic surgery for colorectal cancer:a retrospective comparative study[J].Gastroenterol Nurs,2013,36(7):37-41.
[7]Fujimoto Y,Akiyoshi T,Kuroyanagi H,et al.Safety and feasibility of laparoscopic intersphincteric resection for very low rectal cancer[J].J Gastrointest Surg,2010,14(8):645-650.
[8]Luna-Pérez P,Rodríguez-Ramírez SE,Gutiérrez de la Barrera M,et al.Multivariate analysis of risk factors associated with dehiscence of colorectal anastomosis after anterior or lower anterior resection for sigmoid or rectal cancer[J].Rec Invest Clin,2002,54(6):501-508.
[9]O'Connor G,Coates V,O'Neill S.Exploring the WCJD information needs of patients with cancer of the rectum[J].Eur J Oncol Nurs,2010,14(3):271-277.
[10]Law WL,Chu KW,Ho JW,et al.Risk factors for anastomotic leakage after low anterior resection with total mesorectal excision[J].Am J Surg,2000,179(2):92-95.
