腹腔镜巨脾切除术的临床疗效分析*
2015-03-27郑佳隆黄鹤光陈燕昌陆逢春林贤超林荣贵杨媛媛
郑佳隆,黄鹤光,陈燕昌,陆逢春,林贤超,林荣贵,杨媛媛
(福建医科大学附属协和医院,福建 福州,350001)
自1991年我国第一例腹腔镜手术[1]成功开展,经过二十余年的发展,腹腔镜手术发生了巨大的变化,其创伤小、术后康复快、住院时间短等优点使其在全国绝大多数医院得到广泛开展,且为外科医生普遍接受。而腹腔镜脾脏切除也已普及,目前腹腔镜脾切除术(laparoscopic splenectomy,LS)已成为特发性血小板减少性紫癜(idiopathic thrombocytopenic purpura,ITP)、遗传性球形红细胞增多症、地中海贫血等血液病、原发或继发性脾脏肿瘤及其他原因引起的脾功能亢进等脾脏疾病的常规术式。既往巨脾(≥20 cm)是LS 的绝对禁忌证,但随着腹腔镜技术的不断发展及手术器械、设备的不断改进,腹腔镜巨脾切除术也已在临床得到开展[2]。本文现对我院开展的腹腔镜巨脾切除术进行临床分析。
1 资料与方法
1.1 临床资料 2008年5月31日至2014年10月9日我院施行LS 77 例,以脾脏长径是否≥20 cm 分为非巨脾组(n=64)与巨脾组(n=13)。非巨脾组中男25 例,女39 例;10~68 岁;巨脾组男5 例,女8 例;14~75 岁。同时回顾了同期施行的74 例开腹巨脾切除的临床资料,归为开腹组(n =74)。将各组病种分为血液病(ITP、自身免疫性溶血性贫血、地中海贫血、白血病等)、肿瘤类(脾脏淋巴管瘤、脾脏炎性假瘤、脾脏淋巴瘤等)、肝硬化及其他(Evan 综合征、脾脏硬化性血管瘤样结节性转化及原因不明等)四种。其手术方式主要根据术者对患者病情分析的临床经验及患者的要求进行选择。巨脾组与非巨脾组性别、年龄、疾病、联合手术等方面差异无统计学意义。巨脾组与开腹组年龄、性别差异无统计学意义,而巨脾组疾病种类以血液病为主,开腹组以肝硬化为主,两者差异有统计学意义。开腹组联合贲门周围离断术较多,与巨脾组差异有统计学意义。3组患者性别、年龄、疾病、联合手术等方面的对比见表1、表2。
表1 巨脾组与非巨脾组患者基本资料的比较(±s)
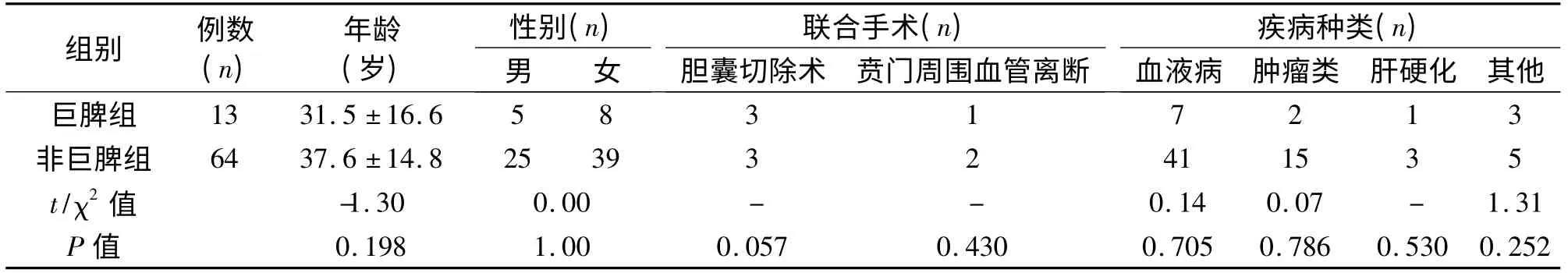
表1 巨脾组与非巨脾组患者基本资料的比较(±s)
注:-表示应用Fisher 的精确检验,不存在χ2 值。
?
表2 巨脾组与开腹组患者基本资料的比较(±s)
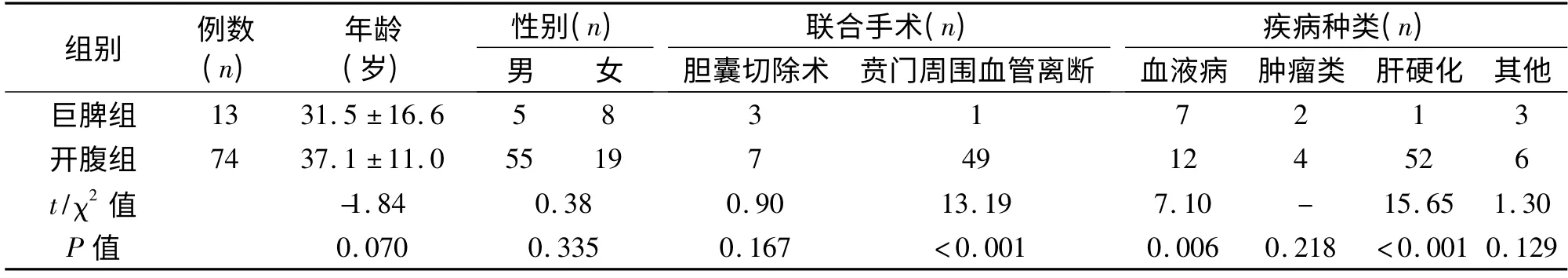
表2 巨脾组与开腹组患者基本资料的比较(±s)
注:-表示应用Fisher 的精确检验,不存在χ2 值。
?
1.2 手术方法 气管内插管静脉复合麻醉,常规导尿。麻醉成功后患者取平卧位,常规消毒铺巾,术者及持镜者立于患者右侧,助手立于患者左侧。下腹正中偏右取10 mm 切口做观察孔,建立气腹,压力维持在12~14 mmHg,穿刺一次性10 mm Trocar,置入腹腔镜,探查腹腔情况,直视下根据脾脏大小选择另外4 个操作孔(于右中腹取2 个5 mm 切口,左下腹取5 mm、10 mm 小切口,分别穿刺相应Trocar),置入超声刀、抓钳、吸引器,再次仔细探查腹腔情况。挑起脾脏下极,用超声刀于脾脏下极分离脾结肠韧带,将脾脏向内翻转,向上分离脾肾韧带至脾脏上极,并分离脾膈韧带。助手用抓钳将胃牵拉至右上方,暴露脾胃韧带,用超声刀自胃大弯中上部逐步分离脾胃韧带至脾脏上极(图1),用Hem-o-lok 夹闭胃短血管胃侧端,显露脾蒂。用超声刀初步分离脾蒂,离断脾蒂周围组织(图2),将胰尾从脾门后方游离。分别采用非解剖脾蒂离断或解剖脾蒂离断两种方法离断脾门,非解剖脾蒂离断法即游离出脾蒂后不解剖其血管及分支,用腔镜直线型切割闭合器切割钉合脾蒂;解剖脾蒂离断法即显露脾蒂后,在腔镜直视下解剖脾动静脉二级分支,分别用Hem-o-lok或钛夹夹闭脾动静脉二级分支及主干后超声刀离断脾蒂(图3、图4)。完全游离脾脏后将脾脏装入标本袋,取绕脐切口长3~4 cm,逐层入腹,取出脾脏(图5),关闭切口。用温生理盐水冲洗腹腔,仔细检查有无活动性出血,清点器械纱布无误,脾窝常规放置中号硅管引流(见图6),退出腔镜器械及Trocar,依次缝合各手术切口。
1.3 观察指标 记录各病例手术时间、术中出血量、术后恢复进食时间、术后住院时间及术后并发症。
1.4 统计学处理 将巨脾组、非巨脾组及同期开腹组的临床资料进行比较。用SPSS 13.0 统计软件包进行数据分析,计量资料(脾脏长径、手术时间、术中出血、术后恢复进食时间、术后出院时间)采用t 检验、计数资料(并发症、中转开腹)采用χ2检验进行组间比较。
2 结 果
本研究中三组均无死亡病例。与非巨脾组相比,巨脾组手术时间长、术中出血多、术后住院时间长。与开腹组相比,巨脾组术后恢复进食时间及术后住院时间短。见表3、表4。巨脾组5 例患者发生并发症,其中肺炎4 例(30.8%),继发性血小板增多症1 例(7.7%);非巨脾组13 例患者发生并发症,其中肺炎10例(15. 6%),腹腔感染1例(1.6%),继发性血小板增多症2 例(3.1%);开腹组33 例患者出现并发症(其中有的患者出现多项并发症),其中肺炎27 例(36.5%),腹腔感染1 例(1.4%),泌尿系感染1 例(1.4%),切口感染3 例(4.1%),继发性血小板增多症2 例(2.7%),脾静脉血栓2 例(2.7%),胰瘘1 例(1.4%),术后出血2例(2.7%)。三组术后并发症发生率均较高,其中巨脾组与非巨脾组(χ2=1.10,P =0.294)及巨脾组与开腹组(χ2=0.012,P =0.914)的术后并发症发生率差异均无统计学意义,而非巨脾组与开腹组(χ2=8.046,P =0.005)相比,术后并发症明显降低,差异有统计学意义。
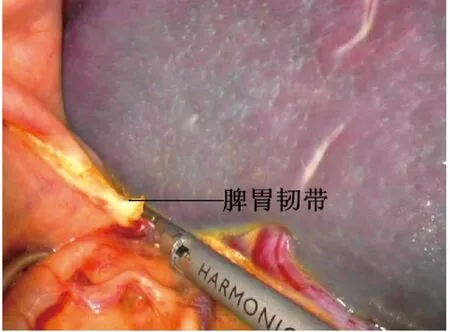
图1 用超声刀分离脾胃韧带至脾脏上极
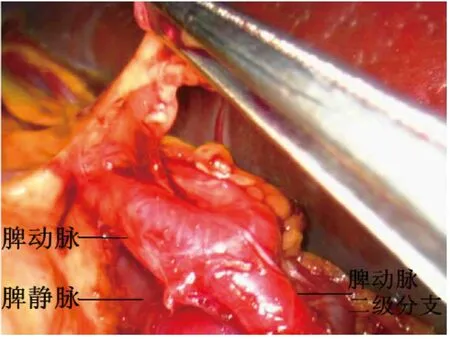
图2 分离脾周组织显露脾蒂
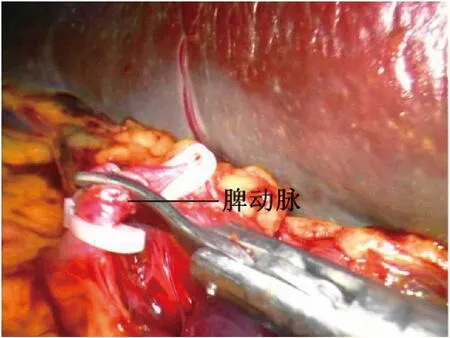
图3 预先断扎脾动脉
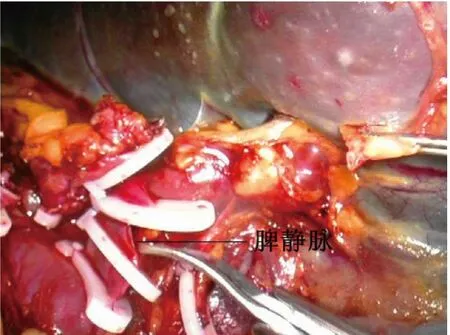
图4 解剖脾蒂断扎脾静脉
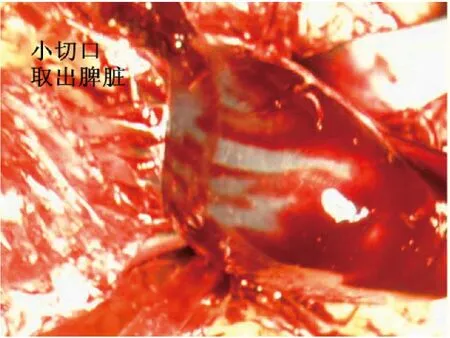
图5 小切口取出脾脏组织
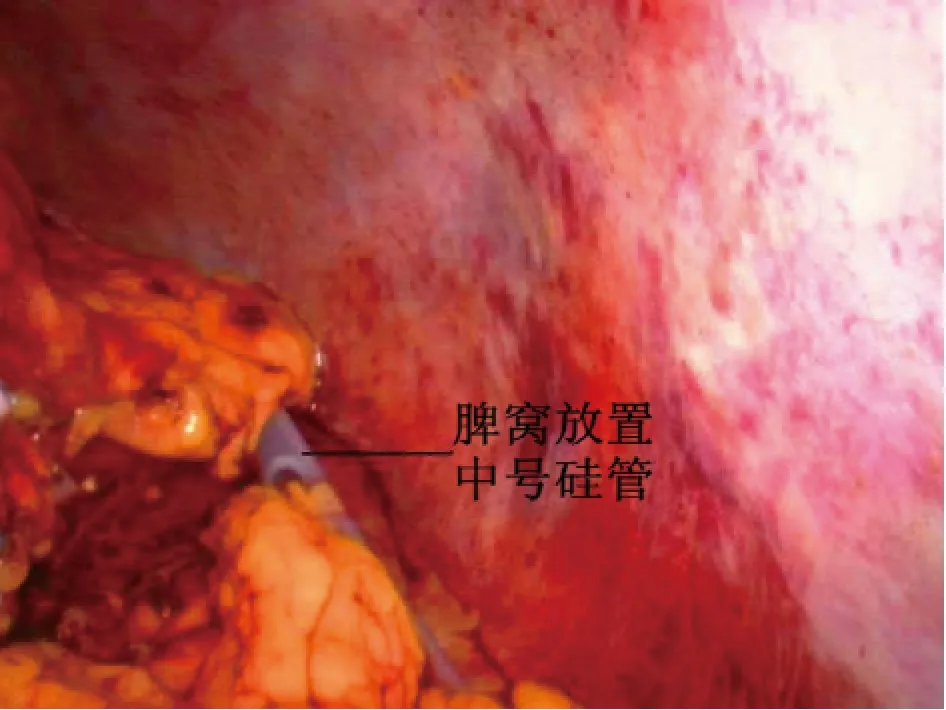
图6 脾窝放置中号硅管
表3 巨脾组与非巨脾组患者临床结果的比较(±s)
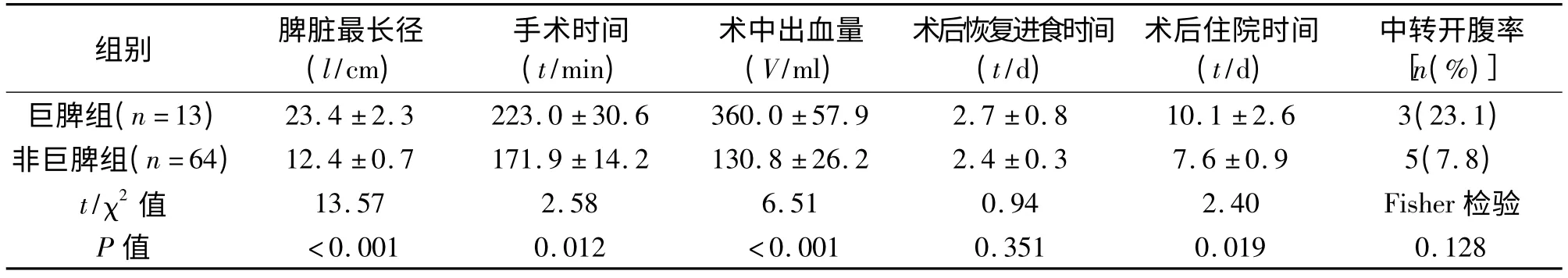
表3 巨脾组与非巨脾组患者临床结果的比较(±s)
?
表4 巨脾组与开腹组患者临床结果的比较(±s)
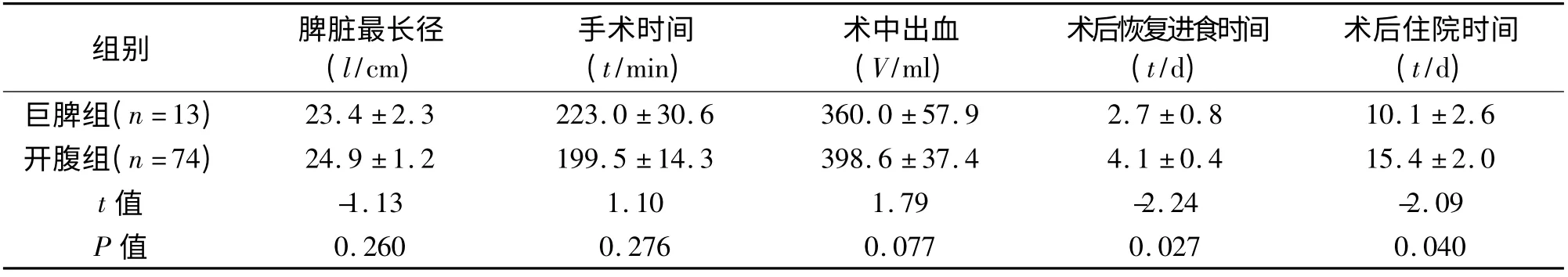
表4 巨脾组与开腹组患者临床结果的比较(±s)
?
3 讨 论
自1992年Delaitre 等[3]首次报道LS 以来,创伤小、术后康复快、住院时间短等优点使其成为血液病脾切除的金标准,也是原发或继发性脾脏肿瘤及其他原因引起的脾功能亢进等非巨脾疾病的常规术式。
巨脾[4](脾脏长径≥20 cm 或质量>1 000 g 的脾脏,由于临床切脾过程中脾脏组织及脾脏血液的流失导致对脾脏质量的估计偏小,因此一般以脾脏的长径≥20 cm 为依据)曾被认为是LS 的绝对禁忌证,但随着腹腔镜技术的不断发展及手术器械、设备的不断改进,腹腔镜巨脾切除术已陆续开展,并取得不错的效果。
3.1 可行性与安全性 本研究中,巨脾组手术时间及术中出血与开腹组相比差异无统计学意义,术后进食时间及术后出院时间较开腹组短,差异有统计学意义,切口并发症存在明显优势。从临床结果可见,与开腹巨脾切除相比,腹腔镜巨脾切除切口小、术后恢复进食快,术后住院时间短,无死亡病例,手术时间及术中出血差异无统计学意义,可见其可行性、安全性及疗效是令人满意的。
3.2 中转开腹 本研究中,巨脾组中转开腹3 例(23.1%),非巨脾组中转开腹5 例(7.8%),中转开腹的主要原因为术中大出血及脾蒂分离困难。由于巨脾患者具有腹腔操作空间小,脾脏张力大、质地脆,脾门及周围血管曲张、病理血管多等特点,腹腔镜巨脾切除术中大出血的风险往往较非巨脾患者高。在游离脾脏周围韧带时,暴力牵拉或抓持脾脏容易引起脾被膜撕裂及脾脏实质损伤出血,因此操作时必须轻柔,使用无损伤钳“抬、拨”脾脏,避免暴力“抓、拉”。解剖脾蒂时避免用力牵拉,造成脾静脉壁撕裂出血,仔细分离脾蒂,用Hem-o-lok 或钛夹夹闭分支血管,避免损伤侧支血管引起出血。如使用直线切割吻合器处理脾蒂,尽量避免直线切割闭合器反复试插脾蒂,以免损伤周围侧支血管,并防止脾蒂组织厚薄不均导致切割闭合不满意从而出血;避免损伤胰腺,以免造成胰腺出血及术后胰瘘等相关并发症[5]。脾蒂周围粘连严重、分离困难也是中转开腹的主要原因之一,对于这种情况如强行于腔镜下分离,导致术中大出血的危险性将大大增加,因此术中需在腔镜下探查清楚,根据患者病情、术中所见及术者手术技巧而选择术式,严格掌握其适应证,避免出现不必要的被动局面。
3.3 术后并发症及预防 脾切除术常见的并发症有感染(肺部感染、腹腔感染、切口感染等)、术后出血、胰瘘、门静脉系统血栓(portal vein thrombosis,PVT)、继发性血小板增多症等[6]。
本研究中,三组患者最常见的并发症均为感染,其中最常见的为术后肺部感染(非巨脾组15.6%,巨脾组30. 8%,开腹组36. 5%),考虑主要由于:(1)部分脾脏疾病(ITP、脾亢、肝硬化、自身免疫性疾病等)导致患者免疫力降低;(2)部分患者经过长期激素治疗后免疫力降低;(3)均为气管插管,且手术时间较长,术中出血相对较多,为易感因素。因此术前做好患者肺部评估、提高免疫力、改善营养状况、术前禁烟(>2 周),术后常规予化痰与雾化治疗、勤咳痰、早期下床活动,对于预防肺部感染至关重要。非巨脾组与巨脾组均未出现切口感染,开腹组出现3 例切口感染(4.1%),主要由于开腹巨脾切除手术切口大、创伤大,切口愈合慢,导致切口感染率增高,这也体现了腔镜手术的优点。腹腔感染常系术后腹腔积液积脓、引流不畅所致,因此术中防止胰腺损伤、止血彻底、引流管位置放置准确、术后保持引流管通畅是关键。泌尿系感染则主要系术后留置尿管时间过长所致,因此术后早期锻炼膀胱、尽早拔除尿管是防止泌尿系感染发生的主要手段。
术后出血也是脾切除术较常见的并发症之一,其主要原因包括患者的自身因素与手术因素,ITP、淋巴瘤等血液病患者大多贫血或血小板减少,门脉高压脾功能亢进患者本身存在凝血功能障碍,可引起切口或脾窝创面渗血,这是患者术后出血的自身因素;而手术因素一般为术中止血不彻底。对于患者自身因素的预防要点为:(1)建议PLT >50 ×109/L时手术,如果病情紧急或术前PLT 低难以纠正时,可于手术前1日输注血小板,并在手术当日备血小板;(2)术前积极纠正凝血功能,必要时输注新鲜冰冻血浆,以改善凝血功能;(3)术中脾窝放置止血材料,防止渗血;(4)术后常规予去氨加压素预防出血。手术因素主要为术中止血不彻底,因此关腹前需再次仔细探查,确认有无渗血。PVT[7]是腹腔镜巨脾切除、开腹巨脾切除术共有的并发症之一,主要与患者脾脏切除术后门静脉属支系统静脉血流增加,局部形成涡流及继发性血小板增多有关,好发于脾静脉。对此术后需密切监测患者血小板,如血小板持续升高,可予以阿司匹林等抗凝,必要时可予以低分子肝素,避免血小板凝集、血栓形成。而胰瘘的防治主要依赖于术中避免损伤胰腺,尤其直线切割吻合器离断脾蒂时避免损伤胰尾。
综上所述,腹腔镜巨脾切除术是安全、可行的,相对于开腹巨脾切除术,具有手术切口小、术后康复快、住院时间短等优点。相对于非巨脾而言,腹腔镜巨脾切除术手术难度高,术中出血较多,手术时间较长,且中转开腹率较高,因此对于术者的腔镜技术要求较高,且术前需做好手术评估,严格掌握适应证。LS 的并发症发生率尤其切口相关并发症明显低于开腹巨脾切除,而对于降低肺部感染等并发症仍有赖于术前做好充分的准备。相信随着临床经验的积累、腔镜技术的提高及相关器械的发展,腹腔镜巨脾切除术会取得更大的突破。
[1]荀祖武,方登华,方荣新,等.电视腹腔镜胆囊切除术100 例报道[J].中华外科杂志,1991,29(10):616-617.
[2]Owera A,Hamade AM,Bani Hani OI,et al.Laparoscopic versus open splenectomy for massive splenomegaly:a comparative study[J].J Laparoendosc Adv Surg Tech A,2006,16(3):241-246.
[3]Delaitre B,Maignien B.Splenectomy by the laparoscopic approach.Report of a case[J].Presse Med,1991,20(44):2263.
[4]Smith L,Luna G,Merg AR,et al.Laparoscopic splenectomy for treatment of splenomegaly[J].Am J Surg,2004,187(5):618-620.
[5]Chand B,Walsh RM,Ponsky J,et al. Pancreatic complications following laparoscopic splenectomy[J]. Surg Endosc,2001,15(11):1273-1276.
[6]Targarona EM,Espert JJ,Bombuy E,et al. Complications of laparoscopic splenectomy[J]. Arch Surg,2000,135(10):1137-1140.
[7]Targarona EM.Portal vein thrombosis after laparoscopic splenectomy:the size of the risk[J].Surg Innov,2008,15(4):266-270.
