紫外分光光度法测定靶向修饰脂质体中蟾毒灵的含量*
2015-03-22袁佳妮周暄宣孙纪元谢艳华王四旺
袁佳妮 曹 蔚 周暄宣 杨 倩 孙纪元 谢艳华 王四旺
第四军医大学(西安 710032)
紫外分光光度法测定靶向修饰脂质体中蟾毒灵的含量*
袁佳妮 曹 蔚 周暄宣 杨 倩 孙纪元 谢艳华 王四旺△
第四军医大学(西安 710032)
目的:建立靶向修饰的蟾毒灵脂质体( BLs)制剂中蟾毒灵( Bu)含量测定的方法。方法:采用紫外分光光度法,通过测定波长300nm处的吸光度,计算BLs制剂中Bu的含量。结果:Bu在15.62-250.0μg/mL的浓度范围内,于300nm处的吸光度线性关系良好,回归方程为Y=0.0114X-0.0346(R2=0.9997),平均回收率为99.82%,RSD为1.13%(n=9)。结论:本方法操作简单,且稳定性、准确度和精密度均符合要求,可用于BLs制剂中Bu含量的测定,并计算得到BLs制剂中Bu包封率。
传统中药材蟾酥(Venenum Bufonis)又名蟾蜍眉脂、蛤蟆酥,是蟾蜍科中华大蟾蜍(Bufo,bufogargarizans Cantor)或黑框蟾蜍(Bufomelanostictus Schneider)的耳后腺和皮肤腺分泌的白色浆液,采集后滤净晒干制得[1]。蟾酥性辛,温,味甘平,有毒。入胃、肾经,归心经,具有解毒消肿、强心、止痛、开窍醒神的功效。《本草纲目》曾记载蟾酥“治一切恶肿”,其治疗肿瘤具有悠久的历史。蟾毒灵(Bufalin, Bu)属于蟾毒甾烯类化合物,分子式为C24H34O4,是蟾酥抗肿瘤的主要活性单体成分[2]。研究表明,Bu对多种恶性肿瘤具有抑制作用, 具有较为广阔的临床应用潜能[3-4]。但是,蟾毒灵水溶性差,毒性强且体内半衰期短,静脉注射治疗窗狭窄,口服给药蟾毒灵容易分解失效,极大的限制了其临床应用[5-6]。
纳米制剂是近年来新兴的靶向递药系统,研究表明,肿瘤细胞具有的吞噬能力远甚于正常细胞,同时,肿瘤病灶部位的血管内皮细胞缝隙远大于正常部位的血管内皮细胞,因此与进入正常组织、器官相比,纳米粒更易进入并富集于肿瘤病变部位[7-8]。同时载药纳米粒在体内能够缓释抗肿瘤药物,延长药物在肿瘤内的存留时间,有效延长药物作用时间,提高疗效[9-10]。我们课题组将蟾毒灵制备成脂质体纳米制剂,以期改变其水溶性,降低毒性,延长半衰期,增加蟾毒灵抗肿瘤临床应用的可行性。本文在参考相关研究文献的基础上,应用紫外分光光度法建立了测定蟾毒灵脂质体BLs中Bu含量的方法。
1 材 料 UV2600型紫外分光光度仪(德国Techcompany);ME235S型电子分析天平(德国赛多利斯公司);KQ-300E型超声波清洗器(昆山市超声仪器有限公司);超纯水系统(美国密理博公司);bufalin(陕西宝鸡辰光生物科技公司,纯度%);大豆卵磷脂(Sigma-Aldrich,St Louis, MO, USA);胆固醇(Sigma-Aldrich,St Louis, MO, USA);其他试剂均为分析纯,实验室用水为超纯水。
2 方 法 2.1 供试溶液的制备 对照品溶液的制备:精密称取Bu 10.0mg,置于10mL棕色容量瓶中,加无水乙醇,摇匀,定容至刻度线,超声震荡使之充分溶解,配制成1.0mg/mL的Bu标准品储备液,待用;供试品溶液的制备:精密量取BLs溶液1mL, 置于10mL具塞玻璃试管中,超声10min后转移至10mL棕色容量瓶中,用无水乙醇定容至刻度线,摇匀,即得。空白脂质体溶液的制备:同供试品溶液制备方法。
2.2 方法学建立 2.2.1 检测波长的确定:将一定浓度的对照品溶液(Bufalin,100μg/mL)、供试品溶液(BLs),空白脂质体溶液(Blank),无水乙醇为空白对照,应用紫外分光光度仪在200~700nm范围内全波段扫描。
2.2.2 标准曲线的建立:分别精密量取对照品溶液0.156,0.312,0.625,1.25,2.50mL于10mL棕色容量瓶中,用无水乙醇定容至刻度线,得到浓度分别为15.62, 31.25, 62.50, 125.0, 250.0μg/mL的系列对照品溶液,4℃冰箱中避光保存备用。以无水乙醇作空白,紫外分光光度仪在300nm处分别测定吸光度,以待测物Bu浓度(C)为横坐标,待测物Bu吸光度(A)为纵坐标,进行线性回归。
2.2.3 精密度试验:取Bu对照品溶液(浓度分别为15.62, 62.50, 125.0μg/mL),紫外分光光度仪在300nm处测定吸光度,日内组1d内连续测定5次,日间组同一条件下每隔1d测定一次,连续测定5d,记录吸光度值,根据回归方程计算其浓度,进而得到日内精密度及日间精密度。
2.2.4 稳定性试验:取Bu对照品溶液(浓度分别为15.62, 62.50, 125.0μg/mL),分别在低温(-4℃)、常温(22℃)、高温(65℃)下放置12h后测定其吸光度,按回归方程计算浓度,评价其稳定性。
2.2.5 重复性试验:精密量取自制BLs溶液5份,按照“2.1”项下同供试品溶液制备方法溶进行操作,测定吸光度,根据回归方程计算浓度。
2.2.6 加样回收率测定:分别准确量取Bu对照品溶液1mL(浓度31.25μg/mL)置于9个10mL棕色容量瓶中,分为3组,每组3份。分别加入Bu对照品溶液(15.62μg/mL)1.0mL、2.0mL、3.0mL,配置成低、中、高三种浓度的溶液。以无水乙醇为空白对照,分别测定其在300nm处吸光度值,计算回收率。
2.2.7 样品检测:制备3批BLs制剂(每批制剂
体积为2.5mL),精密量取BLs溶液1mL,分别置于3个10mL棕色容量瓶中,无水乙醇定容至刻度线。以无水乙醇为空白对照,在300nm波长处测定吸光度值,根据线性回归方程测得其浓度C,并由稀释倍数n(n=100)计算得到BLs制剂中Bu的含量。由于每批BLs制剂制备处方中Bu加入量为0.60mg,求得BLs制剂中Bu包封率。
3 结 果 3.1 检测波长的确定 蟾毒灵(Bufalin)、蟾毒灵脂质体制剂(BLs)、空白脂质体制剂(Blank)三者的全波长扫描图可知,Bu的最大吸收波长为300nm,且在300nm波长处,空白脂质体溶液没有吸收,不会干扰蟾毒灵检测,专属性较强,见图1。
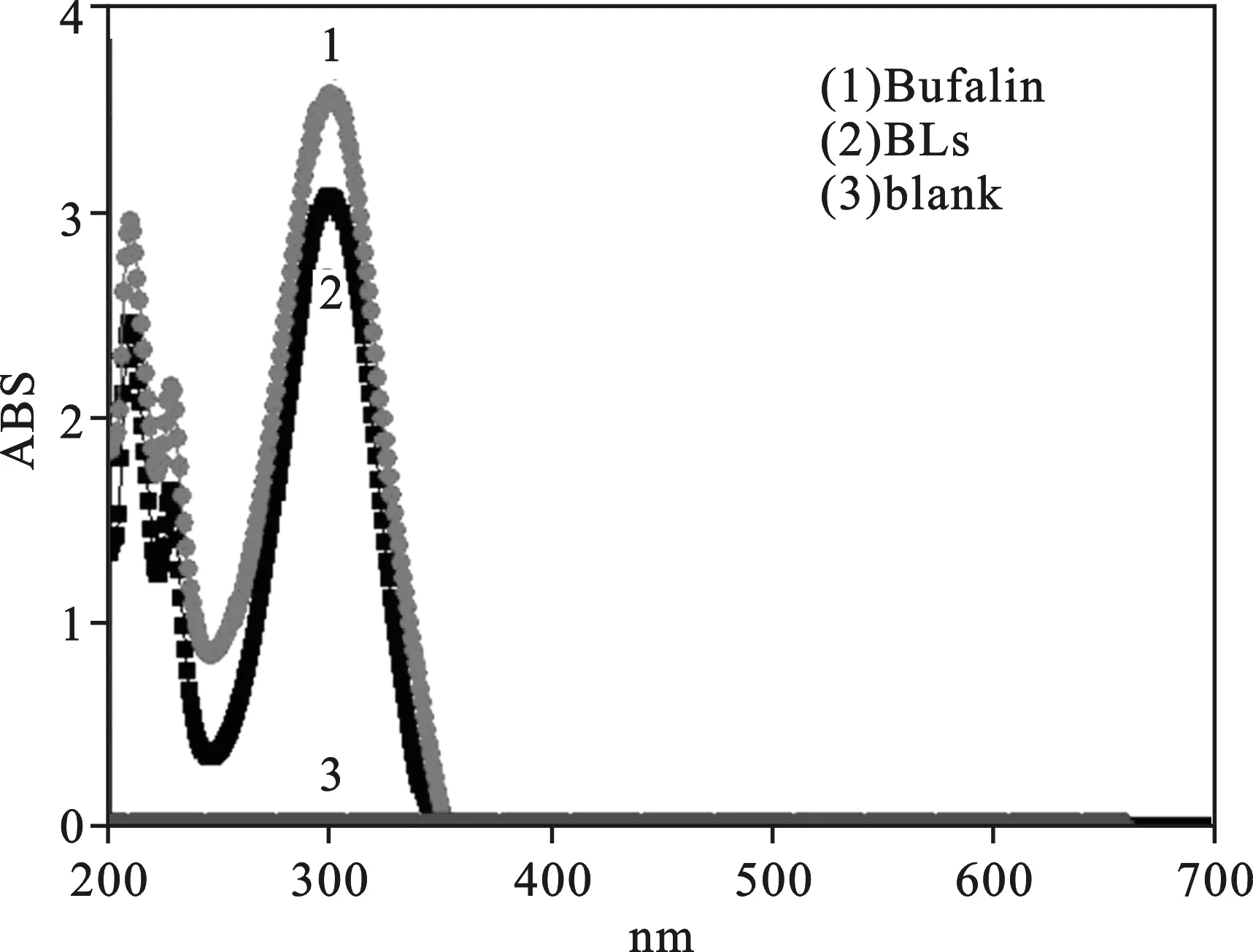
(1.Bufalin;2.BLs;3.blank)
图1 蟾毒灵、蟾毒灵脂质体制剂及空白脂质体制剂的紫外吸收光谱图
3.2 标准曲线的建立 由试验可知,蟾毒灵的浓度及其吸光度之间具有良好的线性关系,线性拟合得到标准曲线方程为Y=0.0114X-0.0346,R2=0.9997(n=5),其标准曲线。结果显示,蟾毒灵在15.62至250.0μg/mL的浓度范围内,线性关系良好,符合分析测试要求。
3.3 精密度试验 由测定结果可知,见表1,所有样品的日内RSD及日间RSD均小于1.0%,精密度良好,符合质量控制要求。
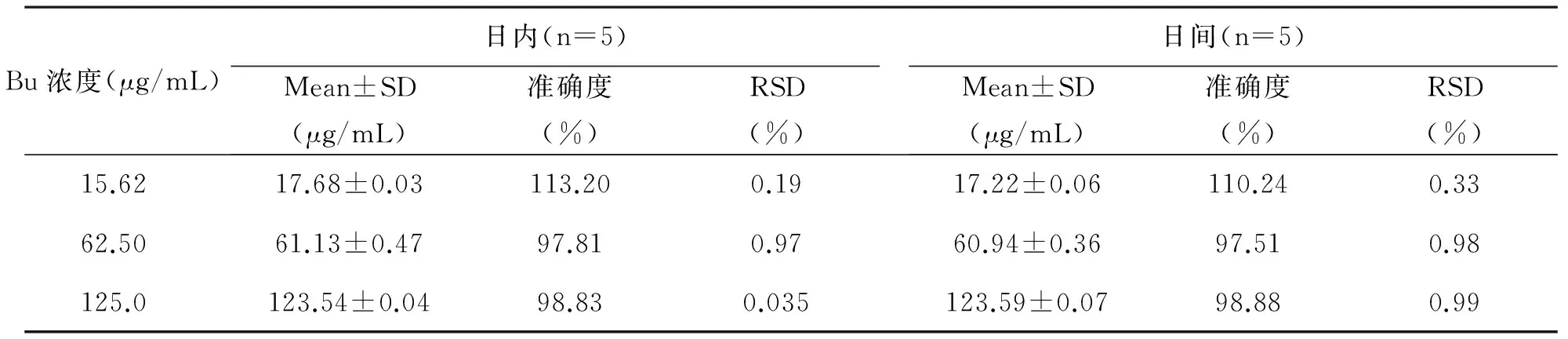
表1 精密度试验结果
3.4 稳定性试验 结果如表2,所有样品的回收率均在97.27%~113.35%之间,符合质量控制要求。
3.5 重复性试验 结果如表3,5份由同一处方制备而成的BLs制剂的RSD值为0.16%,表明重复性较好,符合分析要求。
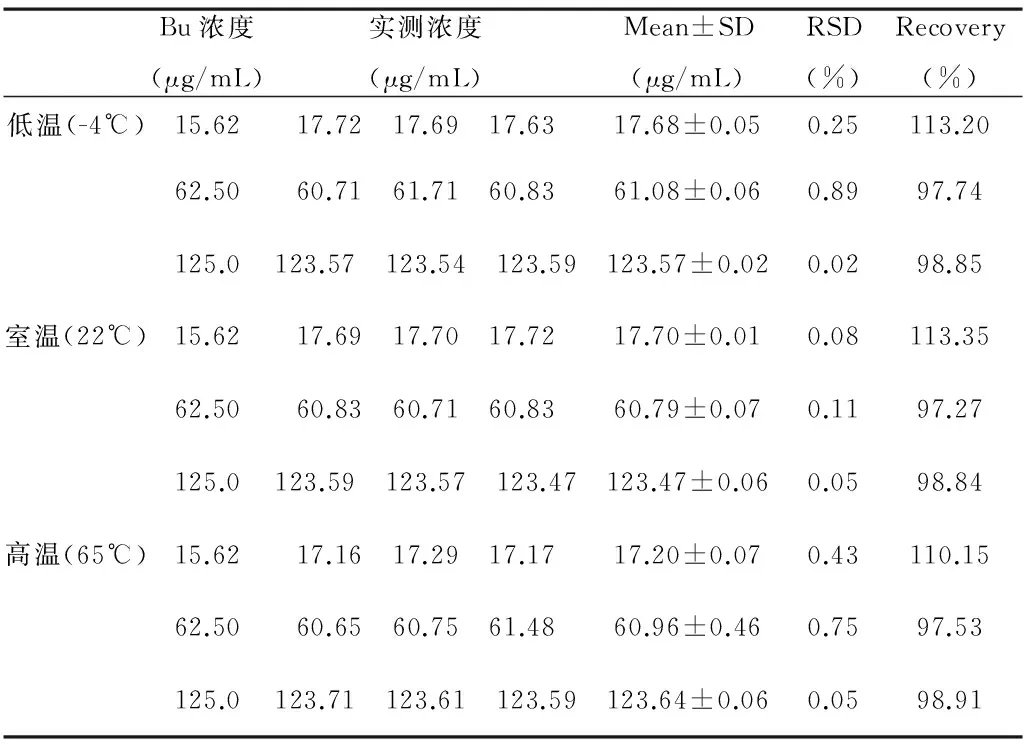
表2稳定性试验结果(n=6)
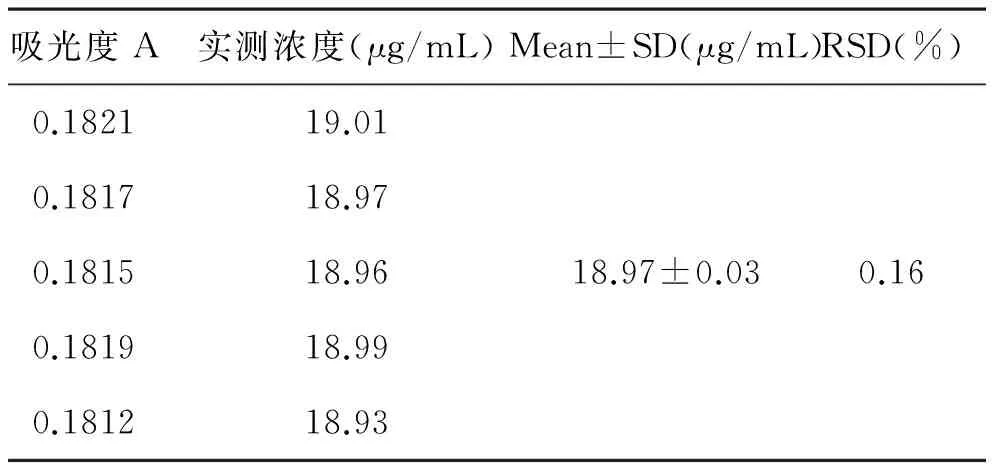
表3 重复性试验结果(n=5)
3.6 加样回收率测定 其结果见表4,所有样品的回收率均在98.30%~101.76%之间,求得平均回收率为99.82%,RSD值为1.13%(n=9),试验结果符合分析要求,见表4。
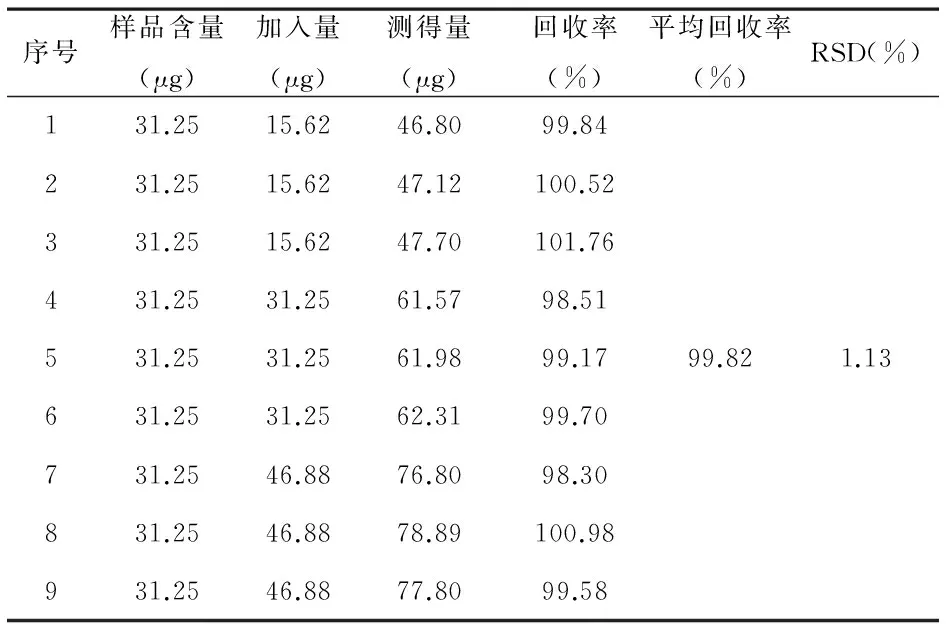
表4加样回收率试验结果(n=9)
3.7 样品检测 结果见表5,根据测得的样品吸光度求得3批BLs制剂中Bu的包封率分别为67.69%、68.24%、68.93%。
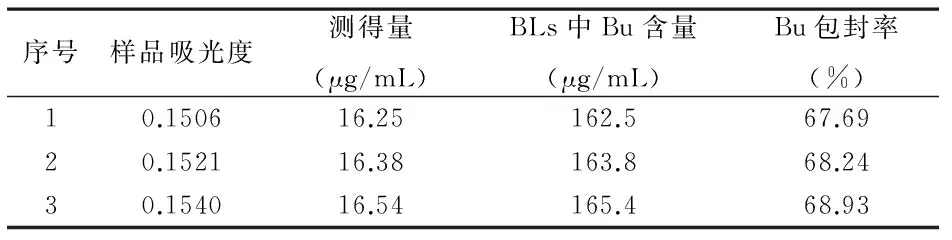
表5 蟾毒灵脂质体制剂样品的含量测定结果
4 讨 论 本试验研制的BLs,以蛋黄卵磷脂和胆固醇为载体,将蟾毒灵单体药物包载于脂质体制剂中,并对蟾毒灵脂质体进行靶向修饰,以达到定位缓释效果,提高蟾毒灵的生物利用度,延长作用时间,降低药物毒性,提高药物安全性,增加其临床应用的价值。本试验建立了应用紫外分光光度法测定蟾毒灵脂质体制剂中蟾毒灵含量的方法,方法学结果表明,该方法简便易行,且准确度高、重现性好,可应用于蟾毒灵含量的测定。
[1] 张慧卿,殷子斐,盛佳钰,等.蟾毒灵抗肿瘤作用机制研究进展[J].中药药理与临床,2012(3):130-133.
[2] Shen S. Bufalin induces the interplay between apoptosis and autophagy in glioma cells through endoplasmic reticulum stress. Int J Biol Sci, 2014, 10(2): 212-24.
[3] Wu S.H. Bufalin induces cell death in human lung cancer cells through disruption of DNA damage response pathways. Am J Chin Med, 2014, 42(3): 729-42.
[4] 李 瑛,两种蟾毒灵脂质体制备工艺及抗肿瘤作用研究[D].2014,西安:第四军医大学,2014.
[5] 毕琳琳,缪 珊,王四旺.蟾酥抗肿瘤有效成分的作用研究[J].现代生物医学进展,2012(16):3185-3187.
[6] 齐芳华.华蟾素及其活性成分蟾毒灵和华蟾毒精诱导肝癌细胞凋亡的机制探讨[D].济南:山东大学,2011.
[7] 张慧卿.蟾毒灵白蛋白纳米粒与蟾毒灵在大鼠体内的药代动力学比较研究[J].中西医结合学报,2012(6):674-680.
[8] 莫永炎,罗深秋.正常与肿瘤性星形神经胶质细胞细胞间直接通讯的比较[J].第一军医大学学报,1997(3):223-224.
[9] Jin, H.L., W. Wu and R. Shu. [Doxycycline nano-liposome slow-release gel improves rat periodontitis]. Shanghai Kou Qiang Yi Xue, 2010, 19(5): 508-11.
[10] Henriksen-Lacey, M., et al. Comparison of the depot effect and immunogenicity of liposomes based on dimethyldioctadecylammonium (DDA), 3beta-[N-(N',N'-Dimethylaminoethane)carbomyl] cholesterol (DC-Chol), and 1,2-Dioleoyl-3-trimethylammonium propane (DOTAP): prolonged liposome retention mediates stronger Th1 responses. Mol Pharm, 2011, 8(1): 153-61.
(收稿2015-07-29;修回2015-08-30)
Content determination of bufalin in targeted liposomes by ultraviolet spectrophotometry
Yuan JianiCao WeiZhou Xuanxuanet al
Fourth Military Medical University( Xi'an 710032)
Objective: To establish the method determination of bufalin(Bu) from Bufalin liposomes(BLs). Methods: Ultraviolet spectrometric assay was used, l=300nm. Results: It had good linearity with the 15.62-250.0μg/mL concentration range of Bu. The regression is Y=0.0114X-0.0346(R2=0.9997). The recovery from the sample was 99.82%, RSD=1.12%(n=9). Conclusion: This method is simple, stable and accurate, which could be used to quality standards for Bu of BLs.
@Bufalin @Ultraviolet spectrometric content determination
*陕西省科技统筹创新工程计划项目(2015KTZDSF02-01-02)
@蟾毒灵 @紫外分光光度法
R282
A
10.3969/j.issn.1000-7369.2015.12.051
△通讯作者
