地黄饮子含药血清对海马脑片SDF-1的影响*
2015-03-22范文涛贺又舜
王 倩 范文涛 贺又舜
湖南中医药大学(长沙 410208)
地黄饮子含药血清对海马脑片SDF-1的影响*
王 倩△范文涛△贺又舜
湖南中医药大学(长沙 410208)
目的:探讨地黄饮子对大鼠海马脑片SDF-1蛋白的影响。方法:SD大鼠18只,用乙醚麻醉大鼠,分离海马组织,培养2周后,分为对照组(HOTC组)和低氧缺糖组(OGD组)。采用地黄饮子含药血清培养海马脑片,观察地黄饮子含药血清对海马脑片SDF-1的影响。结果:研究发现用地黄饮子含药血清培养大鼠脑片,能明显提高缺血、缺氧组脑片SDF-1蛋白、CXCR4含量,与对照组比较具有显著差异,说明地黄饮子能促进缺血区SDF-1的表达,进一步促进低氧低糖区脑组织神经再生能力。结论:地黄饮子含药血清能有效提高缺血缺氧区脑片SDF-1含量,进一步改善脑组织缺血缺氧能力,通过SDF-1/CXCR4信号通路促进脑组织神经再生能力。
在正常情况下的神经干细胞处在休眠状态,只有在一定的信号条件下才可以被激活。脑缺血时,海马、侧脑室室管膜下区以及脑皮层可增殖的神经干细胞被炎症刺激激活,进一步迁移到缺血损伤区,分化成神经元细胞和胶质细胞,创建新的神经连接。新生的神经细胞可以替代损伤的神经元,修复神经功能缺损。这表明,内源性神经干细胞具有修复缺血性脑损伤的能力。因为通过激活内源性神经干细胞所获得的神经干细胞有限,数量较少,同时调控神经干细胞迁移、分化的激活因子不足,最终导致自身不能修复神经功能缺损。本文研究地黄饮子通过调控SDF-1蛋白进一步促神经再生的作用机制。
1 实验材料 1.1 动 物 新生6~9 d健康SD大鼠18只,清洁级,雌雄不拘,购自西安交通大学医学实验动物中心,动物许可证号:SCXK2012-003。
1.2 药 物 中药地黄饮子以《黄帝素问·宣明论方》所载地黄饮子药味和比例配制:熟地黄、白茯苓、菖蒲各12g,巴戟天、 山茱萸、石斛、肉苁蓉、麦门冬、炮附子各15g(先煎), 官桂、 五味子、远志各10g。
根据2010 年版《中国药典》选择中药材饮片:药材饮片购买于陕西省西安市中药饮片有限责任公司,饮片经陕西中医学院药学院中药鉴定学教研室鉴定为道地药材。按组方配伍比例精确称取,加入12倍重量的自来水,先泡40min,再大火煎煮10min,小火煎煮30min,留取药液;再次加入12倍重量的自来水,再大火煎煮10min,小火煎煮30min,留取药液;然后将2次所取药液混合,装入容量瓶成为地黄饮子煎剂。在旋转蒸发仪蒸发浓缩后,定容装入玻璃冻干瓶冷凝干燥,干燥条件:-55℃,真空度:<10 Pa,时间:24 h。计算冻干粉获得率,最后装入密闭玻璃容器中密封保存。
1.3 主要试剂及仪器 MEM 培养基、马血清、噻唑蓝(MTT)、 抗胶质纤维酸性蛋白抗体、焦油紫均购于、兔抗SDF-1α、CXCR4多克隆抗体、生物素化二抗、辣根过氧化酶标记、膜插件、 体视显微镜、振动切片机、电位记录系统、显微镜、 细胞培养箱。
2 实验方法 2.1 地黄饮子含药血清制备 采用大脑中动脉线拴法复制脑缺血模型。造模成功后灌服地黄饮子药液每次2mL,剂量换算方法按照体表面积相当于正常成年人70Kg体重剂量的3倍,换算为大鼠的用药剂量约为每公斤体重灌服生药量14.5g。治疗第7天给药后断头处死动物,收集大鼠的血液,离心分离血清,放入温度为56℃水浴中灭活30min,采用0.22μm滤器进行过滤,分装并放置于-20℃的冰箱中备用。
2.2 海马脑片培养 用乙醚麻醉大鼠,至于无菌环境,断头取出脑组织,放入含糖浓度为7.5 g/L的HBSS溶液中,温度保持在4℃,分离出海马组织。放在表面铺有3%琼脂的活组织切片机上,采用冠状面切开脑组织,切成厚度约400μm的脑片。再将脑片放入6孔培养板的微孔滤膜上,培养板浸泡在培养液中。每个培养板含有6孔,每孔放置脑片6张,培养液含有5%CO2,温度为37℃。将培养板放入平衡湿度的标准培养箱进行培养,隔日更换培养液,培养时间为2周。
2.3 分 组 培养分组:培养2周后,分为对照组(HOTC组)和低氧缺糖组(OGD组)。采用的培养液成分:25%HBSS、50%MEM、23%马血清、0.75%葡萄糖、0.5%谷氨酰胺、2%双抗。
2.4 地黄饮子含药血清海马脑片培养 海马脑片培养2周后,在培养板各脑片培养液中加入0.1 mmol/L PI 90μL,在将培养板放置于温度37℃、5%CO2、平衡湿度的标准培养箱内1 h。然后在倒置显微镜下观察并挑选无特异性,PI荧光显色较好脑片。经过筛选的脑片,对照组(HOTC组)加入正常培养液,培养条件为温度37℃,并将脑片放置于含有5%CO2、平衡湿度的标准培养箱内进行培养。低氧缺糖组(OGD组)脑片加入无糖平衡盐溶液(pH 7.4)做为培养液,培养条件为温度37℃,并将脑片放置于含有5%CO2、1%O2的缺氧培养箱内进行培养。两组脑片均放置1h,之后两组均加入地黄饮子含药血清,放置于正常培养箱中进行培养,培养时间为24h。最后两组均加入PI,放置于普通培养箱中培养1h,用荧光倒置显微镜观察,并拍照记录。
2.5 组织切片制备 对照组(HOTC组)和低氧缺糖组(OGD组)脑片在普通培养箱中恢复培养24h后,分别用4%多聚甲醛固定、浸糖,再用冰冻切片机从冠状面切片,切片厚度约20μm,再进行免疫组化染色备用。
2.6 免疫组化染色(ABC法) 脑切片采用0.01mol/L PBS漂洗,每次漂洗5min,共3次。再用1% H2O2在温室孵育30min,0.01mol/L PBS漂洗,每次漂洗5min,共3次。加入10%羊血清封闭1 h,不洗涤。分2次加入CXCR4兔抗多克隆抗体(1∶500)和兔抗SDF-1α多克隆抗体(1∶500)。阴性组脑片采用0.01mol/L PBS代替一抗,在温度4℃下孵育48 h,0.01mol/L PBS漂洗,每次漂洗5min,共3次。再加入生物素化羊抗兔IgG(1∶200),在温度4℃下孵育12h,0.01mol/L PBS漂洗,每次漂洗5min,共3次。加入辣根过氧化物酶标记的链霉卵白素复合物(1∶200),在温度4℃下孵育12h,0.01mol/L PBS漂洗,每次漂洗5min,共3次。采用DAB/H2O2显色5~10min,电镜下检测显色的程度,用自来水反复冲洗10次以终止。最后采用乙醇梯度脱水,封盖玻片以镜下观察。
2.7 Western blot检测 实验中取两组脑片,分别是HOTC组、OGD组,两组脑片按照每100mg的脑片分别加入1ml的匀浆液并充分搅拌匀浆,在温度4℃离心机以12 000转/min,离心10min,取上清液并进行分装,存入-80℃的冰箱中备用。按Lowry et al的方法,采用小牛血清蛋白做为标准参考蛋白,进一步测定蛋白含量。再按照Gu et al方法,取等量的蛋白做为样品待检。用经10%SDS-聚丙烯酰胺凝胶电泳分离,电泳后转移至NC膜上,在经过5%脱脂奶粉封闭约1h,加入一抗(兔抗SDF-1抗体,兔抗CXCR4抗体),在温度4℃下放置24h。用洗涤缓冲液洗膜,然后添加荧光素和生物素标记的两种抗体,在温度为37℃温孵1h,2min后洗膜。在采用电镜观察,并应用图像分析系统记录分析结果。
2.8 图像及数据的统计处理 实验获得的免疫组化切片均在电镜下采用图像成像及分析系统进行成像及分析。数据采用表示,用SPSS 16.0软件进行统计分析,多组间比较采用单因素方差分析。
3 结果与分析 3.1 采用Westernblot方法检测HOTC组、OGD组大鼠海马脑片SDF-1/CXCR4的变化 各组大鼠脑片SDF-1蛋白、CXCR4含量测定,地黄饮子含药血清培养大鼠脑片,能明显提高缺血、缺氧组脑片SDF-1蛋白、CXCR4含量,与对照组相比差异有显著性意义的(P<0.05)。

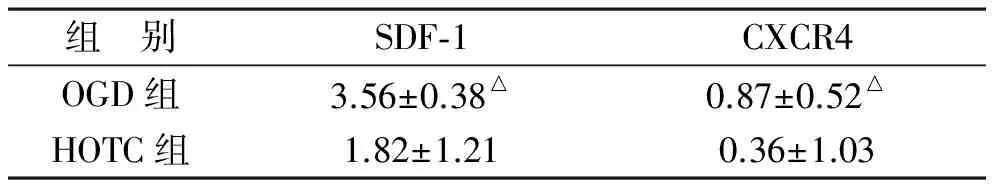
组 别SDF⁃1CXCR4OGD组3.56±0.38△0.87±0.52△HOTC组1.82±1.210.36±1.03
注:与模型组比较△P<0.05
3.2 Western blot检测大鼠脑片海马区SDF-1
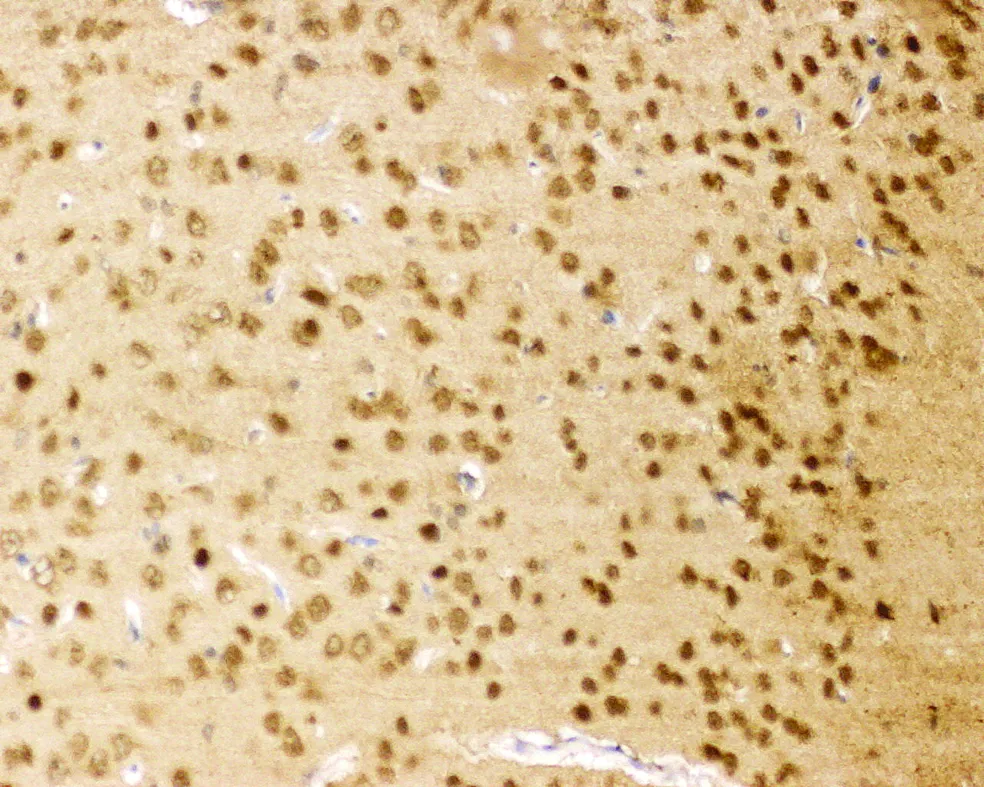
图1 OGD组脑片海马区SDF表达,OGD组海马区SDF升高,阳性细胞数量增多。
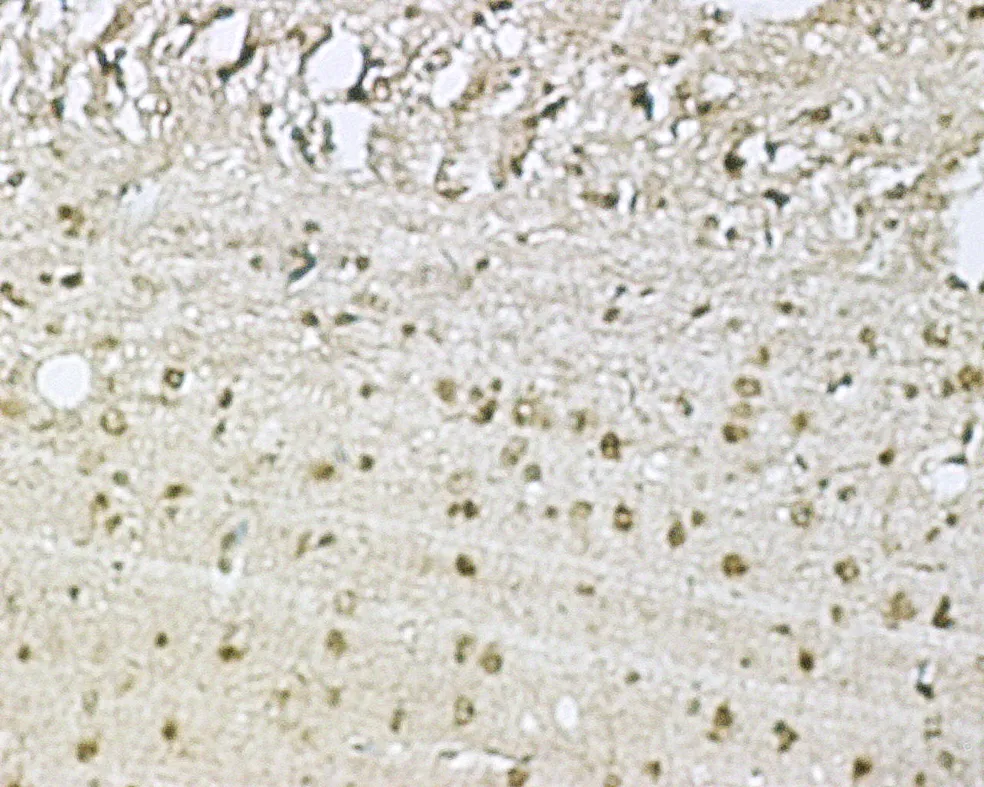
图2 HOTC组脑片海马区SDF表达,HOTC组海马区SDF升高不明显,阳性细胞数量无明显变化。
4 讨 论 最新研究发现,SDF-1可以调节神经元信息传递。SDF-1mRNA和神经元CXCR4共同分布在脑组织相同部位,SDF-1具有神经调节功能。研究发现在局灶性脑缺血的大脑皮层中,SDF-1含量在脑缺血前2日含量持续升高[1]。研究表明,SDF-1可促进神经干细胞增殖、粘附、迁移和归巢。在缺血性脑卒中大鼠实验中,采用免疫组化方法观察到第一个月和第四个月脑缺血边缘SDF-1的表达水平显著高于对侧脑SDF-1对应的部分。对内源性神经干细胞起到诱导迁移并分化为神经细胞的作用[2]。脑缺血后炎症因子刺激,引起海马区及大脑皮层神经干细胞增殖,促进神经干细胞迁移,同时受神经生长因子及抑制因子的影响,促进损伤区对迁移中的神经干细胞捕获,在损伤区域分化成神经元,建立神经神经连接,修复神经损伤[3]。实验研究表明, SDF-1能够促进神经损伤区刺激神经干细胞增殖,进一步促进神经干细胞迁移。同时,损伤区的细胞生长因子可以进一步促进缺血区对神经干细胞的捕获,促进神经干细胞分化成神经元,修复神经损伤[4]。
SDF-1蛋白的受体是CXCR4,CXCR4具有7个跨膜结构,是一种G蛋白偶联受体,通常存在于细胞膜的表面,部分也存在于细胞胞浆中。SDF-1及其受体CXCR4广泛存在于人体多种细胞及组织中,主要存在于脑、心脏、肺脏、脾脏、肝脏。在中枢神经系统、循环系统及免疫系统中发挥重要的作用[5]。近年来的研究证实,SDF-1/CXCR4信号通路在神经干细胞迁移及归巢、介导炎症反应和神经再生等方面发挥着重要作用。研究发现,在人类中枢神经系统存在神经干细胞,神经干细胞具有增殖分化潜能,能分化为神经元及神经胶质细胞[6]。在正常情况下,他们在休息状态,只有在一定的信号可以激活刺激。脑缺血时,海马、大脑皮层等区域的神经干细胞开始增殖,进一步迁移,分化为神经元,建立新的神经连接,替代损伤区神经,促进缺血区神经修复[7]。这表明,内源性神经干细胞具有修复缺血性脑损伤的能力。然而,因为通过激活干细胞数量上的缺乏,导致脑缺血后内源性神经干细胞数量不足,同时调节新生神经元迁移、分化的促进因子分泌不足,最终导致自身修身神经损伤效果不佳。最近发现,SDF-1可调节神经细胞突触传递。SDF-1与其受体分布在相同的脑区,SDF-1具有神经调节功能,可通过SDF-1/CXCR4信号通路进一步调控神经干细胞迁移[8]。本研究发现用地黄饮子含药血清培养大鼠脑片,能明显提高缺血、缺氧组脑片SDF-1蛋白、CXCR4含量,与对照组比较具有显著差异,说明地黄饮子能促进缺血区SDF-1的表达,进一步促进低氧低糖区脑组织神经再生能力。地黄饮子含药血清能有效提高缺血缺氧区脑片SDF-1含量,进一步改善脑组织缺血缺氧能力,通过SDF-1/CXCR4信号通路促进脑组织神经再生能力。
[1] 刘柏炎,蔡光先. 试论中医学对干细胞生物学的认识[J]. 湖南中医学院学报, 2003(6):21-22.
[2] 蔡光先,林 琳,刘柏炎,等. 地黄多糖诱导骨髓间充质干细胞分化为神经样细胞的效应[J].中国临床康复,2005,9(17):46-47.
[3] 陈东风,杜少辉,李伊为,等. 龟板含药血清体外诱导成年大鼠骨髓间充质干细胞分化为神经元[J]. 广州中医药大学学报, 2003,20(3):224-226.
[4] GleichmannM, Gillen C, CzardybonM, et a.l Cloning and charac-terization of SDF-1gamma, a novel SDF-1 chemokine transcriptwith developmentally regulated expression in the nervous system. EurJNeuro Sc,i 2000,12(6):1857-1866.
[5] 胡丽华,陈凤花,王 琳. SDF-1及其受体在造血干/祖细胞归巢中的作用[J].中华输血杂志, 2003,12,16(6):437-439.
[6] 曹 阳. SDF-1 /CXCR4对大鼠骨髓基质细胞迁移的影响及在脊髓损伤中的应用[D].中国医科大学,2006.
[7] 顾 平,娄淑杰,王铭维,等.骨破基质细胞条件培养液对中脑神经干细胞分化的影响[J].第二军医大学学报,2003,924(3):295-297.
[8] Hill WD, Hess DC, Martin - Studdard A, et a.l SDF - 1(CXCL12 ) is upregulated in the ischemic penumbra followingstroke: associatedwith bonemarrow cellhoming to injury. JNeuro-patholExpNeuro,l 2004,63:84-96.
(收稿2014-10-11;修回2014-11-08)
Effect of Dihuang Yinzi protein on hippocampal slices of SDF-1 in rats
Hunan University of Chinese Medicine(Changsha 410208)
Wang Qian Fan Wentao He Youshun
Objective:To study Dihuang Yinzi protein in rat hippocampal slices of SDF-1. Methods:18 SD rats, rats with ether anesthesia, separation of hippocampus, training 2 weeks later, divided into the control group (group HOTC) and low oxygen lack of sugar group (OGD group). Using Dihuang Yinzi drug-containing serum cultured hippocampal slices, observation of Dihuang Yinzi drug-containing serum affect hippocampal slices of SDF-1. Results:The study found that with Dihuang Yinzi drug-containing serum training rats, can significantly improve the ischemia and hypoxia of brain slice of SDF-1 and CXCR4 protein content, compared with the control group with significant difference, Dihuang Yinzi can promote the expression of ischemia area SDF-1, to further promote the low oxygen sugar area brain nerve regeneration ability. Conclusion :DiHuang YinZi medicated serum can effectively improve the ischemia anoxic zone slices SDF-1 content and further improve the cerebral ischemic anoxia ability, through the SDF-1/CXCR4 signaling pathway to promote brain nerve regeneration.
@Dihuang Yinzi Animal,experiment Rats
*陕西省科技厅资助项目(2012k19-05-04)
@地黄饮子 动物,实验 大鼠
R563
A
10.3969/j.issn.1000-7369.2015.03.058
△陕西中医学院(咸阳 712046)
