免疫共沉淀筛选牛卵泡CART相互作用蛋白的研究
2015-03-22李鹏飞孟金柱陈建伟姜晓龙姚晓磊赵妙妙吕丽华
李鹏飞,孟金柱,刘 岩,黄 洋,陈建伟,姜晓龙,曹 霞,姚晓磊,赵妙妙,吕丽华*
(1.山西农业大学生命科学学院,太谷 030801;2.山西农业大学动物科技学院,太谷 030801)
免疫共沉淀筛选牛卵泡CART相互作用蛋白的研究
李鹏飞1,孟金柱2,刘 岩2,黄 洋2,陈建伟2,姜晓龙2,曹 霞2,姚晓磊2,赵妙妙2,吕丽华2*
(1.山西农业大学生命科学学院,太谷 030801;2.山西农业大学动物科技学院,太谷 030801)
旨在研究牛卵泡发育过程中可卡因-苯丙胺调节转录肽(Cocaine-and amphetamine-regulated transcript,CART)相互作用蛋白(Protein-protein interaction,PPI)。选择4头10月龄同期发情的健康母牛,B超检测卵泡达8~12 mm,屠宰并采集、分离卵泡颗粒细胞(Granulosa cells,GCs)后,进行总蛋白提取,兔抗CART一抗沉淀CART及其相互作用蛋白,经Protein G-Agarose磁珠吸附分离,多次洗涤去除盐分和杂蛋白,洗脱蛋白复合体并酶解,LC-ESI-Q-TOF质谱分析(Mass spectrometry,MS)及数据库比对。结果显示:共鉴定蛋白质组分111个;经Cytoscape V3.1.0分析,有81个蛋白符合功能模块,并构建蛋白相互作用网络图;同时对相互作用蛋白进行功能富集性分析,共分为3大类34组:其中分子功能占11.73%,生物学过程占46.93%,细胞组分占41.34%。α2巨球蛋白(A2M)和波形蛋白(VIM)与CART相互作用的相关系数最大; CART与NALP1、 SERPINH1和PDIA6具有负调控应答的功能,提示可能参与牛卵泡发育过程的调控。
牛;CART;免疫共沉淀;质谱分析;相互作用
在人和多种动物组织内,CART已被成功克隆并测序,其均由2个内含子和3个外显子构成。蛋白序列C端有3对二硫键维持空间结构并保证CART活性,N端构象缺乏规律性。本课题组在前期研究中,通过卵泡GCs体外培养研究发现,CART对牛[1-2]、猪[3]、绵羊[4]卵泡GCs的生长增殖及雌激素分泌具有抑制作用,进而对卵泡发育产生影响;免疫组化研究也表明,CART在牛[5]、猪[6]、绵羊[7]有腔卵泡的GCs和卵丘细胞层均有表达。本试验通过Co-IP及MS技术对影响牛卵泡发育的CART及其相互作用蛋白进行研究,为探讨CART对牛卵泡发育的调控机理,进一步明确牛卵泡发育过程及卵泡相关激素调节奠定基础。
1 材料与方法
1.1 材料1.1.1 试验动物及组织 本试验牛卵泡GCs总蛋白提取材料来自北京大兴区金维福仁肉牛屠宰场。选取4头母牛(海福特杂交后代),屠宰后采集双侧卵巢,投入4 ℃ DPBS中,实验室进行卵泡GCs分离。 1.1.2 试剂 兔抗CART一抗(Phoenix pharmaceuticals,美国),Western及IP细胞裂解液(Beyotime,上海),Protein G-Agarose磁珠、蛋白酶抑制剂(Roche,瑞士),酶解试剂盒(Pierce,美国),色谱级甲醇、乙腈、无水乙醇、甲醛、氯仿、异丙醇、正己烷等均为国产分析纯级试剂。
1.2 试验方法
1.2.1 GCs的分离 母牛屠宰后采集双侧健康卵泡,眼科剪剪取8~12 mm透明或呈黄色的卵泡,无菌DPBS冲洗两次后,刮刀刮取卵泡内膜GCs,并收集到表面皿的培养液中,2 000 r·min-1离心,弃上清,-80 ℃保存。
1.2.2 GCs总蛋白的提取 预冷PBS液将GCs冲洗两次,GCs悬液转移至灭菌离心管中,4 ℃ 1 000 r·min-1离心10 min,弃上清;低渗溶液重悬,4 ℃ 1 000 r·min-1离心5 min,弃上清;低渗溶液重悬沉淀,低温溶胀35~40 min,4 ℃ 3 000 r·min-1离心15 min,弃上清;加入细胞裂解液,4 ℃孵育30 min;4 ℃ 20 000 r·min-1离心,上清液即为总蛋白溶液;-80 ℃EP管保存备用。
1.2.3 总蛋白浓度测定 测定蛋白溶液280 nm/260 nm紫外吸收值,蛋白浓度=1.45×OD280 nm-0.74×OD260 nm(mg·mL-1),即可算出蛋白溶液浓度。1.2.4 总蛋白溶液预处理 将洗脱柱放在离心管上,以每毫克初蛋白滴加80 μL Control Agarose Resin过柱;1 000 r·min-1离心1 min,弃上清;100 μL 1×Coupling Buffer洗柱;1 000 r·min-1离心1 min,弃上清;2 mg初蛋白过柱,4 ℃孵育1 h;离心分离获得预处理的总蛋白。
1.2.5 CART一抗免疫沉淀 取等体积的总蛋白和Lysis Buffer及200 μL Protein G-Agarose磁珠于EP管中,1 mL PBS洗涤磁珠,4 ℃ 3 000 r·min-1离心3 min,弃上清,重复3次;Lysis Buffer清洗1次;总蛋白溶液中加30 μL磁珠,3 000 r·min-1离心3 min;取上清于无菌EP管中,加2 μL稀释过的CART抗体,4 ℃摇床孵育过夜;加50 μL磁珠,4 ℃摇床孵育2~3 h;4 ℃3 000 r·min-1离心3 min;磁珠分别用500 μL PBS清洗3次,4 ℃3 000 r·min-1离心3 min,弃上清;加10 μL 5×Sample Buffer和20 μL Lysis Buffer,-20 ℃保存备用。1.2.6 Co-IP复合物洗脱及酶解 将Co-IP磁珠转移至无菌EP管中,加入10 μL Elution Buffer洗涤磁珠,1 000 r·min-1离心1 min,收集洗脱液;洗脱柱中加50 μL Elution Buffer,室温孵育5 min,1 000 r·min-1离心1 min;收集2次洗脱液,即为CART Co-IP复合物,核酸蛋白检测仪测定蛋白浓度;0.25%胰酶进行酶解。
1.2.7 LC-ESI-Q-TOF质谱分析 使用LC-ESI-Q-TOF质谱分析仪,首先液相色谱(Liquid Chromatogram,LC)分离肽段,纳流泵流速设定为0.3 μL·min-1;溶剂A(0.1%甲酸+98.9% ddH2O+1%乙腈)装入HPLC-Chip富集柱1.5 min后反冲,RP分析柱梯度洗脱;毛细管泵流动相为99% ddH2O+1%乙腈,流速4.0 μL·min-1。
正离子模式下进行蛋白组分析,获取的 MS/MS经MassLynx软件转化为PKL文件。MASCOT v2.2软件(www.matrixscience.com)进行数据库搜索,参数设定:IPI(The international protein index)Mammalia database(Http://www.ncbi.nl-m.nih.gov/);固定修饰选择Carbamoylmethylation(C),可变修饰为Oxidation(M),Trypsin切割,允许最大未酶切位点数为1,肽段质量容差(Peptide Mass Tolerance)为±50 mg·L-1,碎片离子质量容差(Fragment Mass Tolerance)为±0.05 u;肽段评分超过阈值[8]视为鉴定肽段,置信度大于95%。
1.2.8 CART相互作用蛋白分析 通过Cytoscape V3.1.0(插件ClusterViz V3.1.0)导入模块,选择Wikipathways、Reactome、GeneOntology、KEGG Pathway分析计算,并构建蛋白网络图谱。
1.2.9 功能富集性分析 通过Cytoscape V3.1.0对CART相互作用蛋白进行基因功能富集性分析,选择牛基因组数据库,超几何分布检验及本杰明-哈氏假阳性率(False discovery rate,FDR)校正,设定参数P<0.05。
2 结 果
2.1 GCs总蛋白提取及定量
经测定总蛋白浓度为1.78 μg·μL-1,样品可用于Co-IP。
2.2 LC-ESI-Q-TOF质谱鉴定
胰酶酶解的多肽混合溶液经LC分离,质谱仪检测结果显示:一级质谱(MS)检测获得2 522个多肽信息,这些多肽经碰撞诱导解离(CID)获得7 018个碎片离子信息。
图1为左侧的诱饵库与右侧的目标库构成混合数据库,随着峰值肽得分增加,肽段频谱匹配(PSM)数呈下降趋势(图1a);随着峰值肽得分的增加,假阳性率明显降低,母离子质量误差集中在10~30 mg·L-1,混合数据库分界——峰值肽得分(-10lgP)控制在≥23.4(图1b);图2为从头测序(De Novo)肽段置信度分布,图2a诱饵库与目标库重合面积较图2b要小,与目标库频谱匹配肽段非重合区置信度均在50%以上;图2b为De Novo肽段数据库赋值置信度分布,非重合区置信度均在79%以上。结果分析参考B.M.Balgley等[9]的方法,将FDR为1.0%时对应的E值作为阈值来筛选Mascot搜索结果,最终确定肽段频谱与数据库匹配数为2 566个(表1)。
蛋白搜索使用 Mascot v2.2搜索引擎,以NCBI nr数据库(35 149 712 sequences;12 374 887 350 residues)中哺乳动物(Mammalia,2 144 738 sequences)数据库为基础,设定匹配评分≥20,单肽段匹配数≥1,匹配置信度≥50%;显著性阈值(Significance threshold)P<0.05。结果显示,在2 566条频谱匹配肽段中,对应蛋白质组分111个(表1)。
表1 筛选结果统计
Table 1 Statistics of filtered result

项目Filtereditem结果ResultPeptide⁃spectrummatches2566Peptidesequences489Proteingroups111Proteins645Proteins(#UniquePeptides)140(>2);83(=2);422(=1)FDR(Peptide⁃spectrummatches)1.0%FDR(Peptidesequences)4.1%FDR(Protein)0.0%Denovoonlyspectra1109

图1 肽段频谱匹配(PSM)得分分布Fig.1 Peptide-spectrum matches(PSM)score distribution
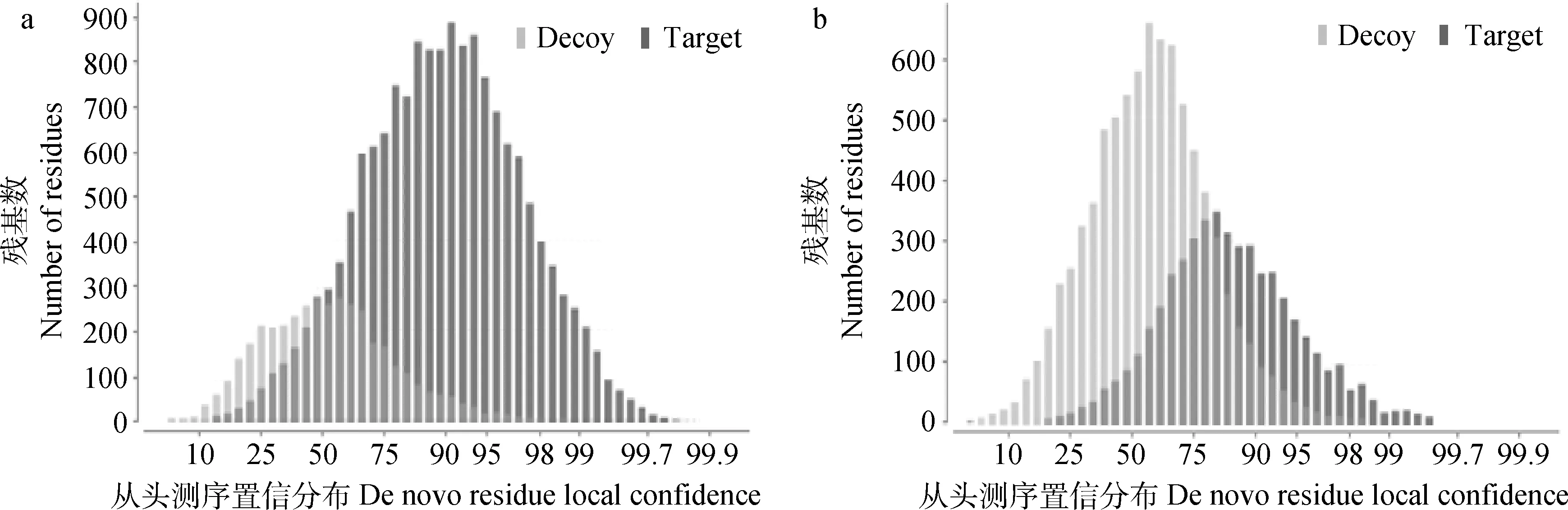
图2 从头测序结果确认——肽段置信分布Fig.2 De novo result validation.Distribution of residue local confidence
2.3 CART相互作用蛋白网络构建
经Cytoscape V3.1.0(插件ClusterViz V3.1.0)导入111个蛋白组分,其中有81个功能模块符合构建CART相互作用网络图谱(图3)。结果表明,α2巨球蛋白(A2M)和波形蛋白(VIM)与CART相互作用的相关系数最大。
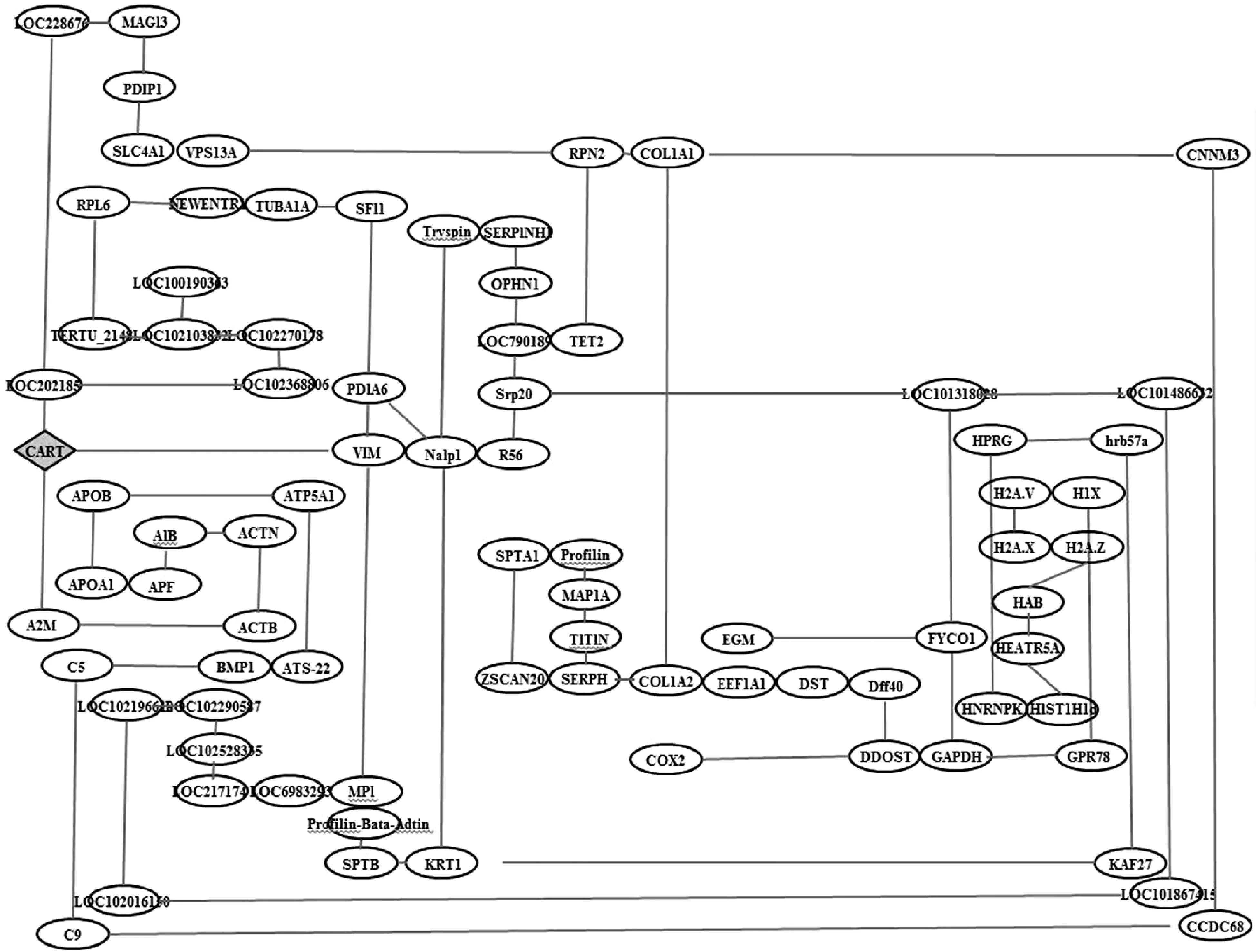
图3 CART相互作用蛋白网络图Fig.3 Protein interaction network diagram on CART
2.4 蛋白功能富集性分析
经Cytoscape V3.1.0导入111个蛋白组分对应的基因,进行基因功能富集性分析,结果见图4,共分为3大类34组:其中分子功能占11.73%,生物学过程占46.93%,细胞组分占41.34%。在卵泡发育过程中,CART主要抑制卵泡GCs的增殖及E2的分泌,从而发挥其负调控的功能,功能富集性分析结果显示,CART与NALP1、SERPINH1和PDIA6的负调控应答(Negative regulation of response)功能提示,这些基因或蛋白可能对卵泡的发育产生重要影响。

图4 CART相互作用网络图Fig.4 Protein interaction network diagram on CART
3 讨 论
蛋白质组学从蛋白质整体作用关系来研究生物有机体[10-11],而PPI作为细胞调节和信号传导的基本要素,对蛋白功能的实现发挥决定作用[12-13]。陈娟[14]应用细菌双杂交技术对CART的PPI做过研究。在本试验中,采用Co-IP技术获得CART蛋白复合体,经酶解及质谱分析对CART的PPI进行研究,Protein G琼脂糖磁珠Co-IP是利用细菌蛋白的“Protein G”作为抗原特异性结合抗体的Fc区段的原理而开发的方法;试验过程中涉及到抗体及总蛋白的纯度、抗体-Agarose beads的特异性结合、复合物洗涤效果及质谱分析结果的鉴定,均会影响到研究结果的准确性。
由相互作用蛋白网络图可知,A2M和VIM与CART的相关系数最大。A2M基因全长4 900 bp,定位于牛第5号染色体,为α-巨球蛋白家族的一员,在动物体内通过对内外源蛋白酶活性的调节来执行其生理功能[15]。VIM(Vimentin)为波形蛋白,在间质组织广泛表达,对细胞完整性的维持及细胞应激反应的产生具有重要作用[16];研究也表明,在许多疾病尤其是一些恶性肿瘤发生过程中,均有VIM的异常表达,造成癌细胞的生长、迁移加速,预后效果较差[17]。仅通过功能及相关系数还不能确定三者的关系,还有待进一步研究。
通过对CART相互作用蛋白的功能富集性分析表明,CART与NALP1、SERPINH1、PDIA6具有负调控应答的功能,可能通过启动GCs凋亡程序进而影响了卵泡的正常发育。NALP1为NOD样受体超家族蛋白,在动物体内诱导细胞凋亡体的形成;整个过程中,caspse-2、caspase-3和caspase-9通过与NALP1相互作用,进一步加速凋亡体的形成。F.Liu等[18]在HELA细胞体外培养研究中证实,NALP1通过诱导激活caspase-3促进HELA细胞的凋亡;C.F.Frederick Lo等[19]通过基因重组技术瞬时表达重组NALP1的神经元发现,该神经元细胞诱导caspase-3活化并促进细胞凋亡,表明NALP1在受损神经元内可能参与细胞凋亡蛋白酶活化的调节。SERPINH1属于丝氨酸蛋白酶抑制剂家族蛋白,通过对该蛋白功能的研究发现:SERPINH1与肿瘤细胞的生长和成骨不全症的形成有关。在人和小鼠体内SERPINH1基因发生变异,可导致蛋白装配、折叠和分泌过程异常,导致胎儿发育受阻及骨骼形成异常[20-22];Y.Y.Yu等[23]应用siRNA干扰技术研究发现,SERPINH1基因沉默后对模型小鼠的肿瘤生长有促进作用,即SERPINH1具有肿瘤抑制作用;PDIA6分布于内质网、高尔基体中心区域,目前,PDIA6与细胞生长调节的相关性主要体现在肿瘤研究方面,PDIA6通过信号通路激活及蛋白折叠反应激活,促进肿瘤的转移和侵袭[24-25]。
为了确定CART的受体,前人已做了大量研究[26-28],到目前基本明确了CART受体的相关特性,但受体蛋白仍未确定。本研究通过Co-IP技术对CART相互作用蛋白进行研究,为进一步确定CART受体奠定基础。
4 结 论
本研究经Co-IP及质谱分析共获得111个CART相互作用蛋白并构建CART相互作用蛋白网络,其中CART与A2M和VIM的相关系数最大;功能富集性分析发现:CART与NALP1、SERPINH1和PDIA6具有负调控应答的功能,提示可能参与牛卵泡发育过程的调控。
[1] SEN A,LÜ L H,BELLO N,et al.Cocaine-and amphetamine-regulated transcript accelerates temination of follicle-stimulating hormone-induced extracellularly regulated kinase 1/2 and Akt activation by regulating the expression and degradation of specific mitogen-activated protein kinase phosphatases in bovine granulosa cells[J].MolEndocrinol,2008,22(12):2655-2676.
[2] LÜ L H,JIMENEZ-KRASSEL F,SEN A,et al.Evidence supporting a role for cocaine-and amphetamine-regulated transcript(CARTPT) in control of granulosa cell estradiol production associated with dominant follicle selection in cattle[J].BiolReprod,2009,81(3):580-586.
[3] 李鹏飞,岳文斌,李富禄,等.可卡因-苯丙胺调控转录肽(CART)对猪卵巢卵泡颗粒细胞雌激素产生的影响[J].畜牧兽医学报,2012,43(12):1879-1886. LI P F,YUE W B,LI F L,et al.Effects of CART on estradiol production of pig ovarian follicular granulosa cellsinvitroculture[J].ActaVeterinariaetZootechnicaSinica,2012,43(12):1879-1886.(in Chinese)
[4] 李鹏飞,岳文斌,黄 洋,等.可卡因-苯丙胺调控转录肽对绵羊卵巢卵泡颗粒细胞雌激素产生的影响[J].畜牧兽医学报,2013,44(6):853-857. LI P F,YUE W B,HUANG Y,et al.Effects of CART on estradiol productioninvitroin follicular granulose cells of sheep ovarian[J].ActaVeterinariaetZootechnicaSinica,2013,44(6):853-857.(in Chinese)
[5] KOBAYASHI Y,JIMENEZ-KRASSEL F,LI Q,et al.Evidence that cocaine-and amphetamine-regulated transcript is a novel intraovarian regulator of follicular atresia[J].Endocrinology,2004,145(11):5373-5383.
[6] 孙晋艳.不同大小猪卵泡颗粒细胞CART mRNA表达与卵泡液雌激素浓度的关系及猪卵泡颗粒细胞体外培养体系的优化[D].太谷:山西农业大学,2012. SUN J Y.Study on the relationship between CART mRNA expression in pig follicular granulosa cells in different sizes and estradiol concentrations in follicular fluid & optimization ofinvitroculture system of pig granulosa cells[D].Taigu:Shanxi Agricultural University,2012.(in Chinese)
[7] 庞钰英.绵羊卵泡CART蛋白表达及其在颗粒细胞体外培养中的作用[D].太谷:山西农业大学,2013. PANG Y Y.Expression of CART protein in sheep ovarian follicles and functions on folliclar granulosa cellsinvitroculture[D].Taigu:Shanxi Agricultural University,2013.(in Chinese)
[8] ZHANG L,XIE J,WANG X,et al.Proteomic analysis of mouse liver plasma membrane:use of differential extraction to enrich hydrophobic membrane proteins[J].Proteomics,2005,5(17):4510-4524.
[9] BALGLEY B M,LAUDEMAN T,YANG L,et al.Comparative evaluation of tandem MS search algorithms using a target-decoy search strategy[J].MolCellProteomics,2007,6(9):1599-1608.
[10] BADER G D,HEILBUT A,ANDRENS B,et al.Functional genomics and proteomics:Charting a multidimensional map of the yeast cell[J].TrendsCellBiol,2003,13(7):344-356.
[11] MORITZ R L,JI H,SCHÜTZ F,et al.A proteome strategy for fractionating proteins and peptides using continuous free-flow electrophoresis coupled off-line to reversed-phase high-performance liquid chromatography[J].AnalChem,2004,76(16):4811-4824.
[12] WALHOUT A J,VIDAL M.Protein interaction maps for model organisms[J].NatRevMolCellBiol,2001,2(1):55-62.
[13] CHEN Z,HAN M.Building a protein interaction map:research in the post-genome era[J].Bioessays,2000,22(6):503-506.
[14] 陈 娟,赵 瑛,由振东.可卡因苯丙胺调节转录肽相互作用蛋白的筛选[J].基础医学与临床,2007,27(1):25-30. CHEN J,ZHAO Y,YOU Z D.Screening of proteins interacting with neuropeptide CART[J].Basic&ClinicalMedicine,2007,27(1):25-30.(in Chinese)
[15] GAETANO J S,SHAWN R B,CAROLINA C,et al.Poster 8 hondroprotective effect of alpha-2-macroglobulin(A2M) on bovine cartilage explants[J].PM&R,2012,4(10):S191.
[16] CLARKE E J,ALLAN V.Intermediate filaments:vimentin moves in[J].CurrBiol,2002,12(17):596-598.
[17] SATELLI A,LI S.Vimentin in cancer and its potential as a molecular target for cancer therapy[J].CellMolLifeSci,2011,68(18):3033-3046.
[18] LIU F,LO C F,NING X,et al.Expression of NALP1 in cerebellar granule neurons stimulates apoptosis[J].CellSignal,2004,16(9):1013-1021.
[19] FREDERICK LO C F,NING X P,GONZALES C,et al.Induced expression of death domain genes NALP1 and NALP5 following neuronal injury[J].BiochemBiophysResCommun,2008,366(3):664-669.
[20] CHRISTIANSEN H E,SCHWARZE U,PYOTT S M,et al.Homozygosity for a missense mutation in SERPINH1,which encodes the collagen chaperone protein HSP47,results in severe recessive osteogenesis imperfecta[J].AmJHumGenet,2010,86(3):389-398.
[21] WIDMER C,GEBAUER J M,BRUNSTEIN E,et al.Molecular basis for the action of the collagen-specific chaperone Hsp47/SERPINH1 and its structure-specific client recognition[J].ProcNatlAcadSciUSA,2012,109(33):13243-13247.
[22] EYRE D R,WEIS M A.Bone collagen:new clues to its mineralization mechanism from recessive osteogenesis imperfecta[J].CalcifTissueInt,2013,93(4):338-347.
[23] YU Y Y,ZENG B,CHAI L M,et al.Effect of serpinH1 on proliferation and growth of murine tumor[J].CancerResTreat,2009,36(9):741-744.
[24] TUFO G,JONES A W,WANG Z,et al.The protein disulfide isomerases PDIA4 and PDIA6 mediate resistance to cisplatin-induced cell death in lung adenocarcinoma[J].CellDeathDiffer,2014,21(5):685-695.
[25] GROENENDYK J,PENG Z,DUDEK E,et al.Interplay between the oxidoreductase PDIA6 and microRNA-322 controls the response to disrupted endoplasmic reticulum calcium homeostasis[J].SciSignal,2014,7(329):ra54.
[26] VICENTIC A,LAKATOS A,KUHAR M J.CART(cocaine-and amphetamine-regulated transcript) peptide receptors:specific binding in AtT20 cells[J].EurJPharmacol,2005,528(1-3):188-189.
[27] KELLER P A,COMPAN V,BOCKAERT J,et al.Characterization and localization of cocaine-and amphetamine-regulated transcript(CART) binding sites[J].Peptides,2006,27(6):1328-1334.[28] MALETNSKL,MAIXNEROVJ,MATYSKOVR,et al.Cocaine-and amphetamine-regulated transcript(CART) peptide specific binding in pheochromocytoma cells PC12[J].EurJPharmacol,2007,559(2-3):109-114.
(编辑 程金华)
Screening Proteins Interacting with Cocaine-and Amphetamine-Regulated Transcript in Bovine Follicles by Co-immunoprecipitation
LI Peng-fei1,MENG Jin-zhu2,LIU Yan2,HUANG Yang2,CHEN Jian-wei2,JIANG Xiao-long2,CAO Xia2,YAO Xiao-lei2,ZHAO Miao-miao2,LÜ Li-hua2*
The study is focused on screening the proteins interacting with cocaine-and amphetamine-regulated transcript(CART) during follicle development in bovine.Four 10-month-old healthy cows,treated for estrus synchronization,were monitored by B-ultrasonic machine to find the ovarian follicles with the diameter of 8-12 mm,which were collected followed by cows being slaughtered.The granulosa cells(GCs) were isolated from those ovarian follicles and then total protein was extracted.CART and the binding protein were deposited by primary antibodies(Rabbit anti CART) using Protein G-Agarose magnetic beads,followed by salt and miscellaneous protein being removed by washing repeatedly.Protein complexes was analyzed by LC-ESI-Q-TOF mass spectrometry(MS) and alignment followed by being eluted and digested by trypsin.Results showed that 111 proteins were identified,in which 81 proteins were functional in conformity with the interaction network modules by Cytoscape V3.1.0 analysis.For the function enrichment analysis,those 81 proteins were classified into 34 groups in 3 categories:molecular function(11.73%),biological processes(46.93%),cell component(41.34%).The correlation coefficient of the interaction between A2M,VIM and CART was maximum.It was also found CART was negatively regulated by NALP1,SERPINH1 and PDIA6,which suggested that they might participate in regulating follicle development in bovine.
bovine;CART;co-immunoprecipitation;mass spectrometry;interaction
10.11843/j.issn.0366-6964.2015.12.007
2015-03-26
国家自然科学基金(31172211);农业部948项目(2010-Z43);山西省横向协作与委托项目(2010HX54);山西省回国留学人员科研资助项目(2014-重点5);山西省科技攻关项目(20130311027-2);山西省人事厅人才引进项目;山西农业大学引进人才博士科研启动费(2014ZZ04);科研管理费资助重大项目和标志性成果培育项目(71060003)
李鹏飞(1978-),男,山西偏关人,博士,副教授,主要从事动物生殖生理方面的研究,E-mail:adamlpf@126.com
*通信作者:吕丽华,E-mail:lihualvsxau@126.com
S823.2
A
0366-6964(2015)12-2169-07
(1.CollegeofLifeScience,ShanxiAgriculturalUniversity,Taigu030801,China;2.CollegeofAnimalScienceandVeterinaryMedicine,ShanxiAgriculturalUniversity,Taigu030801,China)
