5-Azadc 和TSA对鸡Nanog基因启动活性及ESC多能性维持的影响
2015-03-22张亚妮王颖洁左其生汤贝贝毕瑜林张文慧李碧春
张亚妮,王颖洁,左其生,李 东,张 蕾,汤贝贝,连 超,毕瑜林,张文慧,李碧春
(扬州大学动物科学与技术学院 江苏省动物遗传繁育与分子设计重点实验室,扬州 225009)
5-Azadc 和TSA对鸡Nanog基因启动活性及ESC多能性维持的影响
张亚妮,王颖洁,左其生,李 东,张 蕾,汤贝贝,连 超,毕瑜林,张文慧,李碧春*
(扬州大学动物科学与技术学院 江苏省动物遗传繁育与分子设计重点实验室,扬州 225009)
旨在克隆如皋黄鸡Nanog基因启动子,并构建含有双荧光素酶报告基因的表达载体进行启动子活性分析,找出该基因启动子的核心调控区;探索甲基化抑制剂5-Azadc (5-Aza-2′-deoxycytidine)或曲古抑菌素 (Trichostatin A,TSA)对Nanog基因启动活性及其ESC体外培养条件下多能性维持的影响,为初步阐明Nanog基因的表达调控机制提供理论依据。PCR扩增Nanog基因不同长度片段的启动子序列,定向克隆至pGL3-basic载体和pEGFP-N1构建重组载体;将重组载体转染DF-1细胞后,48 h收集蛋白,采用双荧光素酶报告基因检测系统测定其转录活性,确定基本转录调控区;将重组载体转染DF-1细胞后添加5-Azadc或TSA对Nanog基因进行诱导表达,并通过双荧光素酶报告基因检测系统,分析其对Nanog基因启动子活性的影响。选取生长至第3代的ESC,培养基中添加最适浓度的 5-Azadc和TSA,每隔两天观察细胞,分析其对ESC体外多能性维持的影响,并对诱导至第10天的细胞进行间接免疫荧光检测。结果表明,成功构建3个片段的双荧光素酶报告基因表达载体;双荧光素酶活性检测结果显示,pGL3/1967活性最强;分别添加或者联合添加5-Azadc和TSA均可使Nanog基因的转录活性增强;5-Azadc和TSA诱导对ESC体外培养条件下多能性维持的影响结果显示,诱导6 d 后,对照组细胞大量分化,细胞克隆无法维持,而5-Azadc和TSA诱导组克隆明显,5-Azadc+TSA联合诱导组细胞克隆数量显著多于对照组;诱导至第10天,对照组细胞完全分化,没有细胞克隆,而诱导组存在大量细胞克隆,联合诱导组克隆数量显著多于其他两组;SSEA-1间接免疫荧光结果显示,对照组没有明显的ESC克隆,而5-Azadc组和联合诱导组细胞克隆明显,综上表明,5-Azadc和TSA可有效地通过提高Nanog基因的表达而维持鸡ESC在体外培养过程中的多能性。
Nanog基因;启动子;5-Azadc;TSA;双荧光素酶活性检测系统
Nanog蛋白是含有同源盒结构域的转录因子[1],由305个氨基酸组成,其中C端有强的转录激活结构域而N端有弱的转录激活结构域,在维持ESC的多能性过程中起着关键性调控作用[2]。
过表达Nanog的ESC在没有LIF的培养条件下经长时间培养后,仍具有很强的自我复制能力,而且体外诱导试验均证明这些ESC具有多能性[3-4]。Nanog过表达时ESC可在无饲养层的条件下分裂并保持多能性[5-6];I.Chambers等[4]将成年小鼠神经细胞与高表达Nanog的ESC混合培养后发现,成年小鼠神经细胞也表现出ESC的特征。J.Zhang 等[7]用Nanog基因转染小鼠成纤维细胞后发现,Nanog的表达使高度分化的成纤维细胞重新进入S期;J.Yu等[8]利用逆转录病毒介导的Nanog基因转染人成纤维细胞后发现,人成纤维细胞逆转为多能细胞;J.Silva等[9]发现Nanog基因在成体细胞重获多能性的过程中起着关键的作用;在骨骼和成纤维细胞等已分化的成体组织中没有检测到Nanog基因的表达[10]; T.Nishii等[11]研究表明,CIBZ(a BTB domain zinc finger transcriptional factor)依赖Nanog基因的表达来维持ESC的多能性;A.H.Hart等[12]研究表明,Nanog基因在ESC中高表达,而在ESC分化过程中其表达水平下调;由此推测,Nanog基因的表达激活有利于维持ESC的多能性,而其表达抑制则导致ESC分化发生。在分化的细胞中Nanog表达受到限制,说明在分化细胞中有抑制Nanog基因表达的信号途径,因此在维持干细胞多能性的过程中如何解除这种抑制作用是提高维持干细胞多能性的有效措施之一。目前人们对鸡Nanog基因的结构与功能的关系及其调控基因的作用方式尚属空白,研究鸡Nanog基因的表达调节机制,对于阐明禽类胚胎干细胞多能性维持和分化的分子机理具有重要意义。本研究拟克隆如皋黄鸡Nanog基因启动子5′侧翼区不同长度片段的启动子序列,插入到pGL3-Basic构建重组载体,瞬时转染DF-1细胞,利用双荧光素酶报告基因系统寻找Nanog基因核心启动子区,检测Nanog基因启动子活性的变化,寻找Nanog基因的核心启动子区,并初步探索5-Azadc和TSA对Nanog基因启动活性的影响,以期在体外培养条件下提高Nanog基因的表达量,维持鸡ESC在体外培养过程中的多能性,以帮助人们更好地对鸡ESC进行体外遗传修饰和定向诱导分化研究,为生产抗病转基因鸡和具有特殊治疗功能的蛋白质提供技术支持,并为ESC在再生医学、细胞工程和药物研制等领域的应用提供相关基础。
1 材料与方法
1.1 试验材料和试剂
如皋黄鸡来自中国农业科学院家禽研究所。大肠杆菌DH5α感受态、胶回收试剂盒及小提质粒试剂盒均购自北京天根公司,DL 5000 DNA Marker Prime、STAR®Max DNA Polymerase、T4 DNA连接酶及限制性内切酶均购自大连宝生物公司,表达载体pGL3.0-Basic、pRL-SV40 及双荧光素酶检测试剂盒 Dual-Luciferase®Reporter Assay System 均购自Promega 公司,LipofectamineTM2000 购自 Invitrogen公司,5-Azadc和TSA购自SIGMA公司,鸡胚胎成纤维细胞系(DF-1)购自ATCC。其余试剂均为进口或国产分析纯。引物合成及测序由上海英潍捷基公司完成。
1.2 试验方法1.2.1 生物信息学分析 利用在线软件TFsearch(http://www.cbrc.jp/research/db/Tfsearch.html)和AliBaba 2.1(http://www.gene-regulation.com/pub/programs/alibaba2/index.html)对Nanog基因启动子区及其潜在的转录因子结合位点进行预测和分析。利用软件(http://www.urogene.org/cgi-bin/methprimer/methprimer_results.cgi)对Nanog基因的甲基化位点进行预测。
1.2.2 基因组DNA的提取 酚氯仿法(参考《分子克隆试验指南》(第2版))提取成年如皋黄鸡基因组DNA。测定260 nm/280 nm的OD比值及DNA浓度,-20 ℃保存、备用。
1.2.3 如皋黄鸡Nanog基因启动子区不同片段的扩增 根据GenBank 上原鸡Nanog基因序列(GeneID:NC_006088))翻译起始位点(ATG)上游3 000 bp 区域的序列特征分析结果,在上下游引物的5′端分别引入XhoⅠ和KpnⅠ酶切位点和相应的保护碱基,设计不同片段长度的上游引物及共同下游引物。引物序列见表1。
表1Nanog基因启动子不同长度片段引物序列
Table 1 The sequence of primers for constructing the vector ofNanoggene
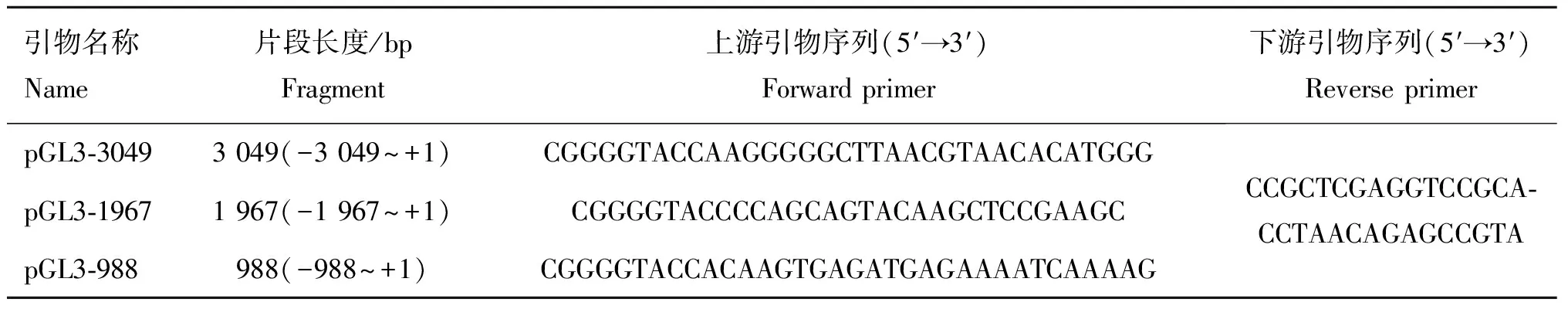
引物名称Name片段长度/bpFragment上游引物序列(5′→3′)Forwardprimer下游引物序列(5′→3′)ReverseprimerpGL3⁃30493049(-3049~+1)CGGGGTACCAAGGGGGCTTAACGTAACACATGGGpGL3⁃19671967(-1967~+1)CGGGGTACCCCAGCAGTACAAGCTCCGAAGCpGL3⁃988988(-988~+1)CGGGGTACCACAAGTGAGATGAGAAAATCAAAAGCCGCTCGAGGTCCGCA⁃CCTAACAGAGCCGTA
以鸡基因组DNA为模板,通过PrimeSTAR®Max DNA Polymerase进行PCR扩增不同长度片段,经1.0%琼脂糖凝胶电泳检测后进行胶回收,将纯化、加A后的PCR产物与pMDTM-19T Vector连接,并转化至感受态细胞DH5α中,经双酶切鉴定及测序正确后,构建正确的TA克隆载体。
1.2.4Nanog基因启动子不同片段重组载体的构建 用KpnⅠ和XhoⅠ分别双酶切克隆载体和pGL3.0-basic载体,酶切片段回收纯化后,连接。转化后,经双酶切鉴定及测序正确后,分别命名pGL3/3049、pGL3/1967、pGL3/988。
1.2.5Nanog基因启动子定性分析 将细胞接种于12孔板,细胞浓度约5×105孔-1,待细胞完全贴壁生长至80%左右时,参照LipofectamineTM2000使用说明书,将重组质粒pEGFP-N1/3049转染至DF-1细胞中,同时设置阳性对照组(pEGFP-N1转染细胞)和阴性对照组(pEGFP-N1-CMV-转染细胞),转染24 h 后于荧光倒置显微镜下观察荧光表达情况。
1.2.6 细胞瞬时转染及其5-Azadc 和TSA诱导对Nanog基因启动子活性的影响 转染前,将细胞接种于24孔板,细胞数2.5×105孔-1,待细胞完全贴壁生长至80%左右时,参照LipofectamineTM2000使用说明书,分别将重组质粒和内参质粒pRL-SV40以35∶1的比例共转染至DF-1细胞中,同时设置阴性对照组(pGL3-basic质粒与pRL-SV40质粒共转染),转染48 h后收集细胞,进行双荧光素酶活性检测。每组3次重复。
转染后12 h 换液时,添加不同浓度的5-Azadc 和TSA对转染重组质粒的DF-1细胞进行诱导,36 h后进行双荧光素酶活性检测,找到最适宜的诱导浓度。然后以最适浓度设立5-Azadc 和TSA单独诱导组或联合添加诱导组,通过检测双荧光素酶活性检测二者的诱导效果。
1.2.7 双荧光素酶活性检测 将收集后的细胞用70 μL的PBS重悬后,加入到96孔酶标板中,参照Dual-Luciferase®Reporter Assay System试剂盒说明书步骤,检测双荧光素酶活性。启动子活性值为荧光素酶相对活性值(Relative luciferase activity)即萤火虫荧光素酶活性值/海肾荧光素酶活性值。采用“平均值±标准差”的形式表示。
1.2.8 5-Azadc 和TSA诱导对ESC体外培养条件下多能性的影响 为了验证5-Azadc 和TSA对ESC体外多能性的影响,选择第3代生长良好的ESC接种到24孔板中,接种密度为105孔-1,培养基中添加最适浓度的5-Azadc 和TSA进行诱导。接种后每隔2 d在荧光倒置显微镜下观察细胞,并对诱导至第10 天 的细胞进行SSEA-1间接免疫荧光检测。
推荐理由:宪法上的基本权利,是有效力的法规范。建构基于宪法文本的解释方案,厘清基本权利条款的规范结构和规范内涵,使之在技术层面上成为可以适用的规范,是宪法学的基本任务。《基本权利的规范建构(增订版)》是基本权利总论领域的体系性著作,围绕基本权利的功能,基本权利的国家义务,基本权利的保护范围、限制、竞合、冲突等问题进行了教义学建构,并回应了中国法治实践中的众多基本权利问题。
2 结 果
2.1 鸡Nanog基因启动子区生物信息学分析和甲基化水平检测
对Nanog启动子区域进行转录因子结合区域预测后发现,在Nanog基因启动子的-3 049 ~-1 967 bp存在GCNF、Tcf3和P53等转录因子结合位点,而在-1 967 ~-988 bp存在p300和SP1/SP3等调控元件。甲基化预测结果显示,在-1 387~-1 285 bp 和-157 ~+56 bp分别存在101 和103 bp的CpG岛。
2.2 鸡Nanog基因启动子区不同长度片段的PCR扩增
1%琼脂糖凝胶电泳检测结果表明,所获得的不同长度片段的PCR产物大小分别与预期设计的长度相一致(图1),表明成功获得了目的DNA片段。

M.DNA相对分子质量标准;1~3. PCR扩增产物M.1 kb DNA marker;1-3. PCR products图1 Nanog基因不同长度片段启动子的PCR扩增Fig.1 PCR products of different length promoters
2.3 鸡Nanog基因启动子不同长度片段载体的构建
用KpnⅠ和XhoⅠ双酶切3个不同长度片段载体,1%琼脂糖凝胶电泳检测(图2),分别获得相应启动子片段和载体片段两条清晰的条带,大小与预期结果相符合,且测序结果经对比后也一致,说明载体构建正确,可用于后续试验。
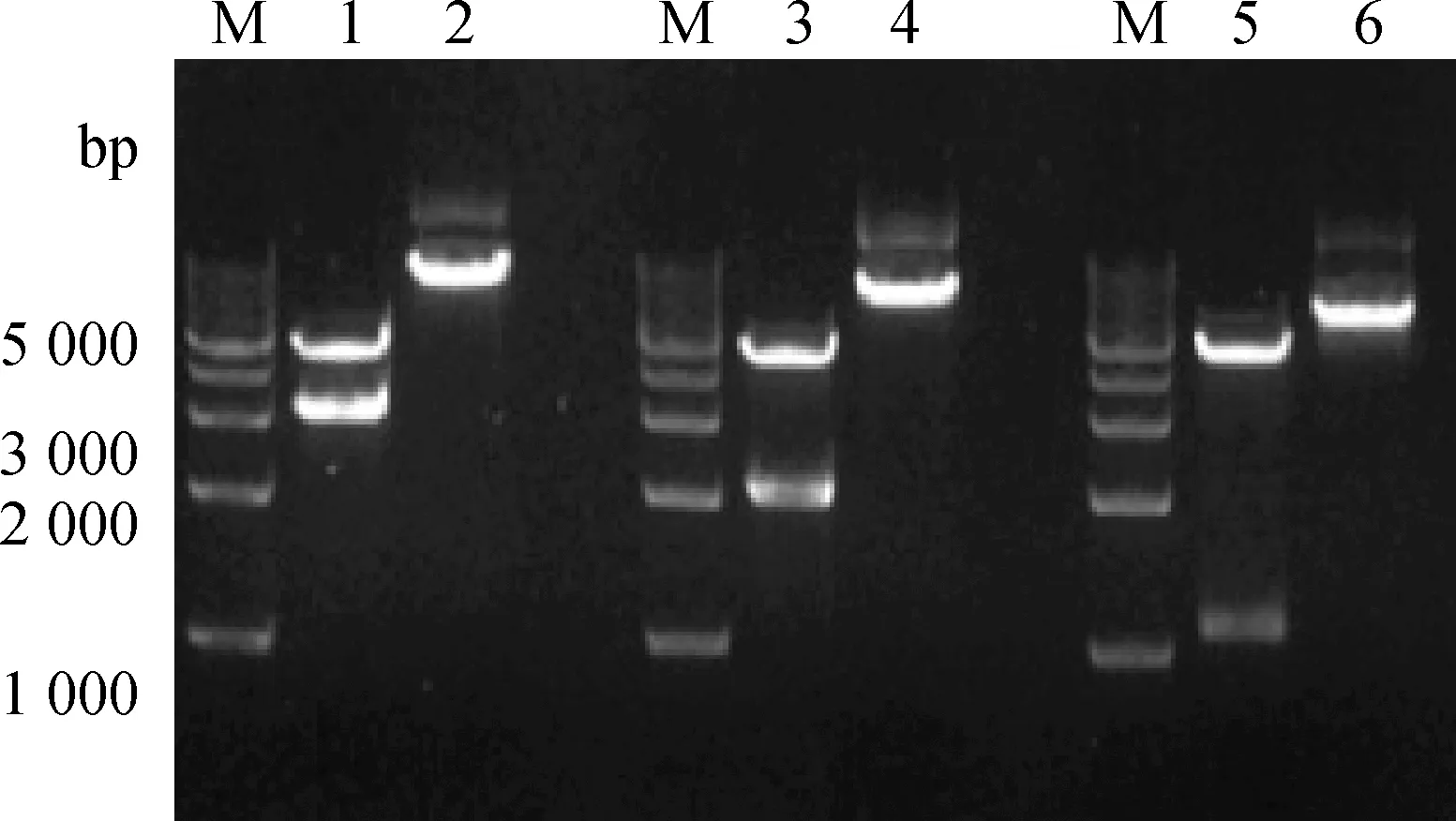
M.DNA相对分子质量标准;1、3、5.pGL3/3049、pGL3/1967和pGL3/988重组质粒双酶切;2、4、6.pGL3/3049、pGL3/1967和pGL3/988重组质粒单酶切M.DL5 000 DNA marker;1,3,5.Double restriction enzyme digestion products of pGL3/3049,pGL3/1967 and pGL3/988;2,4,6.Single restriction enzyme digestion products of pGL3/3049,pGL3/1967 and pGL3/988图2 pGL3/3049、pGL3/1967和pGL3/988重组载体的酶切鉴定Fig.2 Identification of pGL3/3049,pGL3/1967 and pGL3/988 by restriction enzyme digestion
2.4 鸡Nanog基因启动子活性的定性分析
为检测片段-3 049~+1 bp 是否具有启动子活性,将pEGFP-N1/3049、pEGFP-N1、pEGFP-N1-CMV-转染DF-1细胞。结果表明,pEGFP-N1/3049转染的DF-1细胞表达GFP(图3A),但其荧光强度较强启动子CMV驱动的阳性对照质粒pEGFP-N1弱(图3B),而缺失CMV的阴性对照质粒pLinker-EGFP-在细胞中未检测到GFP的表达(图3C)。 因此,-3 049~+1 bp片段具有启动子活性。

图3 鸡Nanog基因启动子-3 049~+1 bp片段的活性检测 40×Fig.3 The promoter activity detection of chicken Nanog -3 049-+1 bp 40×
用构建的3个重组载体和pRL-SV40载体分别共转染DF-1细胞,pGL3-Basic质粒作为阴性对照,检测各自启动子活性(图4)。结果表明:与pGL3-Basic相比较,鸡Nanog基因启动子系列缺失片段都表现出一定的活性,重组质粒pGL3/1967的启动子活性最强,说明Nanog基因启动子的-1 967~-998 bp和-3 049 ~-1 967 bp具有重要的调控元件。

图4 Nanog基因启动子不同长度片段在DF-1细胞中的活性Fig.4 Activity of different promoters of Nanog gene DF-1 cells
2.6 5-Azadc和TSA诱导对Nanog基因启动子活性的影响
由图4可知,pGL3/1967的活性最高,因此选-1 967~+1 bp进行诱导活性检测。DF-1细胞经pGL3/1967转染后,采用不同浓度梯度(终浓度分别为1、5、10和15 μmol·L-1)的5-Azadc对其进行诱导,通过检测双荧光素酶活性确定最佳诱导浓度。不同浓度的诱导结果显示:与对照组相比,终浓度为10 μmol·L-1的5-Azadc的诱导效率最高(图5A)。Nanog基因启动子区的甲基化检测结果显示,用5-Azadc处理后明显降低了Nanog基因的甲基化水平。分别设置4个不同浓度梯度(0.1、0.5、1.0和1.5 μmol·L-1)的TSA进行诱导,终浓度为1.0和1.5 μmol·L-1时可极显著提高其启动活性(图5B)。因此,选择TSA的最佳诱导浓度为1.0 μmol·L-1。
用pGL3/1967转染DF-1细胞后,培养基中分别单独添加或者联合添加终浓度为10 μmol·L-15-Azadc、1.0 μmol·L-1TSA对其进行诱导。结果显示,联合添加5-Azadc和TSA后使-1 967~+1 bp片段的转录活性显著高于单独添加组(图5 C)。
2.7 5-Azadc和TSA诱导激活Nanog基因维持ESC体外培养多能性的影响
取培养第3代纯化后的ESC细胞进行5-Azadc和TSA的诱导试验,结果显示,诱导6 d后,对照组细胞大量分化,细胞克隆无法维持,而5-Azadc和TSA诱导组克隆明显,5-Azadc+TSA联合诱导组细胞克隆数量显著多于对照组;诱导至第10 天,对照组细胞完全分化,没有细胞克隆,而诱导组存在大量细胞克隆,联合诱导组克隆数量显著多于其他3组(图6A和B)。
取诱导至10 d 的细胞进行SSEA-1间接免疫荧光试验,结果显示,对照组没有明显的ESC克隆,而5-Azadc组和联合组细胞克隆明显(图7)。实时荧光定量检测结果发现对照组Nanog基因表达量随着诱导天数延长持续下降,而试验组Nanog基因维持相对稳定的水平,进一步表明,5-Azadc和TSA可有效地维持鸡ESC在体外培养过程中的多能性。

A.5-Azadc最佳诱导浓度的筛选;B.TSA最佳诱导浓度的筛选;C.5-Azadc和TSA联合诱导效果检测A.The optimal induction concentration screening of 5-Azadc; B.The optimal induction concentration screening of 5-Azadc; C.The combination induction effect of 5-Azadc and TSA on Nanog gene promoter图5 5-Azadc 和 TSA诱导对Nanog基因启动活性的影响Fig.5 Effects of 5-Azadc and TSA induction on Nanog promoter activity
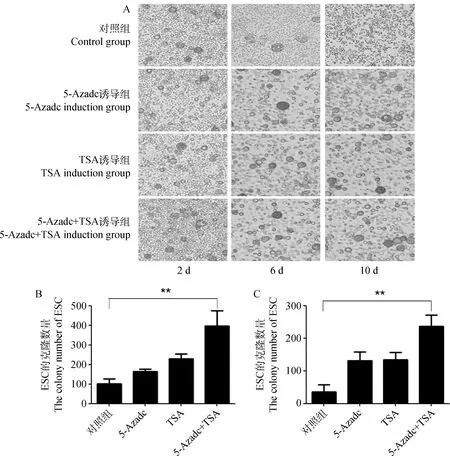
A.不同诱导组ESC细胞克隆40×;B和C.第6和第10天不同诱导组ESC的克隆数量A.ESC cell clone of different induction group 40×;B and C.The number comparation of different group at the 6th and 10th induction图6 5-Azadc和TSA诱导对ESC体外分化的影响Fig.6 The effect of 5-Azadc and TSA induction on the differentiation of ESC in vitro
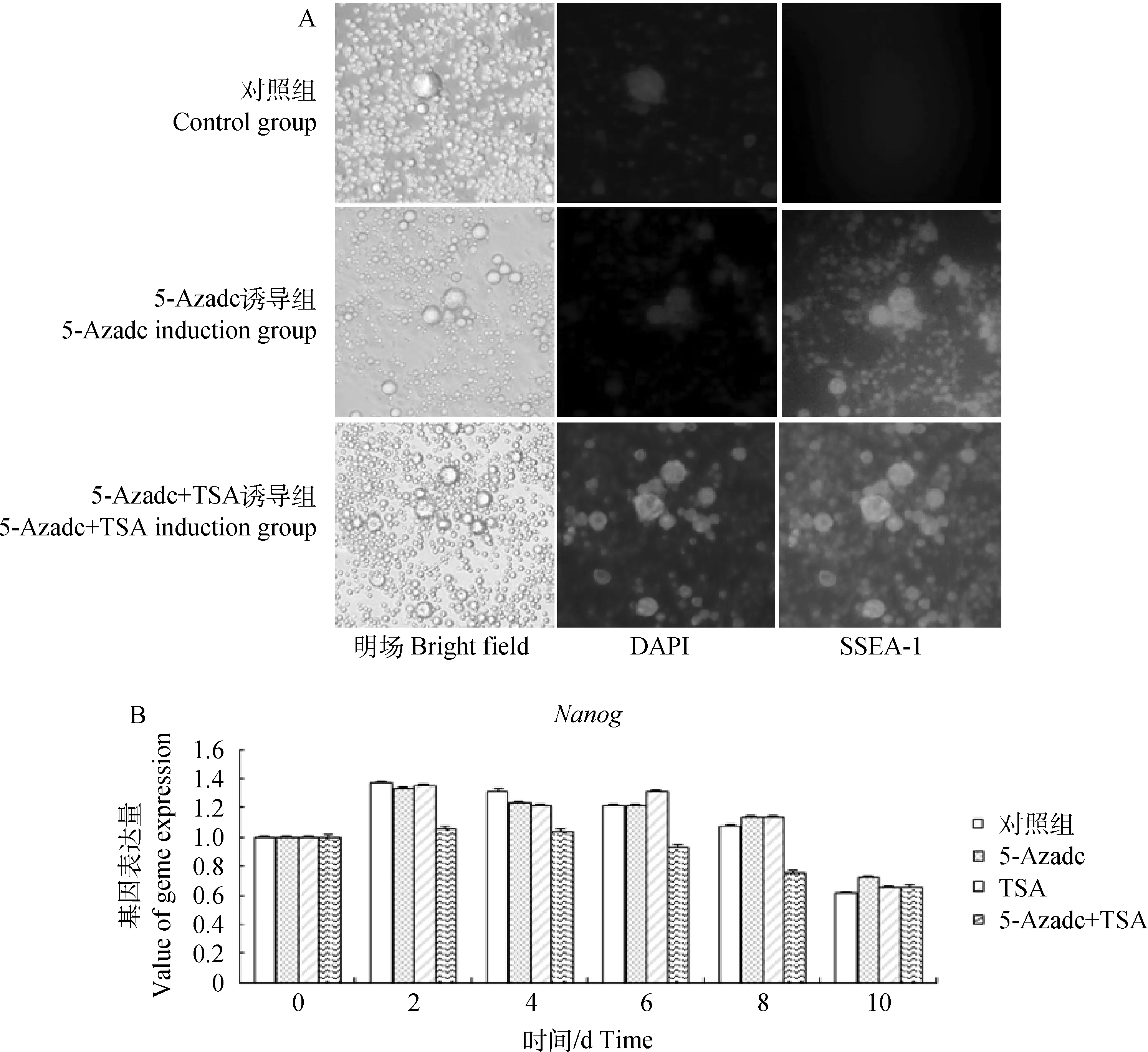
图7 SSEA-1间接免疫荧光(A 40×)和Nanog定量检测(B)Fig.7 Immunofluorescence staining of SSEA-1(A 40×) and real time quantitative detection of Nanog(B)
3 讨 论
本实验室一直致力于鸡ESC向雄性生殖细胞分化的研究,由于ESC是原代细胞,在长时间的体外培养过程中会发生老化和自发分化,致使其丧失多能性,严重影响体外遗传修饰和定向诱导分化的效率。因此,如何在体外培养条件下使鸡ESC较长时期处于未分化状态和维持多能性就显得尤为重要。尽管许多研究表明添加LIF或BMP4 等细胞因子能够维持ESC细胞的多能性[13-14],但需将ESC生长于饲养层细胞上或在培养基中添加细胞因子、生长因子、激素、胎牛血清或血清抽提物等。最新的研究结果表明,利用一些特定的小分子化合物和无任何生长因子的基础培养基就能很好地维持ESC的不分化状态和多能性,尤其是目前已从化学分子库中筛选出一些小分子化合物,并且成功地应用于ESC多能性维持的研究中,这些小分子化合物的应用简化了试验步骤、无需制备饲养层细胞,且避免了动物源性污染,使得培养体系的组分具体化,对延长ESC在体外培养条件下多能性的维持具有重要的意义。
DNA甲基化(DNA methylation)是发现较早的一种重要的DNA表观遗传修饰方式。具体指的是在DNA甲基转移酶(DNA methyltransferase,DMT)的催化作用下,生物体内甲基被选择性地添加到DNA序列的CG两个核苷酸的胞嘧啶上,形成5-甲基胞嘧啶的过程。甲基化发生会导致核小体之间发生紧密结合从而使基因的表达受到抑制。但是,通过添加小分子化合物使基因发生去甲基化可使基因再次表达。5-Azadc就是一种临床普遍应用且效果极佳甲基化抑制剂,大量研究表明,对于因发生甲基化而造成表达沉默的基因,采用5-Azadc进行处理后,基因能够重新得到表达[15-16]。为了研究DNA甲基化对鸡Nanog基因启动子活性及表达的影响,本研究对Nanog基因启动子区的甲基化进行预测,发现在-1 662~-1 764 bp和-2 892~-2 993 bp分别存在103和102 bp的CpG岛,因此采用5-Azadc处理转染pGL3/1967双荧光素酶报告基因载体的DF-1细胞,检测Nanog启动子的活性变化以分析DNA甲基化程度对启动子活性及表达的影响;与对照组相比较,经5-Azadc处理后pGL3/1967的转录活性提高8倍,进一步推测采用5-Azadc处理后抑制了Nanog基因启动子区的甲基化,从而促使其启动活性增强。由于Nanog基因的表达活性增强,有利于维持ESC的多能性,促使大量的ESC克隆出现。
组蛋白乙酰化是一个可逆的反应,包含组蛋白乙酰转移酶(Histone acetyltransferase,HAT)和组蛋白去乙酰化酶(Histone deacetylase,HDAC),二者相互进行反应。组蛋白的乙酰化有利于DNA与组蛋白八聚体的解离,核小体结构松弛,从而使各种转录因子和协同转录因子能与DNA结合位点特异性结合,激活基因的转录。组蛋白的去乙酰化,使得其与带负电荷的DNA紧密结合,染色质致密卷曲,基因的转录受到抑制。曲古抑菌素(Trichostin A,TSA)能够与HDAC结合,抑制组蛋白去乙酰化,促进基因表达[17-18]。R.Cotterman 等[19]研究证实,可以通过改变基因富集区域和已知基因远距离区域的组蛋白乙酰化来调节整个基因组的染色质结构。本试验中,为进一步验证Nanog基因的表达是否存在组蛋白修饰,采用组蛋白去乙酰化酶抑制剂TSA来诱导Nanog启动活性。分别探索了4个不同浓度梯度的TSA对Nanog基因启动活性的影响,发现终浓度为1.0和1.5 μmoloL-1时均可极显著提高Nanog启动活性,表明Nanog基因存在组蛋白修饰作用。即通过TSA处理后,抑制了组蛋白的去乙酰化,促进Nanog基因的转录,使其在ESC的表达量增多,促使较多数目的ESC克隆出现,延长ESC体外培养的多能性。
综上表明,本研究成功构建了pEGFP-N1/3049,对Nanog启动子活性进行定性验证,证明其具有启动活性;通过构建包含3个不同长度Nanog基因启动子片段的荧光素酶报告载体,分别转染了DF-1细胞,说明Nanog基因启动子的-1 967~-998 bp具有正调控元件,而在-3 049~-1 967 bp具有负调控元件。根据对Nanog基因启动子区的甲基化分析结果,发现添加5-Azadc后能明显促进Nanog基因的启动活性,进一步表明该基因的启动受到甲基化水平的调控,这与CEF细胞和ESC细胞Nanog基因的甲基化检测水平相一致,提示分化的细胞中Nanog低表达可能是由于甲基化修饰造成的。TSA的联合添加进一步提高了Nanog基因的启动活性,说明Nanog基因的表达亦受到乙酰化水平的调控,提示在后续的研究中,如果要在体外通过提高Nanog基因的表达量而延长ESC细胞的多能性维持时间可通过添加诱导剂5-Azadc和TSA来实现。此外,本研究通过启动子预测软件Promoter Scan和TFSEARCH database预测分析后发现:在Nanog基因启动子的-3 049~-1 967 bp存在GCNF、Tcf3和P53等转录因子结合位点,双荧光素酶活性检测结果显示,缺失该段导致Nanog的转录活性提高,因此,下一步将定点缺失该结合位点,进一步验证Nanog的启动子活性,进而阐明鸡Nanog基因转录调控机制,为有效地提高Nanog的表达水平提供参考依据。
[1] SUMER H,LIU J,MALAVER-ORTEGA L F,et al.NANOG is a key factor for induction of pluripotency in bovine adult fibroblasts[J].JAnimSci,2011,89(9):2708-2716.
[2] THEUNISSEN T W,SILVA J C.Switching on pluripotency:a perspective on the biological requirement of Nanog[J].PhilosTransRSocLondBBiolSci,2011,366(1575):2222-2229.
[3] MITSUI K,TOKUZAWA Y,ITOH H,et al.The homeoprotein Nanog is required for maintenance of pluripotency in mouse epiblast and ES cells[J].Cell,2003,113(5):631-642.
[4] CHAMBERS I,SILVA J,COLBY D,et al.Nanog safeguards pluripotency and mediates germline development[J].Nature,2007,450(7173):1230-1234.
[5] DARR H,MAYSHAR Y,BENVENISTY N.Overexpression of NANOG in human ES cells enables feeder-free growth while inducing primitive ectoderm features[J].Development,2006,133(6):1193-1201.
[6] KUIJK E W,VAN MIL A,BRINKHOF B,et al.PTEN and TRP53 independently suppress Nanog expression in spermatogonial stem cells[J].StemCellsDev,2010,19(7):979-988.
[7] ZHANG J,WANG X,CHEN B,et al.Expression of Nanog gene promotes NIH3T3 cell proliferation[J].BiochemBiophysResCommun,2005,338(2):1098-1102.
[8] YU J,VODYANIK M A,SMUGA-OTTO K,et al.Induced pluripotent stem cell lines derived from human somatic cells[J].Science,2007,318(5858):1917-1920.
[9] SILVA J,NICHOLS J,THEUNISSEN T W,et al.Nanog is the gateway to the pluripotent ground state[J].Cell,2009,138(4):722-737.
[10] MOON J H,KWON S,JUN E K,et al.Nanog-induced dedifferentiation of p53-deficient mouse astrocytes into brain cancer stem-like cells[J].BiochemBiophysResCommun,2011,412(1):175-181.
[11] NISHII T,OIKAWA Y,ISHIDA Y,et al.CtBP-interacting BTB zinc finger protein(CIBZ) promotes proliferation and G1/S transition in embryonic stem cells via Nanog[J].JBiolChem,2012,287(15):12417-12424.
[12] HART A H,HARTLEY L,IBRAHIM M,et al.Identification,cloning and expression analysis of the pluripotency promoting Nanog genes in mouse and human[J].DevDyn,2004,230(1):187-198.
[13] YING Q L,NICHOLS J,CHAMBERS I,et al.BMP induction of Id proteins suppresses differentiation and sustains embryonic stem cell self-renewal in collaboration with STAT3[J].Cell,2003,115(3):281-292.
[14] KUNATH T,SABA-EL-LEIL M K,ALMOUSAILLEAKH M,et al.FGF stimulation of the Erk1/2 signalling cascade triggers transition of pluripotent embryonic stem cells from self-renewal to lineage commitment[J].Development,2007,134(16):2895-2902.
[15] 王 海.5-氮杂2’-脱氧胞苷联合曲古抑菌素A对人胃癌SGC-7901细胞生长、Reprimo基因甲基化水平及表达的影响[D].合肥:安徽医科大学,2012. WANG H.Effects of 5-Aza-2’-deoxycytidine and trichostatin A on expression,methylation of reprimo gene and the growth of human gastric cancer cell line SGC-7901[D].Hefei:Anhui Medical University,2012.(in Chinese)
[16] 刘林青.5-氮杂-2-脱氧胞苷及曲古抑菌素A对胃癌细胞株SGC-7901及其CHFR基因表达的影响[D].合肥:安徽医科大学,2013. LIU L Q.The effects of 5-Aza-2’-deogycytidine combined with Trichostatin A on the proliferation and CHFR expression of gastric cancer cell line SGC-7901[D].Hefei:Anhui Medical University,2013.(in Chinese)
[17] 丁 辉.组蛋白去乙酰化酶抑制剂曲古菌素A治疗膀胱癌的相关作用机制研究[D].兰州:兰州大学,2013. DING H.The mechanism study of histone deacetylase inhibitor trichostatin A on bladder cancer[D].Lanzhou:Lanzhou University,2013.(in Chinese)
[18] 王雅新.曲古抑菌素A(TSA)在IFN-γ调控TRIM22表达中的作用及其机制研究[D].上海:复旦大学,2011. WANG Y X.Modulation of IFN-y-induced TRIM22 expression by histone deacetylase inhibitor TSA and the underlying mechanism[D].Shanghai:Fudan University,2011.(in Chinese)
[19] COTTERMAN R,JIN V X,KRIG S R,et al.N-Myc regulates a widespread euchromatic program in the human genome partially independent of its role as a classical transcription factor[J].CancerRes,2008,68(23):9654-9662.
(编辑 程金华)
Effects of 5-Azadc and TSA Induction on Promoter Activity ofNanogand Pluripotency Maintaining in Chicken
ZHANG Ya-ni,WANG Ying-jie,ZUO Qi-sheng,LI Dong,ZHANG Lei,TANG Bei-bei,LIAN Chao,BI Yu-lin,ZHANG Wen-hui,LI Bi-chun*
(CollegeofAnimalScienceandTechnology,YangzhouUniversity,KeyLaboratoryofAnimalBreedingReproductionandMolecularDesignforJiangsuProvince,Yangzhou225009,China)
The aim of this study was to cloneNanoggene promoter of chicken and construct the expression vector containing dual luciferase report gene to analyze the promoter activity,find out its core regulatory region,explore the effect of 5-Azadc(5-Aza-2′-deoxycytidine) and TSA(Trichostatin A)on its promoter activity and ESC pluripotent maintaininginvitrocondition,so as to elucidate preliminarily the regulating mechanisms ofNanoggene and provide the theory basis for the future research.The different length fragmentsNanoggene promoter was amplified by PCR technology and cloned into pGL3-basic vector or pEGFP-N1 directly to construct a recombinant vector.After the recombinant vector was transfected into DF-1 cells for 24 h and the protein was collected,the transcriptional activity ofNanoggene was measured by dual luciferase assay system to search for the basic transcriptional regulatory region;The recombinant vector was transfected into DF-1 cells,and methylation inhibitor 5-Azadc or histone deacetylase inhibitor TSA was added to detect its effect on the promoter activity.The third generation ESC was selected and grown into the medium supplemented with the optimum concentration of 5-Azadc and TSA,the cells were observed every 2 d to analyze the pluripotent maintaining of ESCinvitroculture condition,and indirect immune fluorescence of SSEA-1 was detected on the tenth days induction.The results showed that 3 dual luciferase report gene expression vector was constructed successfully.The strongest dual luciferase activity was shown by pGL3/1967;the transcription activity ofNanoggene was enhanced when 5-Azadc and TSA was added single or together.ESC was cultured in the medium with 5-Azadc and TSAinvitro,a great number of cells differentiated after 6 d of induction and cell colony was not maintained in control group,while the cell colony in 5-Azadc and TSA induction group was significant higher than the control group;On the tenth days induction,the cells in control group were fully differentiated,there were still a large number of cell clone in the 5-Azadc + TSA group,the number of colony were significantly more than the other 3 groups;the results of indirect immunofluorescence showed there was no cell colony in the control group,but more colonies were observed in the 5-Azadc and TSA induction group.It further showed that 5-Azadc and TSA could effectively maintain ESC pluripotence of chickeninvitroculture condition by increasing the expression ofNanoggene.
Nanog;promoter;5-Azadc;TSA;dual luciferase activity system
10.11843/j.issn.0366-6964.2015.12.008
2015-02-11
国家自然科学基金(31301959;31272429;31472087);高等学校博士学科点专项科研基金(20123250120009);中国博士后基金((2012M511326));江苏高校优势学科建设工程资助项目
张亚妮(1977-),女,陕西渭南人,副教授,博士,主要从事动物胚胎工程与遗传工程研究,E-mail:ynzhang@yzu.edu.cn
*通信作者:李碧春,教授,博士,主要从事动物胚胎工程与遗传工程研究,E-mail:yubcli@yzu.edu.cn
S831.2
A
0366-6964(2015)12-2176-09
