猪MyD88基因干扰重组慢病毒载体的构建、病毒包装及效果评价
2015-03-22夏日炜殷学梅喻礼怀朱国强吴圣龙包文斌
訾 臣,夏日炜,殷学梅,喻礼怀,朱国强,吴圣龙*,包文斌*
(1.扬州大学动物科学与技术学院,江苏省动物遗传繁育与分子设计重点实验室,扬州 225009;2.扬州大学兽医学院,扬州 225009)
猪MyD88基因干扰重组慢病毒载体的构建、病毒包装及效果评价
訾 臣1,夏日炜1,殷学梅1,喻礼怀1,朱国强2,吴圣龙1*,包文斌1*
(1.扬州大学动物科学与技术学院,江苏省动物遗传繁育与分子设计重点实验室,扬州 225009;2.扬州大学兽医学院,扬州 225009)
髓性分化因子88 (MyD88) 作为TLRs/IL-1R信号通路中重要的接头蛋白,在免疫应答和疾病防御中起重要作用,作者拟通过慢病毒介导的RNA干扰技术获得MyD88基因沉默的猪小肠上皮细胞,为致病菌引起肠道疾病机制研究提供有效模型。共构建4个靶向猪MyD88基因的shRNA表达载体和1个MyD88基因高表达载体,通过实时荧光定量PCR方法鉴定瞬时共转染293细胞中MyD88基因转录水平,筛选获得干扰猪MyD88基因效率最高的shRNA表达载体,将其包装成慢病毒载体,用于建立MyD88基因稳定沉默的猪小肠上皮细胞。最终成功获得MyD88基因沉默效率达到69.3%的小肠上皮细胞,达到基因功能分析的要求。MyD88基因稳定沉默猪肠上皮细胞的获得,为猪肠道病原微生物所引起的TLRs/IL-1R信号通路作用机制的研究提供了宝贵材料。
猪;MyD88基因;基因沉默;慢病毒载体
髓性分化因子88 (myeloid differentiation protein 88,MyD88) 是TLRs/IL-1R (Toll-like receptors /interleukin-1 receptor) 信号通路中重要的接头蛋白,其本质是一种细胞质的可溶性蛋白质,包含N 端的死亡结构域 (death domain,DD) 和 C 端的TIR结构域 (Toll/interleukin-1 receptor domain)[1]。其TIR结构域与TLRs和IL-1R的TIR 结构域结合后激活IRAK-1/4 (interleukin receptor associated kinase) 和TRAF-6 (TNF receptor associated factor 6),最终活化NF-κB (nuclear factor kappa B) 从而激发促炎因子和多种细胞介质的释放,并活化淋巴细胞加速炎症反应蛋白的合成[2-6]。TIR结构域在MyD88信号转导中起到关键作用,MyD88 通过其C 端的 TIR 结构域与膜受体的 TIR结构域作用,向下游传递信号,且MyD88 所参与的不同受体活化信号在下游传递中基本相似。除了 TLR3 之外,TLRs家族所有成员均可以通过 MyD88 依赖途径介导下游信号传导。
猪MyD88基因位于猪第13号染色体,编码293个氨基酸的序列,与人相比相似性达到87%~88%,其在各组织中广泛表达,特别是在免疫组织和肠道组织中高表达[7-8]。这种表达规律与MyD88的功能以及TLRs/IL-1R信号通路在猪肠道中免疫反应及感染防御中的重要作用有关。种类繁多和数量庞大的肠道微生物与消化食糜及肠道组织共同组成一个复杂环境,病原菌侵入和肠道菌群失衡都可能造成肠道疾病的发生,如产肠毒素大肠杆菌就是在仔猪断奶时引起腹泻和水肿病的主要病原菌。因此对MyD88基因功能的研究有利于解释其在猪肠道疾病发生及免疫调控中的作用机制,而肠上皮细胞系作为体外水平研究基因功能的有效模型,可用于模拟MyD88基因在肠道中的免疫调控作用。在国内外相关研究中,尚未见关于靶向猪MyD88基因的shRNA表达载体或者敲除的研究报道。鉴于MyD88基因在猪肠道抵御病原感染调控中的重要作用,本试验首次通过构建靶向猪MyD88基因的shRNA表达载体,筛选高效的干扰序列并包装成慢病毒载体,以猪肠上皮细胞系(IPEC-J2)为素材,获得稳定沉默MyD88基因的猪肠上皮细胞,为MyD88的功能以及TLRs/IL-1R信号通路在猪肠道免疫应答和抗病原的作用机制研究提供宝贵的试验材料。
1 材料与方法
1.1 材料
干扰载体pcDNATM6.2-GW/EmGFP-miR、pMD-18T、pcDNA3.1(+)、pDONR 221、pLenti6.3/V5-DEST载体、载体构建试剂盒BLOCK-iTTMPol II miR RNAi Expression Vector Kit with EmGFP、Packaging Mix、T4 DNA连接酶、高纯度质粒提取试剂盒、脂质体2000、Trizol均购自Invitrogen公司(美国);克隆宿主菌大肠杆菌(Escherichiacoli)DH5α由本实验室保存,IPEC-J2小肠上皮细胞系由美国宾夕法尼亚大学惠赠;胎牛血清、DMEM和Opti-MEM培养基均购自Gibco公司(美国);SYBR premix ExTaq购自TaKaRa公司(中国,大连)。
1.2 引物设计及序列合成
根据MyD88基因编码序列(NM_001099923.1)设计4个针对MyD88基因的干扰序列,序列情况见表1;设计MyD88编码区克隆PCR引物,见表2;设计实时荧光定量PCR引物,见表3。
1.3 干扰载体构建
将合成序列的Oligo DNA序列通过退火处理,克隆入pcDNA6.2-GW/EmGFP载体。方法如下:将5对Oligo各自退火成双链,正反单链各5 μL (100 μmol·L-1),退火缓冲液 (10×) 2 μL,双蒸水8 μL,置于95 ℃加热5 min,然后放置室温自然冷却20 min,形成双链。4 μL双链DNA (10 nmol·L-1),2 μL pcDNA6.2-GW/EmGFP (100 ng·μL-1),1 μL T4 DNA连接酶 (1 U·μL-1),4 μL连接缓冲液 (5×),9 μL双蒸水,室温连接处理30 min。连接产物分别转化感受态细胞DH5α,从含大观霉素固体培养板上挑取多个单克隆提取质粒并进行测序验证。经测序验证序列连接正确后,抽提高纯度质粒备用。
表1 shRNA 寡聚单链DNA序列
Table 1 The single-strand DNA sequence of shRNAs

名称Nameoligo序列(5'-3')Sequenceoftheoligo(5'-3')1FTGCTGttcggcagtcctcttcaatgcGTTTTGGCCACTGACTGACgcattgaaggactgccgaa1RCCTGttcggcagtccttcaatgcGTCAGTCAGTGGCCAAAACgcattgaagaggactgccgaaC2FTGCTGaagggatgctgctatctacagGTTTTGGCCACTGACTGACctgtagatcagcatccctt2RCCTGaagggatgctgatctacagGTCAGTCAGTGGCCAAAACctgtagatagcagcatcccttC3FTGCTGatctcggtcagacacacataaGTTTTGGCCACTGACTGACttatgtgtctgaccgagat3RCCTGatctcggtcagacacataaGTCAGTCAGTGGCCAAAACttatgtgtgtctgaccgagatC4FTGCTGtaacagggatcagtcgtttctGTTTTGGCCACTGACTGACagaaacgagatccctgtta4RCCTGtaacagggatctcgtttctGTCAGTCAGTGGCCAAAACagaaacgactgatccctgttaCN-FTGCTGaaatgtactgcgcgtggagacGTTTTGGCCACTGACTGACgtctccacgcagtacatttN-RCCTGaaatgtactgcgtggagacGTCAGTCAGTGGCCAAAACgtctccacgcgcagtacatttC
斜体部分为引入酶切位点,小写字母部分为干扰序列及其互补序列,下划线部分为loop序列
The italic is the introduced enzyme loci,the lowercase is the interference sequence and complementary sequence,and underline represents the loop sequence
表2MyD88编码区克隆PCR引物
Table 2 The PCR primers for coding area ofMyD88 gene

引物名称Nameoftheprimer引物核苷酸序列(5'-3')Nucleotidesequenceoftheprimer(5'-3')MyD88-FCCATGGCTGCAGGAGGCMyD88-RGCAGTTCAGGGCAGGGATAG
表3 检测MyD88转录水平的实时荧光定量PCR引物
Table 3 The Real-time PCR primers for transcription ofMyD88 gene
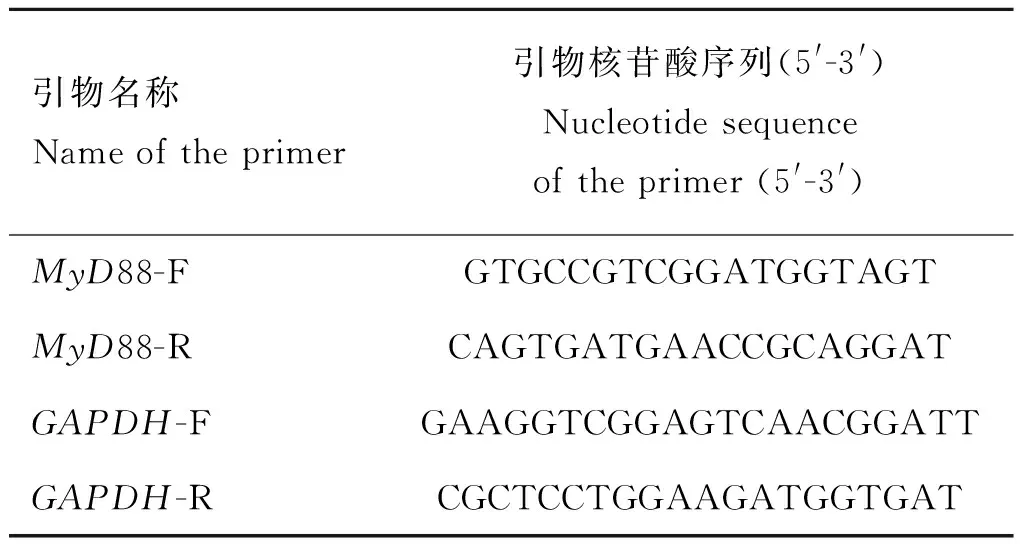
引物名称Nameoftheprimer引物核苷酸序列(5'-3')Nucleotidesequenceoftheprimer(5'-3')MyD88-FGTGCCGTCGGATGGTAGTMyD88-RCAGTGATGAACCGCAGGATGAPDH-FGAAGGTCGGAGTCAACGGATTGAPDH-RCGCTCCTGGAAGATGGTGAT
1.4 表达载体构建
MyD88基因克隆入pMD-18T载体,测序验证序列正确后用BamHⅠ/EcoRⅠ各1 μL,5 μL 10×buffer,5 μL TA克隆质粒,38 μL双蒸水,37 ℃酶切2 h。pcDNA3.1(+)质粒进行相同酶切处理,琼脂糖凝胶电泳并回收酶切的目的片段。用T4 DNA 连接酶连接回收的片段与载体,0.5 μL T4 DNA连接酶,2 μL回收片段,1 μL线性载体,1 μL连接缓冲液 (10×),5.5 μL双蒸水,室温连接2 h。连接产物转化感受态细胞DH5α,从含氨苄青霉素培养板上挑取多个单克隆提取质粒,并进行测序验证。经测序验证连接序列及方向正确后,摇菌并抽提高纯度质粒备用。
1.5 细胞转染及干扰效率验证
将干扰载体和高表达载体共转染HEK293细胞进行干扰效果评价,挑选干扰效果最好的载体。六孔板中DMEM (10%胎牛血清)培养HEK293细胞覆盖率至80%左右时,进行转染;用无血清Opti-MEM轻洗细胞2次,加入1.5 mL Opti-MEM;分别用250 μL Opti-MEM稀释4个干扰质粒以及阴性对照质粒各3 μg,轻轻混匀后各加入1 μg高表达质粒载体;用250 μL Opti-MEM稀释10 μL 脂质体2000试剂,轻轻混匀,室温孵育5 min;将两种稀释液轻轻混合,室温放置20 min;将每管500 μL脂质体-质粒复合物慢慢加入到各细胞孔中,轻轻混匀;每个处理重复3孔。37 ℃,5%的CO2培养箱中培养6 h后,换不含抗生素完全培养液继续培养过夜观察荧光表达情况。
细胞瞬时转染48 h后,提取总RNA。按照TaKaRa试剂盒说明进行实时荧光定量PCR,检测细胞中目的基因的干扰情况,干扰效率为1-2-ΔΔCt。
1.6 慢病毒载体包装及滴度测定
利用Gateway重组技术将挑选干扰效果最好的载体重组克隆到慢病毒载体;并利用293T细胞进行慢病毒的包装;将病毒原液浓缩,并测定病毒滴度。
EagⅠ线性化处理干扰质粒,纯化收集酶切产物。通过BP重组系统将干扰序列重组到pDONR 221载体,继而通过LR重组系统将干扰序列重组到pLenti6.3/V5-DEST载体中。转化挑取克隆,测序正确重组质粒克隆命名为pLenti-MyD88-shRNA,进行大量箘液培养并抽提质粒。
9 μg Packaging Mix (pLP1,pLP2,pLP/VSVG) 和3 μg pLenti-MyD88-shRNA质粒加入1.5 mL Opti-MEM,取36 μL 脂质体2000 加入1.5 mL Opti-MEM,室温静置5 min,轻轻将两者混合,室温放置20 min。293T细胞的10 cm培养皿换5 mL Opti-MEM,将3 mL混合液加入培养皿中。37 ℃,5% CO2的培养箱中培养,6 h后换DMEM (10%胎牛血清) 完全培养液。48 h后收集细胞培养上清,3 000 r·min-1离心10 min,去除细胞和碎片,并用0.45 μm的滤器过滤;将病毒原液在50 000 g下超速离心2 h,去除上清,重悬于opti-MEM培养液中。
用含8 μg·mL-1Polybrene、2% FBS的DMEM培养液,按10倍梯度稀释病毒液,每梯度各取100 μL加入培养有293T细胞的96孔板,每梯度3个重复孔。24 h后,在荧光显微镜下观察各孔中荧光细胞数量,病毒滴度为各孔中表达荧光的细胞数平均数除以每孔中含有的慢病毒液体积。
1.7 病毒液感染猪小肠上皮细胞
取滴度为1×108TU·mL-1的pLenti-MyD88-shRNA及阴性对照病毒液10 μL,分别加入指数生长期IPEC-J2细胞12孔板中,24 h后观察荧光情况,并于36 h收集总RNA;检测MyD88相对转录情况,并计算干扰效率。
2 结 果
2.1 载体构建
通过对所挑取阳性克隆进行测序验证,最终获得连接正确的4个干扰和1个阴性质粒载体,分别命名为pcDNA6.2-GW/EmGFP-shRNA-1、pcDNA6.2-GW/EmGFP-shRNA-2、pcDNA6.2-GW/EmGFP-shRNA-3、pcDNA6.2-GW/EmGFP-shRNA-4,pcDNA6.2-GW/EmGFP-shRNA-NC,测序图谱见图1;以及1个MyD88高表达载体,命名为pcDNA3.1-MyD88。
2.2 干扰效率验证
通过干扰载体与高表达载体共转染293细胞,实时荧光定量检测MyD88基因转录水平,由图2可知,1号干扰载体处理的293细胞中猪MyD88基因相对转录水平为0.36,干扰效率为0.64,即pcDNA6.2-GW/EmGFP-shRNA-1干扰效率最高,用于慢病毒包装。
2.3 慢病毒液滴度测定
包装载体和慢病毒载体pLenti-MyD88-shRNA共转染293细胞,24 h后荧光显微镜下观察到绿色荧光,见图3P,说明包装成功,可用于病毒液收集及浓缩处理。
病毒液梯度稀释后用于病毒滴度检测,pLenti-MyD88-shRNA病毒颗粒感染细胞24 h后各孔的荧光情况见图3,图中A~E的处理分别加入浓缩病毒液量为2×10-3、2×10-4、2×10-5、2×10-6、2×10-7·mL-1。每个处理孔均可观察到发绿色荧光的细胞,说明所包装慢病毒颗粒能够实现对细胞的感染;且每孔发出绿色荧光细胞的数量随病毒液梯度浓度变化呈现倍数差异,由此能够判断滴度检测的准确性,并通过E处理孔中观察到的少量表达绿色荧光细胞进行病毒滴度(TU·mL-1)的计算,病毒滴度的计算公式为:平均每孔荧光细胞个数/病毒液体积。(30+32+37)/3/(2×10-7) =1.65×108TU·mL-1,该滴度水平达到了细胞感染的要求。用Opti-MEM培养液将慢病毒液稀释至1×108TU·mL-1,并分装保存于-80 ℃。
2.4 干扰病毒颗粒对猪小肠上皮细胞MyD88表达的干扰效率
pLenti-MyD88-shRNA慢病毒颗粒液感染IPEC-J2细胞24 h后观察荧光效果,由图4可见荧光表达率较高,能够用于MyD88基因表达水平检测和干扰效率的分析。由图5可知,pLenti-MyD88-shRNA病毒颗粒对IPEC-J2的MyD88基因的干扰效率为69.3%。与干扰效率筛选结果相近,可用于MyD88基因在肠上皮细胞中免疫相关功能分析。
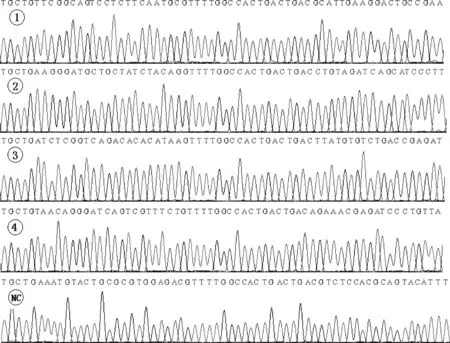
1~4.pcDNA6.2-GW/EmGFP-shRNA-1、pcDNA6.2-GW/EmGFP-shRNA-2、pcDNA6.2-GW/EmGFP-shRNA-3、pcDNA6.2-GW/EmGFP-shRNA-4;NC.pcDNA6.2-GW/EmGFP-shRNA-NC。下图同1-4.pcDNA6.2-GW/EmGFP-shRNA-1,pcDNA6.2-GW/EmGFP-shRNA-2,pcDNA6.2-GW/EmGFP-shRNA-3,pcDNA6.2-GW/EmGFP-shRNA-4;NC.pcDNA6.2-GW/EmGFP-shRNA-NC.The same as below图1 干扰载体测序结果Fig.1 The sequencing results of interference vectors
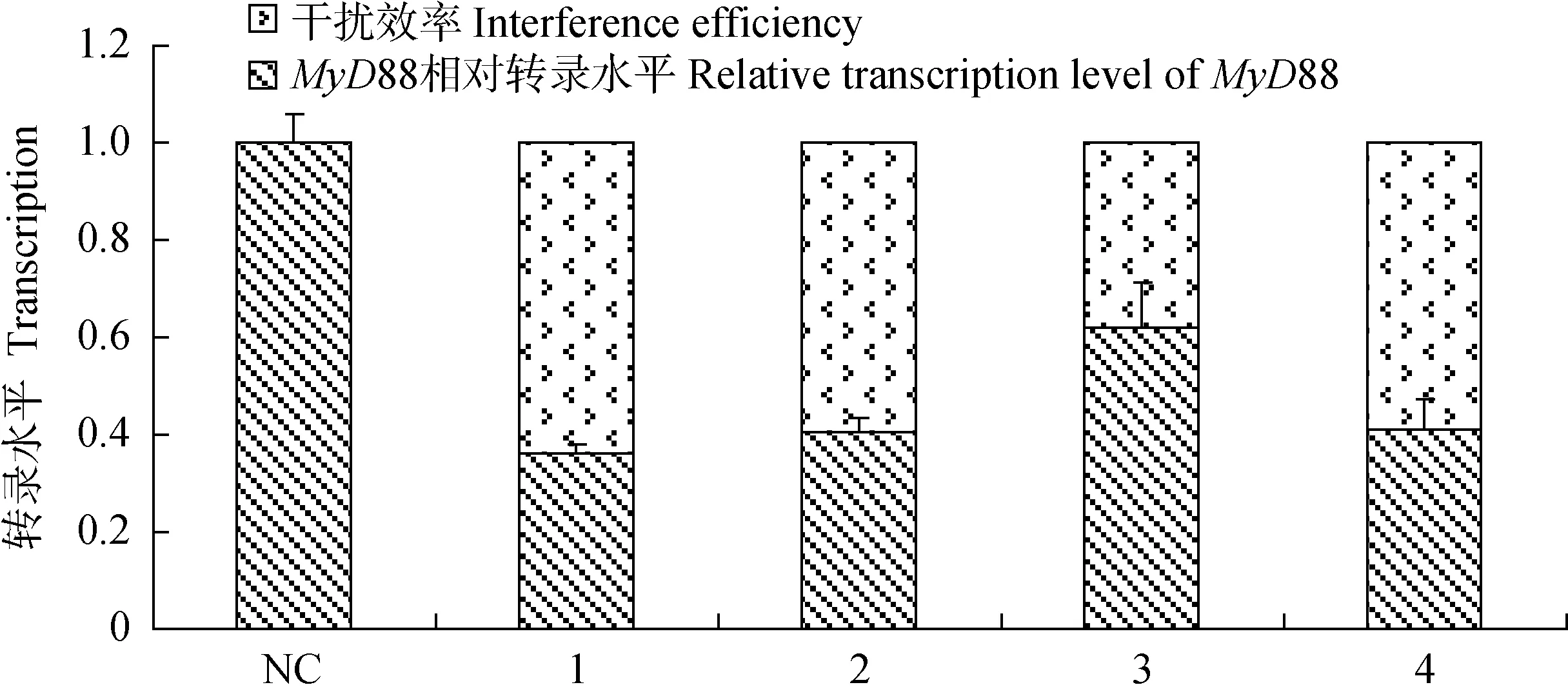
NC和1~4依次为阴性和4个干扰质粒载体与高表达载体共转染293细胞处理NC and 1-4,in turn,represent the 293 cells cotransfected by four interference vectors and the negative plasmid vector respectively together with MyD88 over-expression vector图2 实时荧光定量检测MyD88基因mRNA转录水平及干扰效率分析Fig.2 The mRNA level of MyD88 gene and the interference efficiency detected by Real-time PCR
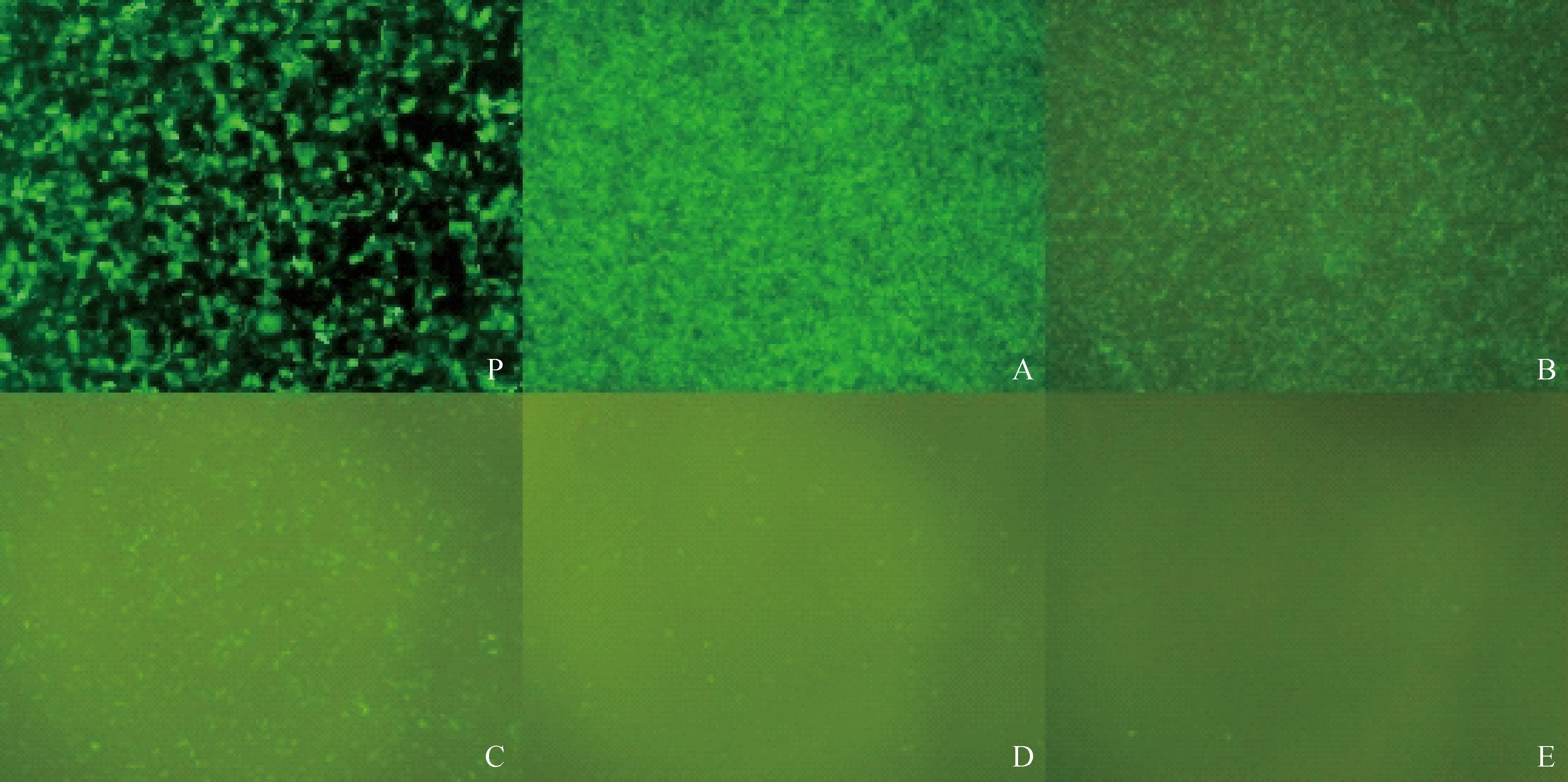
P.病毒包装共转染24 h后荧光显微镜拍照(100×); A~E.加入浓缩病毒液量分别为2×10-3、2×10-4、2×10-5、2×10-6、2×10-7 ·mL-1 (40×)P.The photo of lentivirus package by the fluorescence microscope 24 hours after cotransfection (100×);A-E.Disposed respectively with 2×10-3,2×10-4,2×10-5,2×10-6,2×10-7 ·mL-1 concentrated virus (40×)图3 病毒包装及病毒滴度检测(24 h)Fig.3 The lentivirus package and virus titer testing
图4 pLenti-MyD88-shRNA病毒颗粒侵染IPEC-J2细胞24 h荧光效果(400×)Fig.4 The fluorescent image of IPEC-J2 cell infected by pLenti-MyD88-shRNA virus after 24 hours (400×)
图5 pLenti-MyD88-shRNA病毒颗粒对IPEC-J2细胞MyD88基因干扰效果Fig.5 The interference efficiency of pLenti-MyD88-shRNA virus inhibiting MyD88 gene in IPEC-J2 cell
3 讨 论
MyD88是作为TLRs/IL-1R信号通路中一个关键接头分子,激发NF-κB构成炎症反应通路,在传递炎症信号和增强炎症强度,引发肠道炎症介质的释放中具有重要的作用[9]。M.Loiarro 等通过合成MyD88基因TIR结构域的多肽模拟物,成功干扰MyD88的二聚体化作用[10]。肠道致病性大肠杆菌主要通过释放内毒素(LPS)引起肠道疾病的发生,TLR4是识别LPS的主要受体[11]。TLR4信号通路主要通过MyD88依赖和MyD88非依赖途径传导,对于MyD88基因的功能分析有助于解释致病性大肠杆菌引起断奶仔猪腹泻和水肿病的分子机制。
研究表明,MyD88基因缺陷小鼠表现出对LPS刺激的抗性,而野生型个体在注射LPS后大部分死亡[12]。果蝇中MyD88的过表达能诱导抗菌肽的产生,而在MyD88基因突变体中则相反[13]。有研究表明MyD88在LPS诱导的STAT3磷酸化和SOCS3 表达过程中起到显著的调控作用,且发现MyD88缺陷小鼠可以抵抗LPS所引起的食欲不振[14]。另外,神经方面研究表明MyD88缺陷会造成小鼠认知和行为障碍[15]。
随着分子生物技术的发展,各种基因修饰技术应用于基因功能分析。其中,慢病毒载体法已成熟用于转基因细胞、胚胎和动物个体的制备[16]。对于MyD88基因功能的研究方法主要依靠基因敲除技术获得基因缺失型突变个体,分析其在信号通路中作用。基因敲除后,依赖于MyD88的信号通路被中断,免疫信号传递过程发生改变,虽然能突出目的基因的重要功能,但是不能分析MyD88表达水平差异所引起的免疫反应变化。而RNAi技术(RNA interference)能在一定水平上沉默靶基因的表达,为基因不同表达水平功能分析提供可能,杨浩等通过构建GRN基因短发夹 RNA慢病毒干扰载体感染猪前体脂肪细胞,结果发现GRN基因表达的降低能够促进猪前体脂肪细胞分化[17];同样,程佳等利用慢病毒介导shRNA干扰猪RBP4基因,发现RBP4基因也起着抑制猪前体脂肪细胞成脂分化的作用[18]。此外,RNAi技术还被用于抗病毒以及人类疾病的治疗研究等[19-20]。周谦君等针对猪MyD88基因设计并人工合成双链siRNA分子,成功干扰猪外周血树突状细胞MyD88基因的表达[21],而人工合成siRNA作用的局限在于不能实现靶基因的长期稳定沉默,慢病毒载体介导的基因整合则能实现外源shRNA高效稳定表达,从而起到稳定沉默靶基因的效果。本研究通过靶向MyD88基因设计并成功构建了4个干扰的shRNA表达载体,通过共转染干扰效率筛选试验,发现4个干扰载体均能对MyD88基因起到显著的干扰作用,但针对不同靶点的序列表现出不同的沉默效率,其中1号干扰载体沉默效率最高。同时,成功将其包装成慢病毒,获得了较高滴度的慢病毒液。通过侵染IPEC-J2细胞系,沉默效率接近70%,能成功应用于稳定沉默MyD88基因小肠上皮细胞系的建立和靶基因功能影响的测定。
鉴于MyD88在TLRs/IL-1R信号通路发挥的重要作用,本研究成功构建包装了慢病毒介导的MyD88基因干扰载体,得到良好的侵染和干扰效果,并成功获得MyD88基因稳定沉默的猪肠上皮细胞,为MyD88及TLRs/IL-1R信号通路在猪肠道病原微生物感染所引起的天然免疫分子作用机制研究奠定了基础。
[1] MUZIO M,POLENTARUTTI N,BOSISIO D,et al.Toll-like receptor family and signalling pathway[J].BiochemSocTrans,2000,28(5):563-566.
[2] GHOSH S,KARIN M.Missing pieces in the NF-kappaB puzzle[J].Cell,2002,109(Suppl):S81-S96.
[3] JANSSENS S,BEYAERT R.Functional diversity and regulation of different interleukin-1 receptor-associated kinase (IRAK) family members[J].MolCell,2003,11(2):293-302.
[4] O′NEILL L A.Signal transduction pathways activated by the IL-1 receptor/toll-like receptor superfamily[J].CurrTopMicrobiolImmunol,2002,270:47-61.
[5] SUZUKI N,SUZUKI S,YEH W C.IRAK-4 as the central TIR signaling mediator in innate immunity[J].TrendsImmunol,2002,23(10):503-506.
[6] SUZUKI N,SUZUKI S,DUNCAN G S,et al.Severe impairment of interleukin-1 and Toll-like receptor signalling in mice lacking IRAK-4[J].Nature,2002,416(6882):750-756.
[7] LI X,LIU H,YANG S,et al.Characterization analysis and polymorphism detection of the porcine MyD88 gene[J].GenetMolBiol,2009,32(2):295-300.
[8] TOHNO M,SHIMAZU T,ASO H,et al.Molecular cloning and functional characterization of porcine MyD88 essential for TLR signaling[J].CellMolImmunol,2007,4(5):369-376.
[9] MOSES T,WAGNER L,FLEMING S D.TLR4-mediated Cox-2 expression increases intestinal ischemia/reperfusion-induced damage[J].JLeukocBiol,2009,86(4):971-980.
[10] LOIARRO M,CAPOLUNGHI F,FANTN,et al.Pivotal advance:Inhibition of MyD88 dimerization and recruitment of IRAK1 and IRAK4 by a novel peptidomimetic compound[J].JLeukocBiol,2007,82(4):801-810.
[11] POLTORAK A,HE X,SMIRNOVA I,et al.Defective LPS signaling in C3H/HeJ and C57BL/10ScCr mice:mutations in Tlr4 gene[J].Science,1998,282(5396):2085-2088.
[12] KAWAI T,ADACHI O,OGAWA T,et al.Unresponsiveness of MyD88-deficient mice to endotoxin[J].Immunity,1999,11(1):115-122.
[13] TAUSZIG-DELAMASURE S,BILAK H,CAPOVILLA M,et al.Drosophila MyD88 is required for the response to fungal and Gram-positive bacterial infections[J].NatImmunol,2002,3(1):91-97.
[14] YAMAWAKI Y,KIMURA H,HOSOI T,et al.MyD88 plays a key role in LPS-induced Stat3 activation in the hypothalamus[J].AmJPhysiolRegulIntegrCompPhysiol,2010,298(2):R403-410.
[15] DROUIN-OUELLET J,LEBEL M,FILALI M,et al.MyD88 deficiency results in both cognitive and motor impairments in mice[J].BrainBehavImmun,2012,26(6):880-885.
[16] 罗庆苗,苗向阳,张瑞杰.转基因动物新技术研究进展[J].遗传,2011,33(5):449-458. LUO Q M,MIAO X Y,ZHANG R J.An update on the development of transgenic animal technology[J].Hereditas(Beijing),2011,33(5):449-458.(in Chinese)
[17] 杨 浩,李新建,程 佳,等.慢病毒介导shRNA干扰颗粒体蛋白前体(GRN)促进猪前体脂肪细胞分化[J].农业生物技术学报,2012,20(6):599-605. YANG H,LI X J,CHENG J,et al.Lentivirus mediated granulin shRNA interference silencing promotes pig preadipocyte differentiation[J].JournalofAgriculturalBiotechnology,2012,20(6):599-605.(in Chinese)
[18] 程 佳,蒲 蕾,杨 浩,等.慢病毒介导shRNA干扰RBP4促进猪前体脂肪细胞成脂分化[J].畜牧兽医学报,2013,44(6):937-943. CHENG J,PU L,YANG H,et al.Lentivirus mediated shRNA interference silencing RBP4 promoted differentiation of porcine preadipocytes[J].ActaVeterinariaetZootechnicaSinica,2013,44(6):937-943.(in Chinese)
[19] LAN Y,ZHAO K,HE W,et al.Inhibition of porcine hemagglutinating encephalomyelitis virus replication by short hairpin RNAs targeting of the nucleocapsid gene in a porcine kidney cell line[J].JVirolMethods,2012,179(2):414-418.
[20] BAVYKIN A S,MISHIN D V,KARPUKHIN A V,et al.The ability of small interfering RNA oligonucleotides to decrease the infective activity of hepatitis C virus in the cell cultures[J].VoprVirusol,2012,57(2):32-34.
[21] 周谦君,范慧敏,刘中民.MyD88siRNA诱导猪调节性树突状细胞的实验研究[J].中国细胞生物学学报,2010,32(3):415-421. ZHOU Q J,FAN H M,LIU Z M.MyD88 knockdown by liposome-mediated RNA interference to porcine monocyte-derived dendritic cell[J].ChineseJournalofCellBiology,2010,32(3):415-421.(in Chinese)
(编辑 白永平)
Construction and Packaging of Recombinant Lentivirus Interference Vector Specific to PorcineMyD88 Gene and the Evaluation of the Corresponding Lentivirus
ZI Chen1,XIA Ri-wei1,YIN Xue-mei1,YU Li-huai1,ZHU Guo-qiang2,WU Sheng-long1*,BAO Wen-bin1*
(1.AnimalScienceandTechnologyCollege,YangzhouUniversity,KeyLaboratoryforAnimalGenetics,Breeding,ReproductionandMolecularDesignofJiangsuProvince,Yangzhou225009,China;2.CollegeofVeterinaryMedicine,YangzhouUniversity,Yangzhou225009,China)
Myeloid differentiation factor 88 (MyD88),an important adaptor protein in TLRs/IL-1R signaling pathways,plays an important role in immune response and disease prevention.This study intends to obtain pig small intestinal epithelial cells in whichMyD88 gene is silent mediated by lentiviru,as an effective model for analyzing molecular mechanism of intestinal disease caused by pathogenic bacteria.In this study,four plasmid expression vectors were constructed,which coded shRNAs against pigMyD88 gene,and the over-expression vector codingMyD88 gene was also constructed.By the method of real-time fluorescent quantitative PCR,the level ofMyD88 gene in the cotransfected 293 cells was detected.The highest efficiency vector was adopted and packaged into lentiviral vector to obtain pig small intestinal epithelial cells with silentMyD88 gene.The IPEC-J2 cell was obtained in which theMyD88 mRNA expression was reduced by 69.3%,meeting the requirement for gene function analysis.The obtained pig intestinal epithelial cell with stableMyD88 gene silencing provides important material for mechanism research of TLRs/IL-1R signal pathway caused by pathogenic microorganisms in pig intestines.
pig;MyD88 gene;gene silencing;lentiviral vector
10.11843/j.issn.0366-6964.2015.04.021
2014-07-28
国家自然科学基金(31172183;31140027);转基因生物新品种培育科技重大专项(2014ZX0800601B);江苏省科技支撑计划(BE2012330;BE2013345;BE2014357);江苏高校优势学科建设工程资助项目(PAPD)
訾 臣(1987-),男,山东临沂人,博士生,主要从事猪抗病育种研究,E-mail:zchandy@163.com
*通信作者:包文斌(1974-),男,博士,研究员,主要从事猪遗传育种研究,E-mail:wbbao@yzu.edu.cn;吴圣龙(1963-),男,博士,研究员,主要从事猪遗传育种研究,E-mail:slwu@yzu.edu.cn
S852.2
A
0366-6964(2015)04-0657-08
