胰高血糖素样肽-2对脂多糖应激的IPEC-J2细胞形态和紧密连接相关基因表达的影响
2015-03-22余长松邓秋红陈小玲刘光芒王康宁
余长松,贾 刚,邓秋红,陈小玲,赵 华,刘光芒,王康宁
(四川农业大学动物营养研究所,农业部动物抗病营养与饲料重点实验室,雅安 625014)
胰高血糖素样肽-2对脂多糖应激的IPEC-J2细胞形态和紧密连接相关基因表达的影响
余长松,贾 刚*,邓秋红,陈小玲,赵 华,刘光芒,王康宁
(四川农业大学动物营养研究所,农业部动物抗病营养与饲料重点实验室,雅安 625014)
本研究旨在考察胰高血糖素样肽-2(Glucagons-like peptide-2,GLP-2)和脂多糖(Lipopolysaccharide,LPS)对仔猪空肠上皮细胞及其紧密连接(Tight Junctions,TJ)相关蛋白基因表达的影响,并探讨GLP-2调控仔猪肠道TJ蛋白基因表达可能的作用机理。试验一设对照、GLP-2、LPS、LPS+GLP-2 共4个组,考查各处理对IPEC-J2细胞形态和紧密连接关键蛋白Occludin、Claudin-1和ZO-1基因表达的影响。结果:添加100 nmol·L-1GLP-2能显著改善IPEC-J2细胞形态,显著提高Occludin、Claudin-1和ZO-1 mRNA表达(P<0.01);100 μg·mL-1LPS处理能显著破坏细胞形态、降低IPEC-J2细胞紧密连接蛋白mRNA的表达(P<0.01);在添加LPS基础上添加100 nmol·L-1GLP-2能有效维护细胞形态,显著增加IPEC-J2细胞TJ相关蛋白Occludin、Claudin-1和ZO-1 mRNA的表达(P<0.01),增加量分别为46.3%、65.1%和30.3%。试验二考察了添加PI3K特异性抑制剂Wortmannin(Wort)和LY294002(LY)阻断PI3K-Akt-mTOR信号转导途径后Occludin、Claudin-1和ZO-1 mRNA表达量的变化,试验共设对照、GLP-2、GLP-2+Wort、GLP-2+LY等4个组。结果:添加抑制剂Wort后可显著降低IPEC-J2细胞Akt、mTOR、Occludin、Claudin-1和ZO-1 mRNA的表达(P<0.01),降低量分别为46.9%、50.5%,38.1%、49.6%和18.9%;添加 LY后上述mRNA的表达量分别显著降低了67.2%、70.8%,49.6%、60.9%和25.8%(P<0.01)。以上结果表明:添加GLP-2能够有效抑制LPS应激对IPEC-J2细胞形态和TJ相关基因表达的损伤,PI3K-Akt-mTOR信号转导途径可能是GLP-2调控肠道紧密连接蛋白基因表达的重要信号通路之一。
胰高血糖素样肽-2;脂多糖;仔猪空肠上细胞IPEC-J2;紧密连接;PI3K-Akt-mTOR
仔猪断奶时受到的应激,特别是免疫应激,能对仔猪肠道紧密连接(TJ)以及屏障功能产生不利影响,进而严重地影响到仔猪健康以及生产性能[1-3]。断奶应激导致仔猪肠道屏障功能受损与肠道TJ表达水平下降以及蛋白结构重排有重要关系[4]。GLP-2属于胰高血糖素原衍生肽类,其氨基酸序列在哺乳动物中具有高度的保守性[5-6],能通过多条细胞信号转导途径最终促进正常小肠的生长和病理性肠黏膜的恢复[7]。GLP-2不仅能够有效促进肠道细胞的增殖、分化,抑制细胞的凋亡[8-9],还能降低肠道上皮细胞的通透性,提高肠道的屏障功能[10-11]。 PI3K-Akt-mTOR信号转导途径是参与调控肠道TJ表达和屏障功能的一条重要途径,同时也是GLP-2调控细胞增殖和凋亡的重要细胞信号转导途径[12-13]。然而,也有研究表明GLP-2在调控部分细胞的增殖和生长中并没有通过PI3K-Akt-mTOR信号转导途径[14]。因此,在仔猪肠上皮细胞中,GLP-2能否通过PI3K-Akt-mTOR信号转导途径,上调下游TJ蛋白基因的表达尚不清楚,有待深入研究。IPEC-J2细胞作为未分化的细胞系,建立于仔猪空肠上皮,能准确代表正常生理情况下的断奶仔猪肠上皮细胞,而脂多糖(LPS)是仔猪断奶过程中造成免疫应激的一种重要诱发因子,是引起细胞免疫损伤的常用诱发剂[15]。
本试验将以仔猪空肠上皮细胞IPEC-J2为模型,探究GLP-2对LPS应激的IPEC-J2细胞形态和TJ基因表达的保护效应,探讨GLP-2是否通过PI3K-Akt-mTOR信号转导途径调控TJ基因的表达,研究结果可帮助人们认识肠道损伤、肠道屏障功能变化的分子机制,也为今后应用GLP-2改善肠道屏障功能提供依据。
1 材料与方法
1.1 试验材料、主要试剂及仪器
IPEC-J2细胞系,建立于出生后24 h内的仔猪空肠上皮细胞。由丹麦哥本哈根大学生命科学院人类营养系Per Sangild教授惠赠。
GLP-2(纯度≥95%,Phoenix pharmaceuticals,美国);LPS (Sigma,L2880);Wortmannin (Beyotime,S1952);LY294002(Beyotime,S1737);胰岛素(Sigma,I5500);EGF(Peprotech,100-15);ITS-G(Gibco,41400-045);Trizol(TaKaRa);PrimeScriptTMRT Reagent Kit with gDNA Eraser反转录试剂盒(TaKaRa,RR047A);实时荧光定量PCR试剂盒(TaKaRa,RR820A)。其他常用试剂为国产分析纯或者进口分装试剂。
Ⅱ型注水式CO2细胞培养箱(Thermo)、1300-SERIES-A2生物安全柜(Thermo)、A200型倒置相差多功能生物显微镜及全自动显微摄影装置(Zeiss)、RT-PCR仪(Effendorf)、CFX-96荧光定量PCR仪(Bio-Rad)、DU520分光光度计(Beckman)、UV-1100/1200紫外可见分光光度计(上海美谱达)等。
1.2 试验内容
1.2.1 试验设计 试验一采用单因子设计,共设4个处理,每个处理4个重复,每个重复1孔,详见表1。试验二采用单因子设计,共设4个处理,每个处理4个重复,每个重复1孔,详见表2。
表1 试验1设计方案
Table 1 The design of trial 1

处理Treatment对照组ControlLPS处理组LPSGLP-2处理组GLP-2LPS+GLP-2处理组LPS+GLP-2LPS/(μg·mL-1)01000100GLP-2/(nmol·L-1)00100100
表2 试验2设计方案
Table 2 The design of trial 2
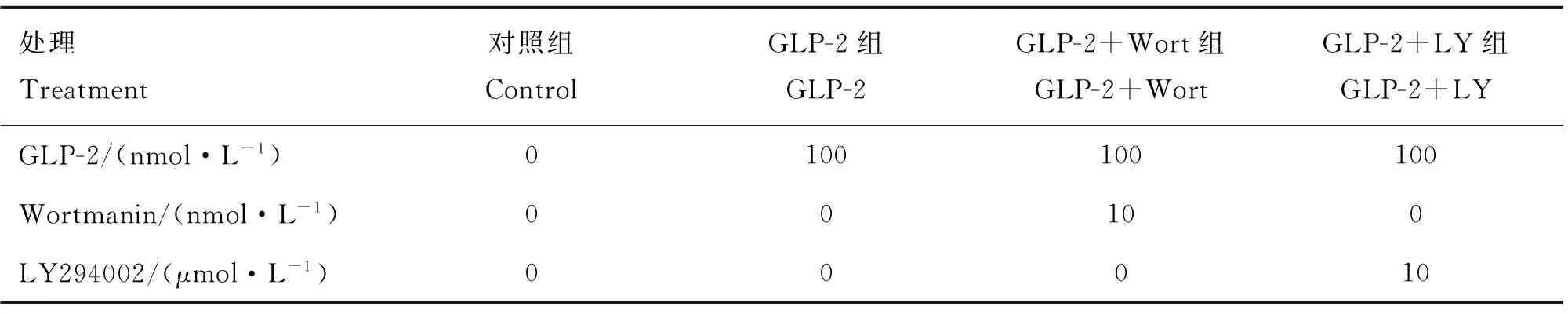
处理Treatment对照组ControlGLP-2组GLP-2GLP-2+Wort组GLP-2+WortGLP-2+LY组GLP-2+LYGLP-2/(nmol·L-1)0100100100Wortmanin/(nmol·L-1)00100LY294002/(μmol·L-1)00010
1.2.2 细胞常规培养 IPEC-J2细胞进行常规细胞培养、传代。细胞培养于T 75 cm2的细胞培养瓶中,完全培养基培养(89% DMEM/F12培养液,5%胎牛血清,5% ITS-G,1%青链霉素混合液,10 ng·mL-1EGF),隔天换液,80%融合时用0.25%的胰酶-EDTA消化液传代。培养瓶二氧化碳培养箱培养,培养条件为37 ℃,5% CO2,95%湿度,定期观察细胞贴壁、增殖等生长情况。取处于对数生长期的生长状态良好的细胞进行试验,试验中均采用无血清培养基培养。
1.2.3 细胞处理 取对数生长期细胞,胰蛋白酶常规消化计数接种至6孔板上(1×105个·孔-1),完全汇合后弃掉原培养液,37 ℃预热PBS洗涤3次,含抑制剂处理组加入37 ℃预热的只含有相应浓度抑制剂的DMEM/F12培养液,同时其余处理组加入DMEM/F12培养液培养1 h,而后根据试验设计替换为37 ℃预热试验用培养液,于37 ℃,5% CO2,95%湿度的二氧化碳培养箱中培养1 h(激酶基因表达)或24 h(紧密连接基因表达)。
1.2.4 样品收集 将6孔细胞培养板从培养箱中取出后弃去培养液,用预热的PBS轻轻洗涤两次,加入Trizol(1 mL·孔-1)裂解液,仔细吹打后收集于1.5 mL无菌EP管中保存于-80 ℃用于基因相对表达量的测定。
1.2.5 考察指标及方法
1.2.5.1 各处理组IPEC-J2细胞形态观察:使用A200型倒置相差多功能生物显微镜及全自动显微摄影装置,AxioVision Rel.4.6程序观察各处理组细胞形态变化。
1.2.5.2 细胞Akt、mTOR、Occludin、Claudin-1和ZO-1基因的相对表达量:Akt、mTOR作为PI3K-Akt-mTOR信号转导途径的重要信号激酶,其基因表达量的变化表明该途径的活化状态,采用实时荧光定量PCR法测定Akt、mTOR、Occludin、Claudin-1和ZO-1的相对表达量。(1)总RNA的提取和cDNA的合成:细胞总RNA提取按照Trizol试剂说明书进行,提取的总RNA最后溶解于DEPC处理水,使用核酸蛋白质检测仪测定总RNA OD260 nm/OD280 nm的值为1.8~2.0,说明提取的RNA纯度较高并经1%琼脂糖凝胶电泳鉴定其完整性后采用PrimeScriptTMRT Reagent Kit with gDNA Eraser将提取的RNA反转录为cDNA。反应体系为5×gDNA Eraser Buffer 2.0 μL,gDNA Eraser 1.0 μL,Total RNA 2.0 μL,RNase Free dH2O 5.0 μL。反应条件:42 ℃ 2 min(去除基因组DNA反应)。上样反应液 10.0 μL,PrimeScript RT Enzyme Mix Ⅰ 1.0 μL,5×PrimeScript Buffer 2 (for real-time) 4.0 μL,RNase Free dH2O→反应条件:37 ℃ 15 min(反转录反应) →85 ℃ 5 s (反转录酶的失活反应),4 ℃保存。(2)实时荧光定量PCR(qRT-PCR):使用CFX-96 real-time PCR系统,按照SYBR®PremixExTaqTMII(Tli RNaseH Plus)步骤采用两步法进行。参照NCBI提供的目的基因序列,采用Primer5.0软件进行引物设计,引物合成委托上海生工生物工程公司。各基因引物序列及退火温度见表3。PCR反应体系(25 μL)为:SYBR®Premix Ex Taq Ⅱ(Tli RNaseH Plus) (2×) 12.5 μL,PCR Forward Primer(10 μmol·L-1) 1.0 μL,PCR Reverse Primer(10 μmol·L-1) 1.0 μL,DNA模板(<100 ng) 2.0 μL,dH2O 8.5 μL。采用两步法并参考试剂盒说明步骤,根据Ct值最小以及荧光信号强度最大确定反应条件。PCR循环反应参数:95 ℃ 30 s;95 ℃ 5 s,各基因退火温度30 s,循环40次;95 ℃ 10 s,随后进行熔解曲线分析,温度以0.5 ℃/5 s的速率从65 ℃递增到95 ℃。采用双△Ct +标准曲线扩增效率校正法,采用l0倍梯度稀释法制作标准曲线,每个样品4个重复,内参基因为GAPDH。计算公式为相对表达量=2-△△Ct,△△Ct=(Ct目的基因-Ct管家基因)试验组-(Ct目的基因-Ct管家基因)对照组。
表3 基因扩增引物序列及退火温度
Table 3 Gene primers sequence and annealing temperature

基因GeneGenBank登录号AccessionNo.引物序列(5'→3')Primersequence退火温度/℃Tm产物大小/bpSizeGAPDHNM_001206359.1Forward:GATGGTGAAGGTCGGAGTGAACReversed:TGGGTGGAATCATACTGGAACA60.9153OccludinNM_001163647.2Forward:ACGAGCAGCAAAGGGATTCTTCReversed:TCACACCCAGGATAGCACTCATT61.2152Claudin-1NM_001244539.1Forward:TGCCTCAGTGGAAGATTTACTCCReversed:TGGTGTTCAGATTCAGCAAGGA60.1147ZO-1XM_005659811.1Forward:AGTTTGATAGTGGCGTTGACACReversed:GCTGAAGGACTCACAGGAACA60.0106AktNM_001159776.1Forward:GCACAAACGAGGCGAGTAReversed:CAGCGGATGATGAAGGTGTT61.4195mTORXM_003127584.4Forward:GGATGCTGGTGTCCTTTGTGAReversed:TGCTCTGGATGGAGGTGTTCAT60.09102
1.3 数据处理与统计分析
所有指标均以孔为统计单位。采用Excel对测得的数据进行初步整理之后,用SPSS 13.0 统计软件对数据进行方差分析,以GAPDH为内参,结果以相对表达量“平均值±标准差”的形式表示,P<0.05为显著水平,P<0.01为极显著水平。
2 结 果
2.1 GLP-2与LPS对IPEC-J2细胞形态的影响
各处理组IPEC-J2细胞形态结果如图1所示,与对照组相比,添加100 nmol·L-1GLP-2后细胞边界亮度增强,细胞大小形态更为匀称,细胞密度增大,表明细胞与细胞之间的连接更为紧密;添加100 μg·mL-1LPS后部分细胞出现细胞膜模糊化,细胞间丧失连接失去原有形态,处理24 h后细胞萎缩脱落死亡,细胞形态与整体性受到严重破坏;在100 μg·mL-1LPS处理的基础上添加100 nmol·L-1GLP-2后细胞形态能够得到有效的恢复,与100 μg·mL-1LPS组相比,细胞形态显著改善,表明GLP-2能够有效地抑制LPS对IPEC-J2细胞形态造成的破坏,维护细胞正常形态。
2.2 GLP-2与LPS对紧密连接蛋白mRNA相对表达量的影响
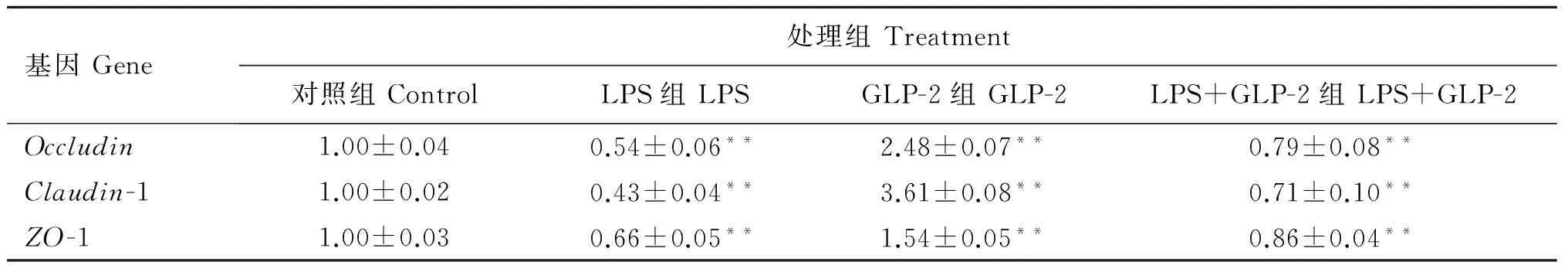
实时荧光定量检测的基因相对表达量结果如表4所示。与对照组相比100 nmol·L-1GLP-2处理可显著增加IPEC-J2细胞Occludin、Claudin-1和ZO-1 mRNA的表达(P<0.01),分别比对照组增加了148%、261%和54%; 100 μg·mL-1LPS处理显著降低了IPEC-J2细胞Occludin、Claudin-1和ZO-1 mRNA的表达(P<0.01),降低量分别为46%、57%和34%;在100 μg·mL-1LPS处理的基础上添加100 nmol·L-1GLP-2能显著地抑制由LPS造成的IPEC-J2细胞紧密连接相关蛋白mRNA表达量的下降(P<0.01),与LPS组相比,添加100 nmol·L-1GLP-2后Occludin、Claudin-1和ZO-1 mRNA的表达量分别增加了46.3%、65.1%和30.3%。

图1 GLP-2和LPS对IPEC-J2细胞形态的影响Fig.1 Effects of GLP-2 and LPS on the morphology of IPEC-J2 cells
表4 GLP-2和LPS对IPEC-J2细胞Occludin、Claudin-1和ZO-1 mRNA相对表达量的影响
Table 4 Effects of GLP-2 and LPS on the mRNA relative expression ofOccludin,Claudin-1 andZO-1 in IPEC-J2 cells
基因Gene处理组Treatment对照组ControlLPS组LPSGLP-2组GLP-2LPS+GLP-2组LPS+GLP-2Occludin1.00±0.040.54±0.06**2.48±0.07**0.79±0.08**Claudin-11.00±0.020.43±0.04**3.61±0.08**0.71±0.10**ZO-11.00±0.030.66±0.05**1.54±0.05**0.86±0.04**
**.P<0.01.The same as Table 5
2.3 GLP-2与抑制剂对Akt、mTOR和紧密连接蛋白mRNA相对表达量的影响
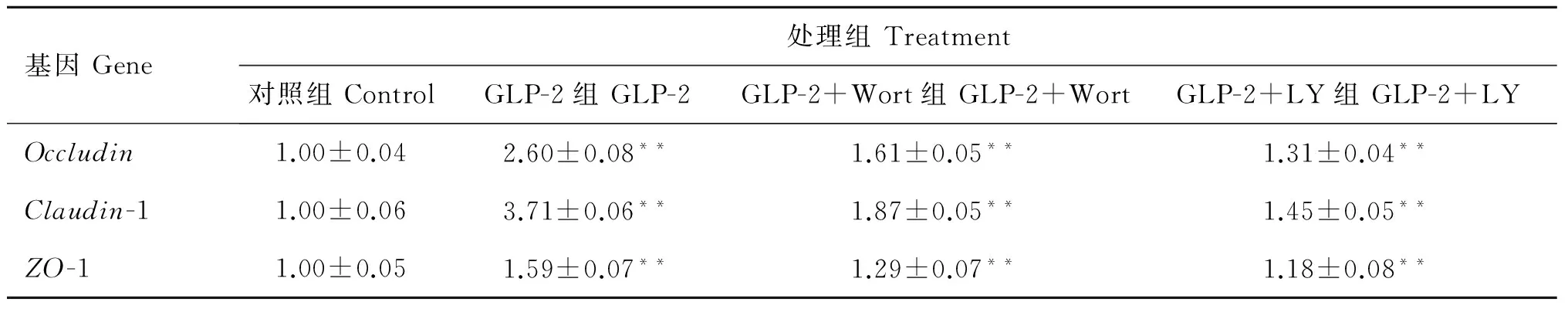
图2和表5反映了GLP-2和两种抑制剂对IPEC-J2细胞PI3K-Akt-mTOR途径重要信号激酶Akt、mTOR和紧密连接蛋白 mRNA相对表达量的影响。可以看出,100 nmol·L-1GLP-2处理显著增加了IPEC-J2细胞Akt、mTORmRNA的表达(P<0.01),增加量分别为378%、490%;而相对应的下游Occludin、Claudin-1和ZO-1 mRNA的表达也分别增加了160%、270%和59%,说明GLP-2可能激活了PI3K-Akt-mTOR信号转导途径。而添加两种抑制剂验证时结果表明,10 nmol·L-1Wort能够显著地抑制由100 nmol·L-1GLP-2处理造成的Akt以及下游mTORmRNA的增加,降低量分别为46.9%、50.5%;而Occludin、Claudin-1和
表5 阻断剂对GLP-2处理的IPEC-J2细胞Occludin、Claudin-1和ZO-1 mRNA相对表达量的影响
Table 5 Effects of signaling inhibitors on the relative mRNA expression ofOccludin,Claudin-1 andZO-1 in IPEC-J2 cells
基因Gene处理组Treatment对照组ControlGLP-2组GLP-2GLP-2+Wort组GLP-2+WortGLP-2+LY组GLP-2+LYOccludin1.00±0.042.60±0.08**1.61±0.05**1.31±0.04**Claudin-11.00±0.063.71±0.06**1.87±0.05**1.45±0.05**ZO-11.00±0.051.59±0.07**1.29±0.07**1.18±0.08**
ZO-1 mRNA的表达同样受到抑制,降低量分别为38.1%、49.6%和18.9%。与Wort类似,添加10 μmol·L-1LY同样能够显著降低100 nmol·L-1GLP-2处理造成的Akt以及下游mTORmRNA的增加,降低量分别为67.2%、70.8%,Occludin、Claudin-1和ZO-1 mRNA的表达也受到抑制,降低量分别为49.6%、60.9%和25.8%。

**P<0.01图2 阻断剂对GLP-2处理的IPEC-J2细胞Akt和mTOR mRNA相对表达量的影响Fig.2 Effects of signaling inhibitors on the relative mRNA expression of Akt and mTOR in IPEC-J2 cells
3 讨 论
3.1 LPS免疫应激对仔猪肠上皮细胞紧密连接蛋白mRNA表达的影响
在LPS对IPEC-J2细胞上的研究表明,LPS能造成细胞炎性细胞因子大量增加,诱发细胞炎性反应[16-17]。本研究发现,当IPEC-J2细胞遭受LPS造成的免疫应激时,细胞紧密连接关键蛋白Occludin、Claudin-1和ZO-1的mRNA表达水平显著下降,表明LPS能造成IPEC-J2细胞紧密连接的严重破坏进而破坏细胞形态。Y.Hou等[18]研究发现,LPS能够显著降低断奶仔猪空肠和回肠上皮细胞中Claudin-1和Occludin的mRNA表达,此外还能降低空肠总RNA和总蛋白的含量。此外,Y.Liu等[19]研究结果表明,LPS能够造成小肠形态的改变进而使小肠上皮的通透性增加,破坏小肠形态结构和屏障功能。本研究中还发现,100 μg·mL-1的LPS免疫应激并不能完全破坏IPEC-J2细胞的整体结构和紧密连接关键蛋白mRNA的表达。该结果与M.M.Geens等[20]和C.Arce等[21]的研究结果一致,说明IPEC-J2细胞对LPS免疫应激具有一定的抵抗能力,在遭遇LPS免疫应激后能避免细胞结构和功能被彻底破坏。
3.2 GLP-2对应激仔猪肠上皮紧密连接蛋白基因表达的保护效应
C.X.Dong等[22]报道,GLP-2能够显著提高小鼠空肠紧密连接关键蛋白Occludin和Claudin-3,7基因的表达。G.W.Moran等[23]研究发现,GLP-2不仅能够显著增加Caco-2细胞紧密连接关键蛋白Occludin和ZO-1的表达,还能有效抑制由TNFα应激造成的紧密连接蛋白Occludin和ZO-1表达量的降低。以上结果表明,GLP-2能够有效地促进肠上皮细胞紧密连接的表达,增强肠道屏障功能。在以IPEC-J2细胞为研究模型研究GLP-2之前,必须明确的是IPEC-J2细胞是否存在GLP-2R表达,本研究前期试验证明了该细胞存在GLP-2R的表达,GLP-2可能对IPEC-J2细胞产生作用。本试验在仔猪空肠细胞模型上的研究结果表明,GLP-2能够显著地改善正常培养条件下IPEC-J2细胞形态结构,提高紧密连接关键蛋白Occludin、Claudin-1和ZO-1基因的表达。此外,GLP-2还能有效的抑制LPS应激造成的IPEC-J2细胞形态的破坏和紧密连接关键蛋白基因表达量的下降。该结果提示,GLP-2能促进健康仔猪肠道上皮细胞紧密连接基因的表达,有效的抑制LPS造成的免疫应激,维护上皮细胞形态结构,能作为未来缓解仔猪断奶应激的一种理想营养手段。
3.3 GLP-2通过PI3K-Akt-mTOR信号转导途径调节上皮细胞紧密连接
C.I.Cheeseman[24]研究表明,GLP-2能够通过增加小鼠空肠刷状缘膜钠依赖性葡萄糖转运蛋白的含量从而促进空肠的生长发育,进一步使用PI3K特异性抑制剂Wortmannin研究表明GLP-2的促蛋白表达和促细胞生长的作用效应可能通过了PI3K。B.Yusta等[25]研究表明,GLP-2能够通过PI3K-Akt信号转到途径促进幼仓鼠肾上皮细胞的生长抑制细胞的凋亡。X.Shi等[26]研究表明,GLP-2能够通过PI3K-Akt-mTOR信号转导途径促进上皮细胞蛋白质的合成,从而确定了mTOR在GLP-2促进细胞蛋白质表达中的重要地位。
然而,J.A.Koehler等[27]研究报道,GLP-2并没有通过PI3K-Akt-mTOR信号转导途径调控小鼠或人结肠癌细胞的生长和存活。该研究提示我们,不是在所有的细胞或组织中GLP-2都能通过PI3K-Akt-mTOR信号转导途径调控细胞的生长,细胞内蛋白的表达。因此,明确PI3K-Akt-mTOR信号转导途径在GLP-2调控仔猪空肠上皮细胞紧密连接基因表达中的作用具有重要的研究意义。本试验的研究结果表明,GLP-2能够显著的增加PI3K-Akt-mTOR信号转导途径重要激酶Akt和mTOR基因的表达,其作用不仅增加了相应该信号分子蛋白的表达,更重要的是增加了信号分子蛋白被磷酸化的可能,下游紧密连接关键蛋白Occludin、Claudin-1和ZO-1基因的表达量也相应提高。在进行细胞信号转导途径研究时,在细胞正常状态下、在关键位点使用两种抑制剂或激活剂能更准确检测出该信号转导途径是否参与信号物质的传导[28]。本研究使用PI3K特异性抑制剂Wortmannin和LY294002阻断PI3K-Akt-mTOR信号转导途径后Akt和mTOR基因表达量显著下降,而下游紧密连接关键蛋白Occludin、Claudin-1和ZO-1的基因表达量的提高量显著下降。本试验结果与X.Shi等[29]的研究结果一致,提示我们PI3K-Akt-mTOR信号转导途径是GLP-2调节细胞紧密连接基因表达的重要信号途径之一。
4 结 论
GLP-2能够提高正常培养条件下IPEC-J2细胞紧密连接基因的表达量、改善细胞形态,而且能够有效抑制LPS应激造成的IPEC-J2细胞紧密连接基因的表达量的降低和细胞形态的破坏,从而提高IPEC-J2细胞抵抗LPS应激的能力;GLP-2能通过PI3K-Akt-mTOR信号转导途径调控IPEC-J2细胞紧密连接基因的表达,PI3K-Akt-mTOR信号转导途径可能是GLP-2调控仔猪空肠上皮细胞紧密连接基因表达的重要途径之一。
[1] NIEKAMP S R,SUTHERLAND M A,DAHL G E,et al.Immune responses of piglets to weaning stress:Impacts of photoperiod[J].JAnimSci,2007,85(1):93-100.
[2] SMITH F,CLARK J E,OVERMAN B L,et al.Early weaning stress impairs development of mucosal barrier function in the porcine intestine[J].AmJPhysiol-GastrL,2010,298(3):G352-G363.
[3] ZHAO Y,QIN G,SUN Z,et al.Effects of soybean agglutinin on intestinal barrier permeability and tight junction protein expression in weaned piglets[J].IntJMolSci,2011,12(12):8502-8512.
[4] 刘海萍,胡彩虹,徐 勇.早期断奶对仔猪肠通透性和肠上皮紧密连接蛋白 Occludin mRNA 表达的影响[J].动物营养学报,2008,20(4):442-446. LIU H P,HU C H,XU Y.Effects of early weaning on intestinal permeability and tight junction protein occludin mRNA expression levels of piglets[J].ChineseJournalofAnimalNutrition,2008,20(4):442-446.(in Chinese)
[5] SIGALET D L,DE HEUVEL E,WALLACE L,et al.Effects of chronic glucagon-like peptide-2 therapy during weaning in neonatal pigs[J].RegulPeptides,2014,188:70-80.
[6] NAIMI R M,MADSEN K B,ASKOV-HANSEN C,et al.A dose-equivalent comparison of the effects of continuous subcutaneous glucagon-like peptide 2 (GLP-2) infusions versus meal related GLP-2 injections in the treatment of short bowel syndrome (SBS) patients[J].RegulPeptides,2013,184:47-53.
[7] SHI X,WEN S,CHANG B,et al.GLP-2 receptor is required for glucose homeostasis and energy balance[J].FASEBJ,2013,27:1160.
[8] PETERSEN Y M,HARTMANN B,HOLST J J,et al.Introduction of enteral food increases plasma GLP-2 and decreases GLP-2 receptor mRNA abundance during pig development[J].JNutr,2003,133(6):1781-1786.
[9] BURRIN D G,PETERSEN Y,STOLL B,et al.Glucagon-like peptide 2:a nutrient-responsive gut growth factor[J].JNutr,2001,131(3):709-712.
[10] BENJAMIN M A,MCKAY D M,YANG P C,et al.Glucagon-like peptide-2 enhances intestinal epithelial barrier function of both transcellular and paracellular pathways in the mouse[J].Gut,2000,47(1):112-119.[11] CAMERON H L,PERDUE M H.Stress impairs murine intestinal barrier function:improvement by glucagon-like peptide-2[J].JPharmacolExpTher,2005,314(1):214-220.
[12] DONG C X.Mechanisms of glucagon-like peptide-2-mediated effects on intestinal barrier function in health and irinotecan-induced enteritis[D].Toronto,Ontario,Canada:University of Toronto,2013.
[13] GU M J,SONG S K,PARK S M,et al.Bacillus subtilis protects porcine intestinal barrier from deoxynivalenol via improved zonula occludens-1 expression[J].Asian-AustJAnimSci,2014,27(4):580-586.
[14] KOEHLER J A,HARPER W,BARNARD M,et al.Glucagon-like peptide-2 does not modify the growth or survival of murine or human intestinal tumor cells[J].CancerRes,2008,68(19):7897-7904.
[15] JIANG Z Y,SUN L H,LIN Y C,et al.Effects of dietary glycyl-glutamine on growth performance,small intestinal integrity,and immune responses of weaning piglets challenged with lipopolysaccharide[J].JAnimSci,2009,87(12):4050-4056.
[16] PASZTI-GERE E,MATIS G,FARKAS O,et al.The effects of intestinal LPS exposure on inflammatory responses in a porcine enterohepatic co-culture system[J].Inflammation,2014,37(1):247-260.
[17] RAZZUOLI E,VILLA R,AMADORI M.IPEC-J2 cells as reporter system of the anti-inflammatory control actions of interferon-alpha[J].JInterfCytokRes,2013,33(10):597-605.
[18] HOU Y,WANG L,ZHANG W,et al.Protective effects of N-acetylcysteine on intestinal functions of piglets challenged with lipopolysaccharide[J].AminoAcids,2012,43(3):1233-1242.
[19] LIU Y,HUANG J,HOU Y,et al.Dietary arginine supplementation alleviates intestinal mucosal disruption induced byEscherichiacolilipopolysaccharide in weaned pigs[J].BritJNutr,2008,100(3):552-560.[20] GEENS M M,NIEWOLD T A.Preliminary characterization of the transcriptional response of the porcine intestinal cell line IPEC-J2 to enterotoxigenicEscherichiacoli,Escherichiacoli,andE.colilipopolysaccharide[J].CompFunctGenomics,2010,2010:469583.
[21] ARCE C,RAMIREZ-BOO M,LUCENA C,et al.Innate immune activation of swine intestinal epithelial cell lines (IPEC-J2 and IPI-2I) in response to LPS fromSalmonellatyphimurium[J].CompImmunolMicrob,2010,33(2):161-174.
[22] DONG C X,ZHAO W,SOLOMON C,et al.The intestinal epithelial insulin-like growth factor-1 receptor links glucagon-like peptide-2 action to gut barrier function[J].Endocrinology,2013,155(2):370-379.
[23] MORAN G W,O′NEILL C,MCLAUGHLIN J T.GLP-2 enhances barrier formation and attenuates TNFα-induced changes in a Caco-2 cell model of the intestinal barrier[J].RegulPeptides,2012,178(1):95-101.
[24] CHEESEMAN C I.Upregulation of SGLT-1 transport activity in rat jejunum induced by GLP-2 infusioninvivo[J].AmJPhysiol-RegI,1997,273(6):R1965-R1971.
[25] YUSTA B,ESTALL J,DRUCKER D J.Glucagon-like peptide-2 receptor activation engages bad and glycogen synthase kinase-3 in a protein kinase A-dependent manner and prevents apoptosis following inhibition of phosphatidylinositol 3-kinase[J].JBiolChem,2002,277(28):24896-24906.
[26] SHI X,LI X,WANG Y,et al.Glucagon-like peptide-2-stimulated protein synthesis through the PI 3-kinase-dependent Akt-mTOR signaling pathway[J].AmnJPhysiol-EndocM,2011,300(3):E554-E563.
[27] KOEHLER J A,HARPER W,BARNARD M,et al.Glucagon-like peptide-2 does not modify the growth or survival of murine or human intestinal tumor cells[J].CancerRes,2008,68(19):7897-7904.
[28] NAN L,JOSEF N.Glutamine deprivation alters intestinal tight junctions via a PI3-K/Akt mediated pathway in Caco-2 cells[J].JNutr,2009,139(4):710-714.[29] SHI X,ZHOU F,LI X,et al.Central GLP-2 enhances hepatic insulin sensitivity via activating PI3K signaling in POMC neurons[J].CellMetab,2013,18(1):86-98.
(编辑 郭云雁)
The Effects of GLP-2 on Cell Morphology and the Gene Expression of Tight Junction in LPS Stressed IPEC-J2 Cells
YU Chang-song,JIA Gang*,DENG Qiu-hong,CHEN Xiao-ling,ZHAO Hua,LIU Guang-mang,WANG Kang-ning
(KeyLaboratoryofAnimalDisease-resistantNutritionandFeedofMinistryofAgriculture,AnimalNutritionInstitute,SichuanAgriculturalUniversity,Ya’an625014,China)
The purpose of this research was to investigate the effect of glucagon-like peptide-2(GLP-2) and lipopolysaccharide (LPS) on the gene expression of tight junction in piglets jejunum epithelial IPEC-J2 cells and to deeply discuss the possible mechanism of GLP-2 regulating the expression of intestinal TJ gene of the piglet.Trial 1,single factor design was adopted and 4 treatments(control,GLP-2,LPS,LPS+GLP-2) were used to test the effect of GLP-2 and LPS on the mRNA expression ofOccludin,Claudin-1 andZO-1 in IPEC-J2 cells.The results showed that:100 nmol·L-1GLP-2 could improve cellular morphology and significantly increase the expression level ofOccludin,Claudin-1 andZO-1 mRNA in IPEC-J2 cell (P<0.01);100 μg·mL-1LPS could significantly destroy cellular morphology and significantly reduce the mRNA expression of TJ in IPEC-J2 cells (P<0.01).LPS with 100 nmol·L-1GLP-2 could improve cellular morphology and significantly increase the expression ofOccludin,Claudin-1 andZO-1 mRNA in IPEC-J2 cell (P<0.01) for 46.3%,65.1% and 30.3%,respectively.Trial 2,PI3K specific inhibitor,Wortmannin (Wort) and LY294002 (LY),were added to investigate whether GLP-2 modulates TJ’s mRNA expression in IPEC-J2 cells through PI3K-Akt-mTOR signal transduction pathway.Four treatments(control,GLP-2,GLP-2+Wort,GLP-2+LY) were designed.The results showed that:100 nmol·L-1GLP-2 with 10 nmol·L-1Wort could significantly decrease the expression ofAkt,mTOR,Occludin,Claudin-1 andZO-1 mRNA in IPEC-J2 cells (P<0.01) for 46.9%,50.5%,38.1%,49.6% and 18.9%,respectively;GLP-2 with LY could significantly decrease the expression ofAkt,mTOR,Occludin,Claudin-1 andZO-1 mRNA in IPEC-J2 cells (P<0.01) for 67.2%,70.8%,49.6%,60.9% and 25.8%,respectively.In summary,the results showed that GLP-2 can effectively inhibit the damnification of TJ mRNA expression by LPS.GLP-2 may modulate TJ’s mRNA expression through PI3K-Akt-mTOR signal transduction pathway in IPEC-J2 cells.
glucagon-like peptide-2;lipopolysaccharide;piglet intestinal epithelial cell jejunum 2;tight junctions;PI3K-Akt-mTOR
10.11843/j.issn.0366-6964.2015.04.012
2014-06-20
四川省杰出青年基金(2010JQ0043);教育部博士点基金(2015103110011)
余长松(1988-),男,四川乐山人,硕士,主要从事饲料资源开发与高效利用研究,E-mail:yuchangsong0327@163.com
*通信作者:贾 刚,教授,博士生导师,E-mail:jiagang700510@163.com
S828;S815
A
0366-6964(2015)04-0592-08
