绵羊甲状腺自主合成并分泌褪黑素的研究
2015-03-22欧科鹏李尤简郭若婷顾真真刘小军
欧科鹏,李尤简,郭若婷,王 颖,顾真真,刘 乙,刘小军
(1.石河子大学动物科技学院,石河子 832003; 2.河南农业大学牧医工程学院,郑州 450002)
绵羊甲状腺自主合成并分泌褪黑素的研究
欧科鹏1#,李尤简1#,郭若婷1,王 颖1,顾真真1,刘 乙1,刘小军2*
(1.石河子大学动物科技学院,石河子 832003; 2.河南农业大学牧医工程学院,郑州 450002)
本研究旨在探讨绵羊甲状腺是否表达催化褪黑素合成的关键酶基因AANAT、HIOMT以及褪黑素受体基因MT1,并自主合成和分泌褪黑素,为研究甲状腺在绵羊季节性繁殖中的功能奠定基础。利用RT-PCR、组织免疫荧光、细胞免疫荧光和ELISA技术,分别在基因、蛋白质和细胞水平对绵羊甲状腺中合成褪黑素的关键酶基因AANAT、HIOMT以及褪黑素受体基因MT1的表达、细胞定位以及褪黑素的合成与分泌进行了研究。结果表明:绵羊甲状腺表达褪黑素合成酶基因AANAT、HIOMT和褪黑素受体基因MT1,并能够自主合成和分泌褪黑素。该研究首次证实了绵羊甲状腺具有自主合成并分泌褪黑素的功能,表明甲状腺内部可能存在有通过褪黑素调控甲状腺素合成的新通路,为进一步研究绵羊甲状腺自主合成褪黑素的功能奠定了基础。
甲状腺;褪黑激素;AANAT;HIOMT;MT1;绵羊
褪黑素(Melatonin,MEL)是一种松果体在夜间分泌的重要吲哚胺,具有抗氧化[1]、抗衰老[2]和抗恶性细胞增殖[3]等多项生理功能,同时参与绵羊等哺乳动物和其他脊椎动物的昼夜节律控制,扮演光周期信息发射器的重要角色[4]。体内MEL是色氨酸在一系列酶的催化下合成的。色氨酸在色氨酸羟化酶(Tryptophan hydroxylase,TPH)作用下转变为5-羟色氨酸(5-hydroxytryptophan,5-HTP),后经5-羟色氨酸脱羧酶(5-hydrotryp tophen decarboxylas,5-HTPDC)催化为5-羟色氨(5-hydroxy tryptamine,5-HT),在N-乙酰基转移酶(N-acetyltransferase,NAT又称AANAT)作用下转变成N-乙酰-5-羟色胺(N-acetylserotonin,NAS)[5],NAS在羟基吲哚-氧-甲基转移(Hydroxyindole-O-methyltransferase,HIOMT也称为ASMT)的作用下转变为MEL[6]。AANAT是合成过程中的限速酶,HIMOT是全部合成过程中的关键酶。
松果体被认为是MEL合成的主要场所,但松果体以外的许多组织也被确定能够合成MEL,如视网膜[7]、哈德氏腺[8]、肠道[9]、卵巢[10]、免疫系统[11]、皮肤[12]和睾丸[13]等。1999年MEL就在大鼠甲状腺被发现[14],但并不清楚MEL是由其他组织合成后转运而来还是由甲状腺自主合成。最近在试验动物小鼠的研究中证实,甲状腺存在合成MEL所必需的两个关键酶AANAT和HIOMT,同时分布有褪黑素受体(Melatonin receptor,MT1)[15]。迄今为止,绵羊的甲状腺是否存在MEL合成关键酶,是否能自主合成MEL还不清楚。本研究就是为了探讨绵羊甲状腺能否自主合成并分泌MEL,并对MT1基因的表达进行分析,为后续研究绵羊MEL在甲状腺中的功能打下基础。
1 材料与方法
1.1 样品采集
选择发育良好、健康的10月龄中国美利奴新疆军垦型绵羊5只,屠宰后将采集到的新鲜甲状腺剪块,一部分置于装有RNAfixer(天根,北京)的无RNase离心管(天根,北京)迅速放入液氮中,另一部分用4%的多聚甲醛(Paraformaldehyde,PFA)固定,同时采集完整的甲状腺组织置于冰上保存的磷酸盐缓冲液中,迅速带回实验室备用。
1.2 引物设计与合成
通过NCBI查找到绵羊HIOMT(GenBank:KC290950.1)、AANAT(GenBank:KC290949.1)、MT1 (GenBank:NM_001009725.1)和持家基因β-actin(GenBank:NM_001009784.1)4个基因的mRNA序列,用BLAST-Primer在线软件设计引物。引物均由北京六合华大基因科技有限公司合成。引物序列见表1。
表1 PCR引物信息
Table 1 Primers information

基因Gene引物序列(5'-3')Primersequences退火温度/℃Annealingtemperature产物长度/bpSizeofproductsHIOMTF:GCTGTACTCGCTGAACATGCR:CTGCCCAAGACTGCATCGTA58142AANATF:GTCCACTGCCTGAAACCCTCR:TCTCCTCATCCCACAGGGAG58292MT1F:AGATACGGCAAGCTGTATAGCR:TTAAACGGAGTCCACCTTTACTAG58654β-actinF:GTGGATCAGCAAGCAGGAGTR:CGAGGCCAATCTCATCTCGT58141
1.3 绵羊甲状腺组织总RNA的提取和cDNA第一链的合成
按照 Trizol(Invitrogen,USA)试剂盒说明书提取总RNA,用RNase-free DNase I消化可能含有的基因组DNA,并用1% Tris-乙酸缓冲液琼脂糖凝胶电泳及紫外分光光度计检测RNA的质量和浓度。 在完整性良好且A260nm/A280nm>1.8的RNA样品中,取1 μg做为cDNA合成的模板,按照Quantscript RT Kit(天根,北京)说明书反转录合成cDNA第一链。
1.4 PCR扩增
以cDNA为模板,进行特异基因PCR扩增,反应体系:2×PCR Master Mix(康为,北京)10 μL,10 μmol·L-1的上下游引物各1 μL,cDNA 500 ng,补足RNase-Free Water到20 μL。反应条件:95 ℃预变性5 min;94 ℃变性20 s,58 ℃退火20 s,72 ℃延伸20 s,共30个循环,72 ℃延伸10 min。用2%琼脂糖凝胶电泳检测。
1.5 免疫荧光法检测HIOMT和MT1基因在甲状腺组织中的表达
将固定在4% PFA中的绵羊甲状腺组织,按照常规石蜡切片的处理步骤依次进行,切片厚度为5 μm。切片经脱蜡下行入蒸馏水孵育5 min;PBS(pH7.4)浸泡5 min;切片置于0.01 mol·L-1枸橼酸钠缓冲溶液,微波最大功率加热30 min,进行抗原修复;PBS清洗2次,每次5 min;接着用3% H2O2去离子水37 ℃孵育10 min;PBS清洗2次,每次5 min;然后用10%正常羊血清(厚普生,江苏)室温封闭1 h,弃封闭液,勿洗;按1∶100的稀释比例分别加入HIOMT(厚普生,江苏)和MT1(博奥森,北京)抗体,置湿盒4 ℃过夜;复温20 min,PBS清洗2次,每次5 min;按1∶200稀释比例加FITC标记羊抗兔IgG二抗(厚普生,江苏),室温避光孵育2 h;PBS清洗2次,每次5 min;PI和DAPI(厚普生,江苏)分别复染细胞核5 min;PBS清洗2次,每次5 min;抗淬灭封片剂封片。荧光显微镜观察,拍片。
1.6 原代细胞培养
将新鲜的甲状腺组织用pH为7.4的磷酸盐缓冲液彻底清洗后,在无菌条件下去除甲状腺组织包膜,用眼科剪将组织剪成1 mm3的匀浆状,加入多于5~10倍的0.125%胰蛋白酶和130 U·mL-1的胶原酶Ⅰ(Sigma,美国)混合液37 ℃消化2 h分离细胞,期间每15 min摇动一次。血清终止消化后,离心并弃掉消化液;经DMEM重旋并用200目细胞筛过滤,再次收集滤液于离心管中,离心去上清。用含15% 胎牛血清(Gbico,美国)、1 U·L-1牛促甲状腺素、5 mg·L-1氢化可的松、5 mg·L-1转铁蛋白、10 mg·L-1胰岛素、0.3 g·L-1L-谷氨酰胺、105U·L-1青霉素和100 mg·L-1链霉素(以上试剂均购自Sigma,美国) 的DMEM(Gbico,美国)培养基反复吹打悬浮细胞,接种到细胞培养板上,并预先放入盖玻片以备细胞免疫荧光检测所用,置于37 ℃,含5% CO2培养箱中培养。
1.7 免疫荧光检测甲状腺球蛋白(Thyroglobulin,Tg)表达
当细胞生长铺满培养板底80%左右,用1.5 mL Eppendorf管收集培养液置于-80 ℃备用。将长有细胞的盖玻片从培养板中取出,用PBS清洗2次,每次5 min;接着用冷丙酮液固定15 min,空气干燥5 min;用PBS清洗2次,每次3 min,;然后用10%正常山羊血清室温封闭1 h,弃封闭液,勿洗; 按1∶100稀释比例加Tg(厚普生,江苏)抗体,置湿盒4 ℃过夜; 然后再用PBS清洗2次,每次3 min;按1∶200稀释比例加FITC标记羊抗兔IgG二抗(厚普生,江苏),室温避光孵育2 h;PBS清洗2次,每次3 min;PI复染细胞核5 min,PBS清洗2次,每次3 min;抗淬灭封片剂封片。 荧光显微镜观察,拍片。
1.8 MEL检测
将1.7收集的细胞培养液,按照绵羊MEL ELISA试剂盒说明书进行操作,测定其中MEL的含量,并以DMEM和含血清的DMEM为对照。用标准品得标准曲线方程:y(Melationin)=-0.000 2×(OD450 nm)+0.295 5,按此方程计算各组样品中MEL浓度。试验重复3次。
1.9 统计分析
利用SPSS软件,对试验组和对照组中MEL浓度进行单因素水平方差分析,P<0.05表明差异显著,P<0.01表明差异极显著。
2 结 果
2.1 PCR结果
以松果体或垂体组织为阳性对照,用RT-PCR在绵羊甲状腺cDNA中获得了与预期相同的MEL合成关键酶AANAT、HIOMT和MT1基因的片段(图1)。序列分析表明,扩增获得的片段为绵羊AANAT、HIOMT和MT1基因。
2.2 细胞培养与鉴定
倒置显微镜下观测结果表明(图2),绵羊甲状腺组织经双酶消化后呈大小不等、折光性较强的滤泡细胞[16]。在培养的第2天,甲状腺滤泡细胞已逐渐贴壁,有一定的三维结构。培养第6 天,铺成单层细胞,形态变化较大且不规则。培养第10天,细胞覆盖满培养皿。

M.DNA marker Ⅱ(天根,北京);1.甲状腺;2.垂体;3.松果体。A.持家基因β-actin在松果体、垂体和甲状腺表达;B.HIOMT在松果体和甲状腺表达;C.AANAT在松果体和甲状腺表达;D.MT1在垂体和甲状腺表达;N.无底物cDNA阴性对照M.DNA marker Ⅱ;1.Thyroid gland;2.Pituitary gland;3.Pineal gland.A.mRNA expression of housekeeping gene β-actin in sheep pineal,pituitary and thyroid gland;B.mRNA expression of HIOMT in pineal and thyroid gland;C.mRNA expression of AANAT in pineal and thyroid gland;D.mRNA expression of MT1 in sheep pituitary and thyroid gland;N.The negative control in which cDNA is replaced with distilled water图1 RT-PCR检测AANAT、HIOMT和MT1的表达Fig.1 Expression of AANAT,HIOMT and MT1 by RT-PCR
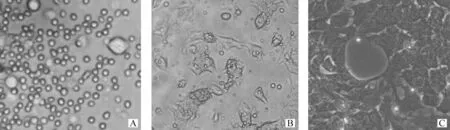
A.刚消化的甲状腺滤泡细胞;B.培养第2天的甲状腺细胞;C.培养第10 天的甲状腺细胞A.Newly digested thyroid follicular cells;B.Thyroid cells cultured for 2 days;C.Thyroid cells cultured for 10 days图2 甲状腺原代细胞形态观察 200×Fig.2 The morphological changes of cultured cells under light microscope 200×
2.3 免疫荧光分析
组织免疫荧光分析表明,HIOMT表达于绵羊甲状腺滤泡细胞质,MT1则表达于滤泡细胞膜与细胞质(图3)。
甲状腺球蛋白是由甲状腺细胞合成并分泌的特征性糖蛋白,通过对该蛋白的检测,不但可以对所获得的原代培养细胞是否是甲状腺细胞做出更准确的判断,而且可以同时对其功能健全与否做出客观的评判[17]。对培养第8天的细胞爬片进行以抗甲状腺球蛋白抗体为第一抗体的免疫荧光检测,图4结果表明,在原代培养的甲状腺细胞的细胞质中有甲状腺球蛋白的表达,由此表明所获得的原代培养细胞是功能性的绵羊甲状腺细胞。
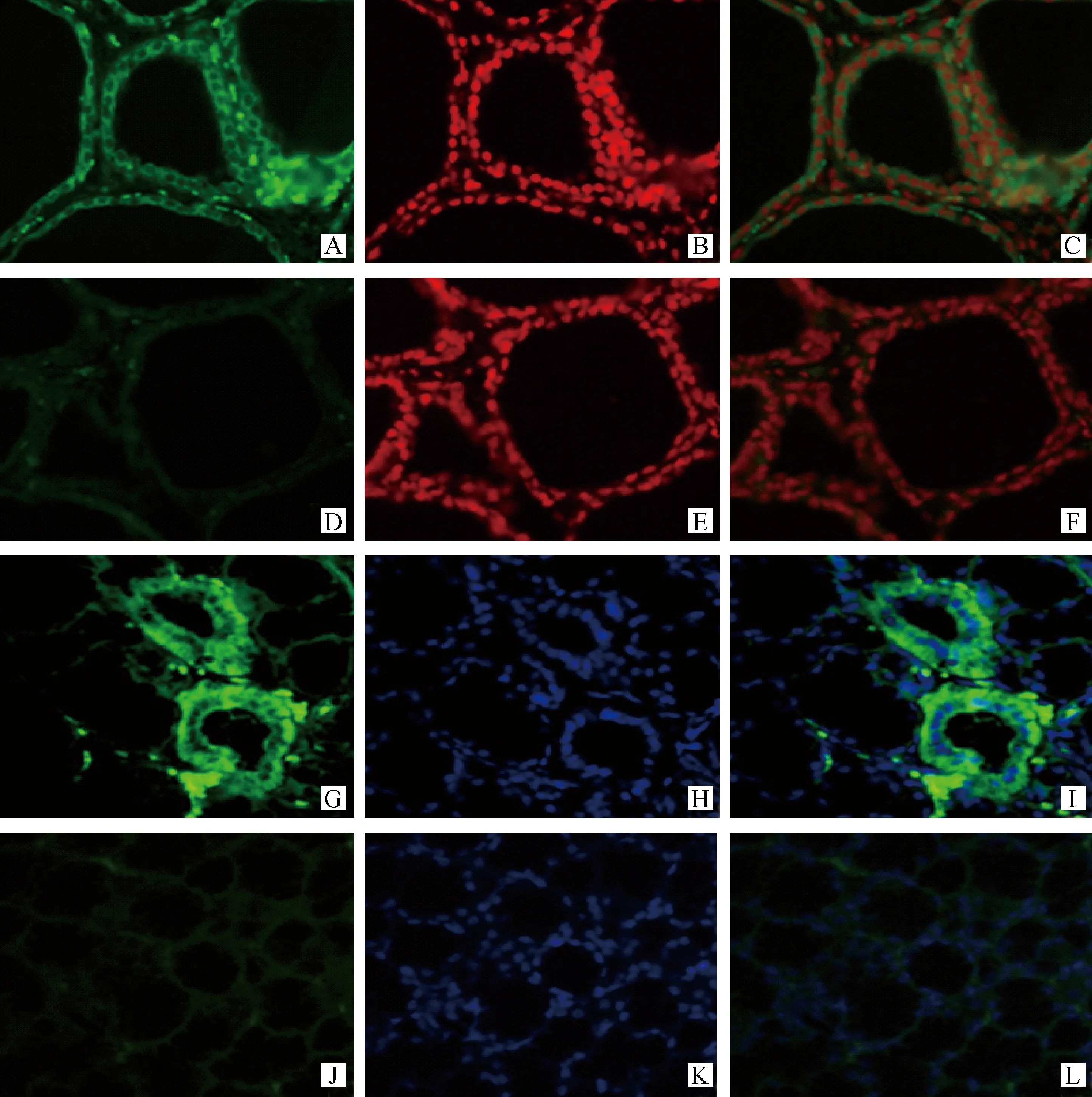
A.HIOMT抗体胞浆阳性;B.PI复染细胞核;C.A和B合并;D.PBS替代HIOMT抗体做阴性对照;E.PI复染细胞核;F.D和E合并;G.MT1抗体胞膜胞浆均为阳性;H.DAPI复染细胞核;I.G和H合并;J.PBS替代MT1抗体做阴性对照;K.DAPI复染细胞核;L.J和K合并A.Immunopositivities for HIOMT were detected in thyroid tissue;B.Nucleus stained with PI;C.Merge A and B;D.Negative control;E.Nucleus stained with PI;F.Merge D and E;G.Immunopositivities for MT1 were detected in thyroid tissue ;H.Nucleus stained with DAPI;I.Merge G and H;J.Negative control;K.Nucleus stained with DAPI;L.Merge J and K图3 免疫组织荧光检测HIOMT和MT1基因的表达与定位 200×Fig.3 Immunolocalization of HIOMT and MT1 in sheep by immunofluorescence 200×

A.Tg在细胞质表达;B.细胞核;C.A和B完整合并到一起A.Cells stained with Tg antibody;B.Nucleus;C.Merge A and B图4 免疫荧光显示甲状腺特异抗原 400×Fig.4 Thyroid specific antigen Tg expression were detected by immunofluorescence 400×
2.4 MEL的检测
收集的细胞培养液中MEL的浓度与DMEM培养基和含血清的DMEM培养基两阴性对照中MEL的浓度进行比较,图5可以看出,尽管含血清的培养基中有一定浓度的MEL(来自血清本身),通过SPSS方差分析,细胞培养液中MEL含量均高于两阴性对照组,差异极显著(P<0.01),证明了绵羊甲状腺具有自主合成和分泌MEL的能力。3次重复试验均证明了相同的结果。
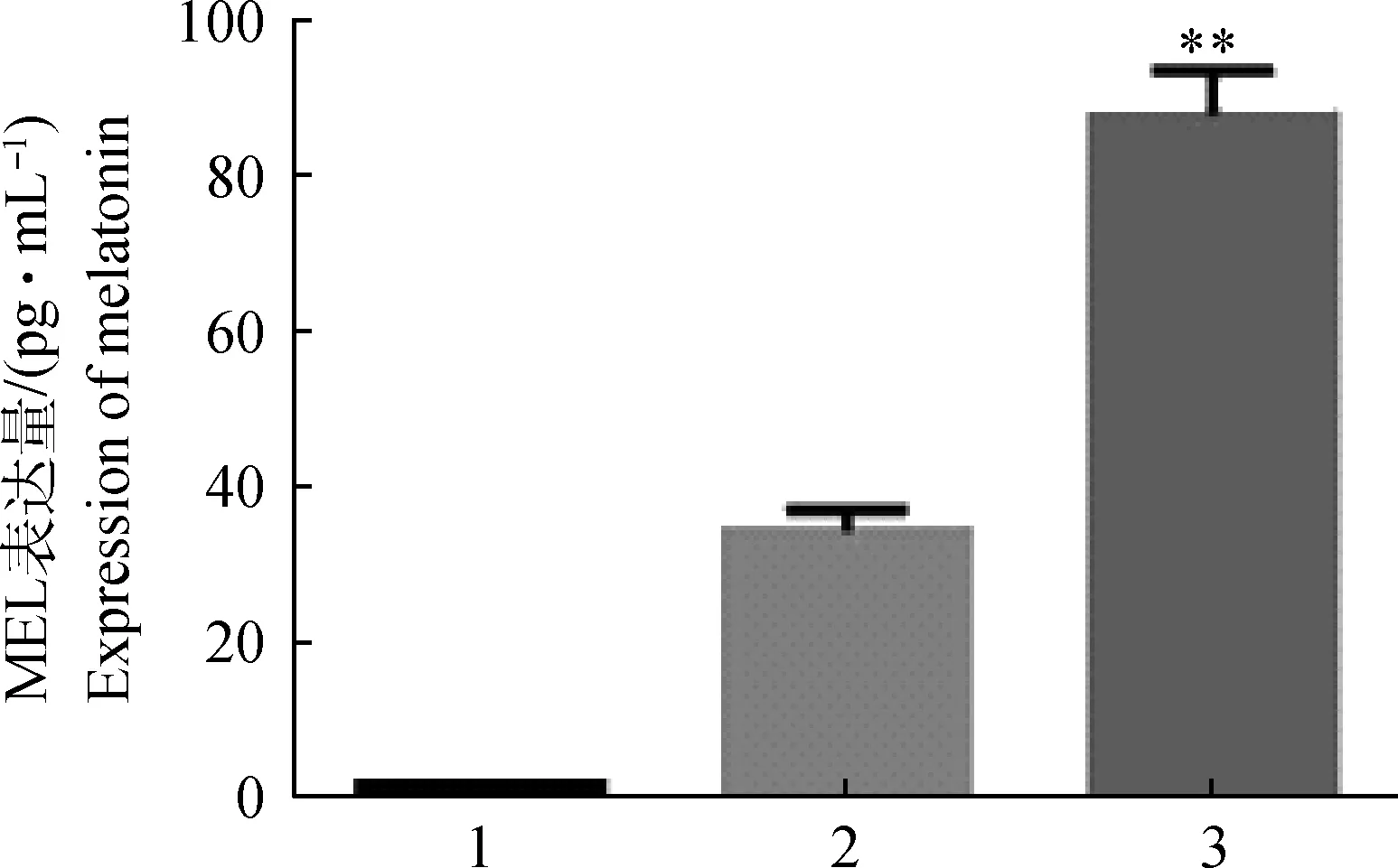
1.DMEM中MEL含量;2.加血清的DMEM中MEL含量;3.细胞培养液中MEL含量,差异极显著(**P<0.01)1.Melatonin was measured in culture medium without cells and FBS;2.Melatonin was measured in culture medium with FBS but without cells;3.Amounts of melatonin in cell culture medium,**P<0.01 图5 褪黑素的ELISA检测Fig.5 Melatonin determination in culture medium
3 讨 论
MEL虽然主要在动物松果体合成,但其他组织也有一定量的合成,具有广泛的生理功能。在小鼠上的研究表明,MEL以及其它激素和非激素药物可以调节和控制甲状腺功能及体内平衡[18]。同时,在体内和体外试验中也发现了MEL对促甲状腺激素释放的抑制作用[19]。一方面,MEL通过滤泡细胞合成可能在抗氧化过程中保护甲状腺细胞免受氧化影响起作用。有研究者认为MEL在甲状腺的生理和病理过程中对氧化侵害起保护作用[20]。活性氧分子 (ROS)涉及甲状腺的细胞活动进程,在其他器官中同样发生。例如,氢过氧化物参与甲状腺中激素合成、Wolff-Chaikoff效应和碘过量导致的甲状腺功能减退的不同阶段[21]。另一方面,小鼠甲状腺核滤泡细胞表达MT1。MEL通过对甲状腺自分泌和旁分泌的影响,可能参与甲状腺激素合成或氧化还原反应的体内平衡。本研究结果表明,绵羊甲状腺组织存在有MEL生物合成的关键酶基因AANAT和HIOMT,可以自主合成和分泌甲状腺素,同时甲状腺组织中也有MEL受体MT1的表达,表明绵羊甲状腺中存在有MEL信号传导的通路,但其具体的生理功能还有待进一步研究。
近年来的研究表明,季节性繁殖动物的生殖活动受下丘脑-垂体-性腺轴(Hypothalamic-pituitary-gonadal axis,HPGA)系统的调控[22]。而 HPGA 分泌生殖激素的季节性变化又受到光照周期的调控[23]。光照刺激作用于视网膜并转化为神经冲动,神经冲动经由下视丘及动物体内主要的生物钟视交叉上核(Suprachiasmatic nucleus,SCN)作用于松果体。绵羊松果体分泌的MEL再通过垂体结节部(PT)高浓度表达的MT1调节PT特异性细胞中促甲状腺激素β亚基(TSHB)表达[24],再通过下丘脑内侧基底部伸展细胞的促甲状腺激素受体(Thyroid stimulating hormone receptor,TSHR)激活3′,5′-环一磷酸腺苷(3′,5′-cyclica denosine monophosphate,cAMP)信号通路,调节Ⅱ型甲状腺素脱碘酶(DIO2)和Ⅲ型甲状腺素脱碘酶(DIO3)在下丘脑的比率从而调节下丘脑中三碘甲腺原氨酸(T3)和四碘甲腺原氨酸(T4)的浓度来调控繁殖活动[25]。该通路连接了MEL光周期分泌信号和甲状腺素合成释放以实现对季节性繁殖的生理调控。可以看出MEL是季节性繁殖动物生殖行为随光周期变化的中心信号分子,是哺乳动物繁殖节律系统中重要环节[26]。本研究结果表明,绵羊甲状腺组织可以自主合成和分泌甲状腺素,也可表达MT1,但甲状腺内部是否存在有通过MEL调控甲状腺素合成的新通路,以及甲状腺组织中MEL的合成是否也与松果体一样受光周期的调控,进而参与绵羊季节性繁殖的调控,还有待于进一步研究。
[1] REITER R J,PAREDES S D,MANCHESTER L C,et al.Reducing oxidative/nitrosative stress:a newly-discovered genre for melatonin [J].CritRevBiochemMolBiol,2009,44:175-200.
[2] TAJES M,GUTIERREZ-CUESTA J,ORTUO-SAHAGUN D,et al.Anti-aging properties of melatonin in aninvitromurine senescence model:involvement of the sirtuin 1 pathway [J].JPinealRes,2009,47:228-37.
[3] LEWINSKI A,KARBOWNIK M.Melatonin and the thyroid gland[J].NeuroEndocrinolLett,2002,1:73-78.[4] JOHNSTON J D,BASHFORTH R,DIACK A,et al.Rhythmic melatonin secretion does not correlate with the expression of arylalkylamine N-acetyltransferase,inducible cyclic AMP early repressor,period 1 or cryptochrome1 mRNA in the sheep pineal[J].Neuroscience,2004,124:789-795.
[5] VOISIN P,NAMBOODIRI M A,KLEIN D C.Arylamine N-acetyltransferase and arylalkylamine N-acetyltransferase in the mammalian pineal gland[J].JBiolChem,1984,259:10913-10918.
[6] AXELROD J,WEISSBACH H.Enzymatic O-methylation of N-acetylserotonin to melatonin[J].Science,1960,29:131-1312.
[7] MENNENGA K,UECK M,REITER R J.Immunohistological localization of melatonin in the pineal gland and retina of the rat[J].JPinRes,1991,10:159-164.
[8] DJERIDANE Y,VIVIEN-ROELS B,SIMONNEAUX V,et al.Evidence for melatonin synthesis in rodent harderian gland:A dynamicinvitrostudy[J].JPinealRes,1998,25:54-64.
[9] RAIKHLIN N T,KVETNOY I M,TOLKACHEV V N.Melatonin may be synthesised in enterochromaffin cells[J].Nature,1975,255:344-345.
[10] ITOH M T,ISHIZUKA B,KUDO Y,et al.Detection of melatonin and serotonin N-acetyltransferase and hydroxyindole-O-methyltransferase activities in rat ovary[J].MolCellEndocrinol,1997,136:7-13.
[11] GUERRERO J M,REITER R J.Melatonin-immune system relationships[J].CurrTopMedChem,2002,2:167-179.
[12] SLOMINSKI A,WORTSMAN J,KOHN L,et al.Expression of hypothalamic-pituitary-thyroid axis related genes in the human skin[J].JInvestDermatol,2002,119:1449-1455.
[13] TIJMES M,PEDRAZA R,VALLADARES L.Melatonin in the rat estis:evidence for local synthesis[J].Steroids,1996,61:65-68.
[14] KVETNOY I M.Extrapineal melatonin:location and role within iffuse neuroendocrine system[J].HistochemJ,1999,31:1-12.
[15] GARCIA-MARIN R,MIGUEL M D,FERNANDEZ-SANTOS J M,et al.Melatonin-synthesizing enzymes and melatonin receptor in rat thyroid cells[J].HistolHistopathol,2012,27:1429-1438.
[16] 刘泽兵,臧晓怡,于秀杰,等.小鼠甲状腺细胞原代培养及鉴定[J].中国地方病学杂志,2007,26(6):620-623. LIU Z B,ZANG X Y,YU X J,et al.Primary culture and identification of mouse thyroid cells[J].ChineseJournalofEndemiology,2007,26(6):620-623.(in Chinese)
[17] 范 俊,杨润琳,邹美芬,等.小鼠甲状腺细胞的原代培养及其摄碘功能研究[J].中国血液流变学杂志,2008,18(4):465-510. FANG J,YANG R L,ZOU M F,et al.Primary culture of mouse thyrocyte and its iodide uptake assay[J].ChineseJournalofHemorhcology,2008,18(4):465-510.(in Chinese)
[18] MOGULKOC R,BALTACI A K,OZTEKIN E,et al.Melatonin prevents oxidant damage in various tissues of rats with hyperthyroidism[J].LifeSci,2006,79:311-315.
[19] PÉVET P.Melatonin and biological rhythms[J].SignalsRecept,2000,9:203-212.
[20] RAO M V,CHHUNCHHA B.Protective role of melatonin against the mercury induced oxidative stress in the rat thyroid[J].FoodChemToxicol,2010,48:7-10.[21] KARBOWNIK M,LEWINSKI A.The role of oxidative stree in physiological and pathological processes in the thyroid gland;possible involvement in pineal-thyroid interactions[J].NeuroEndocrinolLett,2003,24:293-303.
[22] GREIVES T J,MASON A O,SCOTTI M A,et al.Environmental control of kisspeptin:implications for seasonal reproduction[J].Endocrinology,2007,148(3):1158-1166.
[23] THIMONIER J.Control of seasonal reproduction in sheep and goats by light and hormones[J].JReprodFertilSuppl,1981,30:33-45.
[24] EBLING F J.Photoperiodic regulation of puberty in seasonal species[J].MolCellEndocrinol,2010,324(1-2):95-101.
[25] BARRETT P,EBLING F J,SCHUHLER S,et al.Hypothalamic thyroid hormone catabolism acts as a gatekeeper for the seasonal control of body weight and reproduction[J].Endocrinology,2007,148(8):3608-3617.
[26] 黄冬维,储明星.动物季节性繁殖分子调控机理研究进展[J].遗传,2011,33(7):695-706. HUANG D W,CHU M X.Research progress in molecular mechanism of animal seasonal repriduction[J].Hereditas(Beijing),2011,33(7):695-706.(in Chinese)
(编辑 程金华)
Investigation into Synthesis and Secretion of Melatonin in Thyroid Gland in Sheep
OU Ke-peng1#,LI You-jian1#,GUO Ruo-ting1,WANG Ying1,GU Zhen-zhen1,LIU Yi1,LIU Xiao-jun2*
(1.CollegeofAnimalScienceandTechnology,ShiheziUniversity,Shihezi832003,China;2.CollegeofAnimalScienceandVeterinaryMedicine,HenanAgriculturalUniversity,Zhengzhou450002,China)
The objectives of present study were to investigate whether two key genes of enzymes for melatonin biosynthesis,arylalkylamine N-acetyltransferase (AANAT) and hydroxyindole-O-methyltransferase (HIOMT),and melatonin receptorMT1 were expressed in thyroid gland in sheep,and whether melatonin could be independently synthesized and secreted in the gland.The expression ofAANAT,HIOMTandMT1 was firstly detected by using RT-PCR,and was then confirmed by immunofluorescenct histochemical assay in tissues of thyroid gland of sheep.The specificity of cultured primary thyroid gland cells was characterised by immunofluorescenct cytochemical assay.The synthesis and secretion of melatonin in sheep thyroid gland cells were analysed using ELISA.The results showed thatAANAT,HIOMTandMT1 mRNAs were expressed in sheep thyroid tissue.Immunofluorescence assays confirmed thatHIOMTandMT1 protein were localized on follicular cells in thyroid gland.Meanwhile,ELISA assay demonstrated that the thyroid gland of sheep could synthesize and secret melatonin autonomously.The present study evidenced,for the first time,that the melatonin synthesizing enzymes and melatonin receptor were presented in the thyroid tissue,and thyroid gland was able to synthesize and secret melatonin autonomously in sheep.The data provided new evidence for a putative novel intrathyroidal regulatory pathway that melatonin might be involved in thyroid-hormone synthesis.
thyroid gland;melatonin;AANAT;HIOMT;MT1;sheep
10.11843/j.issn.0366-6964.2015.04.010
2014-10-28
教育部高等学校博士学科点专项科研基金(博导类)( 20126518110004)
欧科鹏(1990-),男,重庆江津人,硕士生,主要从事动物遗传育种与繁殖研究,E-mail:oukepeng@gmail.com;李尤简(1990-),女,湖南岳阳人,硕士生,主要从事动物疾病病理学研究。欧科鹏和李尤简为并列第一作者
*通信作者:刘小军,教授,E-mail:xjliu2008@hotmail.com
S826.2
A
0366-6964(2015)04-0576-07
