新孢子虫GRA6表达、定位及对小鼠免疫效力的初步分析
2015-03-22邢明,刘晶,王辉,郝攀,刘群
邢 明,刘 晶,王 辉,郝 攀,刘 群
(中国农业大学动物医学院,国家动物寄生原虫实验室,农业部人畜共患病重点开放实验室,北京 100193)
新孢子虫GRA6表达、定位及对小鼠免疫效力的初步分析
邢 明,刘 晶,王 辉,郝 攀,刘 群*
(中国农业大学动物医学院,国家动物寄生原虫实验室,农业部人畜共患病重点开放实验室,北京 100193)
顶复亚门原虫在其侵入宿主细胞及其纳虫空泡的形成过程中,有多种蛋白质发挥着重要的作用,其中致密颗粒蛋白在纳虫空泡的形成和修饰过程中起着至关重要的作用。作者从新孢子虫基因组中扩增致密颗粒蛋白GRA6基因,构建原核表达质粒pGEX-NcGRA6,表达、纯化蛋白质,制备鼠源多抗,利用IFA对NcGRA6进行细胞内定位,显示其定位于纳虫空泡的网状系统。构建真核表达质粒pcDNA-GRA6,分别用真核质粒和重组蛋白质免疫BALB/c小鼠,给三免后小鼠腹腔接种2×106新孢子虫速殖子,观察小鼠临床变化。每次免疫前,采血检测抗体水平;攻虫后第30天,处死小鼠,利用RT-PCR检测小鼠脑内荷虫量,结果显示真核表达质粒和纯化蛋白免疫后均对小鼠提供了较好的免疫保护,与未免疫的对照组小鼠相比差异显著(P<0.05)。
新孢子虫;GRA6;定位;免疫原性
新孢子虫病(Neosporosis)是由(犬)新孢子虫(Neosporacaninum)引起的多种动物共患寄生原虫病,呈世界性分布。新孢子虫是一种严格的胞内寄生原虫,宿主范围广泛,包括牛、马、猪、犬、猫等多种家养动物,鹿、狐狸、熊、灵长类动物等多种野生动物也都可以感染[1-2]。新孢子虫病主要引起宿主的肌肉神经系统功能障碍,导致孕畜流产、死胎、产弱胎等一系列繁殖障碍,对牛的危害最大,已在世界范围内对养牛业造成巨大的经济损失。我国奶牛新孢子虫感染严重,血清阳性率达到20%~25%,并证实新孢子虫感染与牛流产密切相关,是奶牛流产的重要原因之一[3-4]。迄今为止,还没有筛选到对新孢子虫感染有特效的药物,且由于成年动物的新孢子虫感染多为隐性感染,牛感染后至流产才被发现,难以掌握用药时机,所以有关药物治疗的报道很少。20世纪90年代,曾有灭活苗在某些国家和地区试用,但临床效果不确实,没有得到广泛应用。目前对新孢子虫的控制是在有效检测的基础上,淘汰感染牛,净化牛群,但这种方法会导致巨大经济损失,也难以推广,因此急需筛选和研制高效疫苗来防控新孢子虫病。
顶复亚门原虫在入侵宿主细胞时,有三类重要分泌蛋白,包括棒状体蛋白、致密颗粒蛋白(dense granule protein)和微线体蛋白[3]。分泌蛋白在虫体入侵、繁殖、发育以及释放过程中发挥着主要作用,其中致密颗粒蛋白的功能主要是对纳虫空泡进行修饰、营养物质运输以及与纳虫空泡内虫体的同步分裂有关[5]。新孢子虫作为顶复亚门原虫的新成员,对其的研究相对较少。迄今,已见于报道的新孢子虫致密颗粒蛋白有6种,分别是NcGRA1[6]、NcGRA2[7]、NcGRA6(又名NcDG1)[8]、NcGRA7(又名NcDG2或Nc-p33)[9]、NcGRA14[10]和NcNTP (NTPase)[11],但是新孢子虫基因组中存在着与弓形虫其他致密颗粒蛋白同源性很高的未命名基因。
对NcGRA6已知的信息包括:未成熟GRA6蛋白相对分子质量约为37 ku,成熟GRA6相对分子质量约为19 ku;与弓形虫GRA6氨基酸序列相似性为34%,在其C末端存在疏水区,推测与新孢子虫纳虫空泡膜的形成有关系,但是是否可以抵御新孢子虫速殖子的入侵有待于深入研究。
本研究从新孢子虫基因组中扩增GRA6基因,分别构建pGEX-GRA6原核表达载体和真核表达载体pcDNA-GRA6,进行NcGRA6的表达、定位、鉴定及其免疫保护效力的初步研究。
1 材料与方法
1.1 材料
Vero和HEK293T细胞,本实验室传代和保存。
新孢子虫Nc1株,经Dubey 授权,日本带广畜产大学国家原虫病研究所玄学南教授馈赠,本实验室传代、保存。
实验动物:BALB/c雌鼠(6周龄),购自北京实验动物研究中心。
1.2 载体和菌株
pGEX-6p-1原核表达载体、pcDNA3.1(+)载体;pEASY-T1-Simple克隆试剂盒、感受态细胞E.coliTrans1-T1和Transetta,均购自北京全式金生物技术有限公司。
1.3 其他试剂和仪器
DNA快速连接试剂盒购自威格拉斯生物技术(北京)有限公司; GST融合蛋白纯化柱及填料购自上海浩然生物技术有限公司; FITC标记的羊抗小鼠IgG等二抗购自美国Proteintech公司;其他常用试剂均购自北京吉普腾生物技术有限公司。
所用仪器:德国Biometra公司Tgradient PCR 仪、美国AlphaImagerTM2200,Alpha Innotech 公司α-凝胶成像仪、美国BIO-RAD POWER/PAC 1000电泳仪与电泳成套设备等。
1.4 方法
1.4.1 NcGRA6的生物信息学分析 将GRA6编码序列提交Sanger 数据库(http://www.Sanger.ac.uk)进行序列比对,分析内含子和外显子的数量及在染色体上的位置;利用蛋白质分析数据库 ExPASY(http://ca.expasy.org)中Proteomic在线分析工具 protparam(http://ca.expasy.org/tools/protparam.htmL)分析GRA6氨基酸序列的等电点、稳定系数和相对分子质量;利用ExPASY数据库中Protscale 在线软件(http://www.expasy.org/cgi-bin/protscale)对GRA6氨基酸序列的亲水性和疏水性进行分析;用SMART(http://smart.embl-heidelberg.de)对GRA6的信号肽和跨膜区进行分析;利用DNAStar软件中Protean 分析工具对GRA6蛋白的二级结构和抗原性进行分析。
1.4.2NcGRA6基因扩增及质粒构建 以新孢子虫基因组DNA为模板,扩增NcGRA6基因,引物序列见表1。在GRA6原核表达载体上下游引物引入EcoRⅠ和XhoⅠ酶切位点(下划线标注),在真核表达质粒上游引物加入HindⅢ酶切位点和Kozark序列,下游引物加his标签和XbaⅠ酶切位点。
表1 引物设计
Table 1 Primer design
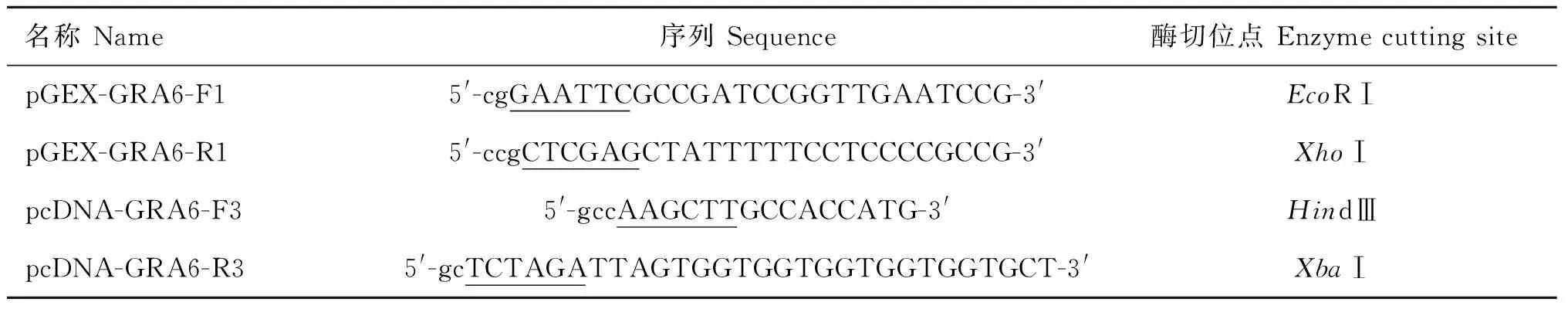
名称Name序列Sequence酶切位点EnzymecuttingsitepGEX-GRA6-F15'-cgGAATTCGCCGATCCGGTTGAATCCG-3'EcoRⅠpGEX-GRA6-R15'-ccgCTCGAGCTATTTTTCCTCCCCGCCG-3'XhoⅠpcDNA-GRA6-F35'-gccAAGCTTGCCACCATG-3'HindⅢpcDNA-GRA6-R35'-gcTCTAGATTAGTGGTGGTGGTGGTGGTGCT-3'XbaⅠ
PCR反应条件: 94 ℃预变性10 min; 94 ℃变性40 s; 60 ℃退火1 min; 72 ℃复性1 min,共3个循环,最后72 ℃延伸10 min。扩增产物经0.8% 琼脂糖凝胶电泳鉴定,采用低融点琼脂糖法回收。
分别用EcoRⅠ/XhoⅠ或HindⅢ/XbaⅠ双酶切,电泳回收GRA6与相应载体,然后用Faster linker连接酶置于37 ℃连接30 min,分别转入大肠杆菌Transetta感受态细胞,构建pGEX-GRA6和pcDNA-GRA6质粒。
1.4.3 重组蛋白质表达及鉴定 将含重组质粒pGEX-GRA6工程菌于37 ℃摇床培养至对数生长期后,加IPTG至终浓度为1 mmol·L-1,于37 ℃继续培养1~6 h,收集菌体。12% SDS-PAGE电泳对蛋白质表达情况进行检测。
用亲和层析法纯化GRA6蛋白:将表达菌超声裂解,经Sepharose 4B柱洗脱、收集蛋白质。用纯化的蛋白质免疫BALB/c小鼠,制备多克隆抗体,ELISA检测血清抗体滴度。
将纯化蛋白质于100 V转膜60 min,以其多克隆抗体作为一抗(1∶200),羊抗鼠IgG-HRP为二抗(1∶5 000)进行Western blot鉴定。
1.4.4 NcGRA6亚细胞定位 以制备的鼠源多抗为一抗(1∶100稀释)、FITC标记羊抗鼠IgG (1∶100)为二抗,对细胞内新孢子虫进行IFA检测,共聚焦显微镜观察。
1.4.5 真核表达质粒鉴定 将构建真核表达质粒pcDNA-GRA6转染HEK293T细胞,以anti-his抗体为一抗,采用IFA及Western blot方法,检测真核细胞内GRA6的表达情况。
1.4.6 NcGRA6免疫BALB/c小鼠后对新孢子虫感染的保护力 分别用rNcGRA6纯化蛋白和真核表达质粒pcDNA-GRA6免疫BALB/c小鼠。在第三次免疫后一周每只鼠腹腔接种新孢子虫Nc-1速殖子2×106,首免佐剂为弗氏完全佐剂,二免、三免为弗氏不完全佐剂,免疫剂量、程序见表2。每次免疫前1 d采血检测小鼠新孢子虫抗体水平。接种后30 d处死小鼠,取20 mg脑组织,RT-PCR检测新孢子虫的28S和Nc5转录情况,以代表小鼠脑内荷虫量,引物分别为28S上游引物TGCCATGGTAATCCTGCTCA,下游引物CCTCAGCCAAGCACATACACC;Nc5上游引物ACTGGAGGCACGCTGAACAC和下游引物AACAATGCTTCGCAAGAGGAA[12]。
表2 小鼠的免疫、攻虫试验设计
Table 2 The experimental design of immunization and inoculation

组别Groups一免1stimmunization二免2ndimmunization三免3rdimmunization攻虫(速殖子)Challenge(Tachyzoite)空白组----PBS组100μL100μL100μLNc1(2×106)rNcGRA6100μg+佐剂50μg+佐剂50μg+佐剂Nc1(2×106)pcDNA-NcGRA6100μg100μg100μgNc1(2×106)pcDNA3.1(+)100μg100μg100μgNc1(2×106)

2 结 果
2.1NcGRA6的基本特征
NcGRA6(NCLIV_052880)不含内含子,共582个碱基,编码193个氨基酸,预测相对分子质量20.589 ku,理论等电点4.87,与弓形虫VEG株的GRA6氨基酸相似性36%。存在2段跨膜区,分别位于第13位到35位氨基酸与第155位到172位氨基酸,N端的跨膜区为信号肽。
2.2 基因扩增
NcGRA6共582 bp,为了更好地表达蛋白质,去除了前端126 bp信号肽序列,扩增目的基因为456 bp,将扩增产物送睿博新科公司测序,测序结果与预期一致,扩增结果见图1。
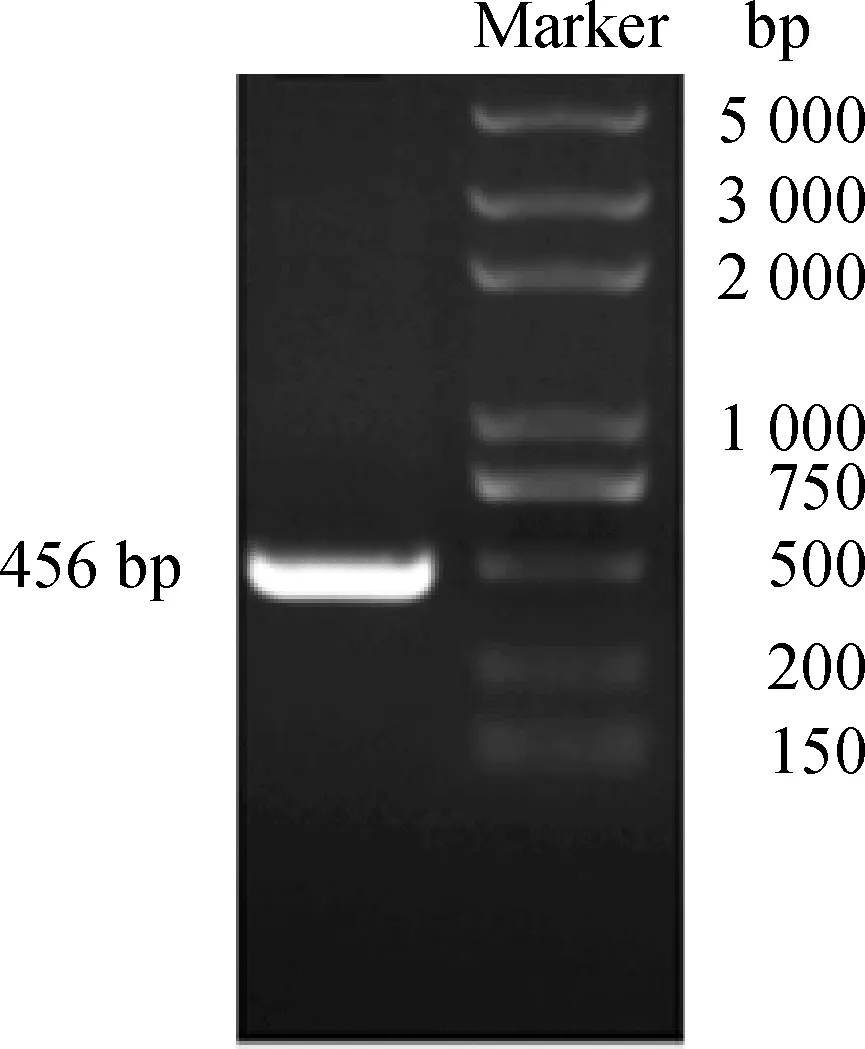
图1 NcGRA6基因扩增结果Fig.1 Result of NcGRA6 amplification
2.3 原核和真核表达质粒鉴定
回收目的基因片段,连接T载体,分别用EcoRⅠ和XhoⅠ与HindⅢ和XbaⅠ对构建的原核表达质粒和真核表达质粒进行双酶切鉴定,见图2。

图2 NcGRA6原核表达质粒pGEX-GRA6(A)和GRA6真核表达质粒pcDNA-GRA6(B)酶切鉴定Fig.2 Identification of pGEX-GRA6 (A) and pcDNA-GRA6 (B) by enzyme digestion
2.4 蛋白质表达与鉴定
IPTG诱导表达pGEX-GRA6,SDS-PAGE蛋白质电泳检测rNcGRA6蛋白表达情况(图3A)。将纯化蛋白转膜,以GRA6多抗为一抗,进行Western blot鉴定,NcGRA6与GST融合表达,蛋白质相对分子质量为37 ku,与预期大小相符,见图3B。
2.5 亚细胞定位
用anti-GRA6鼠源多克隆抗体为一抗,以FITC标记的山羊抗鼠IgG为二抗,对细胞内的新孢子虫进行IFA检测,发现新孢子虫在各个阶段(1个、2个、4个至多个速殖子)的GRA6均定位于整个纳虫空泡网状系统。图4为纳虫空泡内存在多个虫体时的IFA检测结果。
2.6 真核表达质粒的鉴定
以anti-his单抗作为一抗、FITC标记的羊抗鼠 IgG为二抗,对转染pcDNA-NcGRA6的细胞(A)以及转染 pcDNA3.1(+)空载体的细胞(B)进行IFA检测,在倒置荧光显微镜下可观察到绿色荧光(图5),说明pcDNA-NcGRA6真核质粒能够在哺乳动物细胞内表达。

1.未诱导;2-6.诱导2、3、4、5、6 h;7.蛋白质相对分子质量标准1.Not induced;2-6.2-6 h after induction;7.Protein marker图3 GRA6重组蛋白表达(A)及Western blot鉴定(B)Fig.3 Expression of GRA6 recombinant protein (A) and identification by Western blot (B)

图4 GRA6在新孢子虫的定位(bar=5.00 μm)Fig.4 Localization of GRA6 in Neospora caninum(bar=5.00 μm)

A.pcDNA-NcGRA6转染细胞;B.空质粒pcDNA3.1(+)转染细胞A.HEK293T cells transfected with pcDNA-NcGRA6;B.HEK293T cells transfected with pcDNA3.1(+)图5 pcDNA-NcGRA6真核质粒在HEK293T细胞的表达Fig.5 Expression of eukaryotic expression plasmid pcDNA-NcGRA6 in HEK 293T cells
2.7 NcGRA6对小鼠免疫效力的检测
2.7.1 抗体水平 每次免疫前1 d采集小鼠血液,血清抗体水平见图6。随着免疫次数的增加,其抗体滴度逐渐上升;重组蛋白rNcGRA6免疫小鼠产生的抗体滴度高于真核质粒免疫小鼠,三免后的抗体滴度达106~107,真核质粒免疫鼠的抗体滴度达104。

图6 不同组免疫小鼠的血清抗体变化Fig.6 Change of serum antibody in different immune groups of mice
2.7.2 脑内荷虫量 采用Real-time PCR检测小鼠脑内荷虫量。将未免疫攻虫组小鼠脑内新孢子虫mRNA转录水平设定为1,各免疫组小鼠脑内新孢子虫mRNA与未免疫攻虫组小鼠脑内新孢子虫mRNA的比值,得到相对荷虫量,并应用统计学软件SPSS16.0进行统计学分析。结果显示:经rNcGRA6蛋白与核酸疫苗免疫小鼠的脑内新孢子虫mRNA含量均大大低于未免疫攻虫组小鼠,与未免疫攻虫组、空白组和pcDNA3.1(+)空质粒免疫组小鼠相比差异均显著(P<0.05),意味着免疫组小鼠获得了较好保护,见图7。

“*”代表差异显著(P<0.05)“*”means significant difference (P<0.05)图7 不同处理组 BALB/c小鼠脑内新孢子虫相对荷虫量Fig.7 BALB/c brain relative burden of Neospora caninum in different groups
3 讨 论
致密颗粒蛋白是顶复亚门原虫的一类重要功能蛋白质,结构和功能多样,主要功能是参与形成纳虫空泡的网状结构并对其进行修饰,调控纳虫空泡内虫体的同时分裂,参与虫体与宿主细胞间营养物质交换以及自身废弃物排出。致密颗粒蛋白对纳虫空泡的形成及其功能的发挥具有重要的作用。
迄今,已在弓形虫中发现21种致密颗粒蛋白。见于报道的新孢子虫致密颗粒蛋白已有6种,分别是NcGRA1、NcGRA2、NcGRA6、NcGRA7、NcGRA14和NcNTP。Y.Nishikawa 等对NcGRA7蛋白的免疫原性进行了研究,将该蛋白质包埋于由甘露三糖包被的脂质体中,然后皮下免疫小鼠,结果显示NcGRA7可以诱导小鼠产生特异性Th1型免疫反应和体液免疫反应。攻虫试验后,PCR 检测结果显示免疫组小鼠脑组织中新孢子虫DNA 含量较对照组降低了66.7%。此外,NcGRA7免疫可以有效阻断新孢子虫的垂直传播[13]。J.Ellis 等发现NcGRA2 是新孢子虫速殖子表达量较大的一种致密颗粒蛋白,该蛋白质与其他成分联合作为重组疫苗可以有效抵御新孢子虫速殖子感染[14]。上述基于新孢子虫致密颗粒抗原的疫苗研究证实其可以作为疫苗候选抗原之一,用于降低新孢子虫感染率。
NcGRA6是从新孢子虫的cDNA文库中筛选获得的,与弓形虫GRA6氨基酸序列相似性为34%。在弓形虫中,GRA6在速殖子和缓殖子中均有表达,是弓形虫致密颗粒蛋白多样性的典型标签[15],定位于弓形虫速殖子致密颗粒,在纳虫空泡内与网状结构紧密结合。本研究从新孢子虫基因组中扩增获得NcGRA6,分析该基因结构,进行原核表达及真核表达,确认该蛋白质最终定位于纳虫空泡的网状结构中。推测NcGRA6可能与其他顶复亚门原虫中的功能较为一致,在纳虫空泡的形成、虫体营养与代谢物的运输和排泄中发挥重要作用。S.Ramamoorthy等利用布氏杆菌PR51表达NcGRA6,免疫C57BL/6小鼠,发现NcGRA6具有较好的阻止小鼠新孢子虫病垂直传播的免疫保护效果[16]。本研究用NcGRA6的重组蛋白质和真核表达质粒免疫BALB/c小鼠,攻虫后发现免疫组小鼠脑内荷虫量明显低于未免疫小鼠,说明NcGRA6对新孢子虫的感染具有很好的保护效力,同样提示NcGRA6可以作为新孢子虫病疫苗研究的主要候选抗原。
4 结 论
新孢子虫GRA6蛋白定位于纳虫空泡的网状结构中;用NcGRA6的重组蛋白质和真核表达质粒免疫小鼠后,对新孢子虫的感染具有很好的保护效力,提示NcGRA6可以作为新孢子虫病疫苗研究的主要候选抗原。
[1] 刘 晶,余劲术,刘 群,等.新孢子虫dNcSRS2重组蛋白间接ELISA的建立及其应用[J].畜牧兽医学报,2006,37(10):1036-1041. LIU J,YU J S,LIU Q,et al.Establishment of recombinant dNcSRS2 protein based indirect ELISA for detection of antibody againstNeosporacaninumand its application[J].ActaVeterinariaetZootechnicaSinica,2006,37(10):1036-1041.(in Chinese)
[2] DUBEY J P,SCHARES G,ORTEGA-MORA L M.Epidemiology and control of neosporosis andNeosporacaninum[J].ClinMicrobiolRev,2007,20(2):323-367.
[3] 刘 群.新孢子虫病[M].北京:中国农业大学出版社,2013. LIU Q.Neosporosis[M].Beijing:China Agricultural University Press,2013.(in Chinese)
[4] ZHANG W,DENG C,LIU Q,et al.First identification ofNeosporacaninuminfection in aborted bovine foetuses in China [J].VetParasitol,2007,149 (1-2):72-76.
[5] NAM H W.GRA proteins ofToxoplasmagondii:maintenance of host-parasite interactions across the parasitophorous vacuolar membrane [J].KoreanJParasitol,2009,47(Suppl):S29-S37.
[6] ATKINSON R A,RYCE C,MILLER C M,et al.Isolation ofNeosporacaninumgenes detected during a chronic murine infection [J].IntJParasitol,2001,31(1):67-71.
[7] ELLIS J T,RYCE C,ATKINSON R,et al.Isolation,characterization and expression of a GRA2 homologue fromNeosporacaninum[J].Parasitology,2000,120(Pt4):383-390.
[8] LALLY N,JENKINS M,LIDDELL S,et al.A dense granule protein (NCDG1) gene fromNeosporacaninum[J].MolBiochemParasitol,1997,87(2):239-243.
[9] LIDDELL S,LALLY N C,JENKINS M C,et al.Isolation of the cDNA encoding a dense granule associated antigen (NCDG2) ofNeosporacaninum[J].MolBiochemParasitol,1998,93(1):153-158.
[10] LIU G,CUI X,HAO P,et al.GRA 14,a novel dense granule protein fromNeosporacaninum[J].ActaBiochimBiophysSin(Shanghai),2013,45(7):607-609.
[11] ASAI T,HOWE D K,NAKAJIMA K,et al.Neosporacaninum:Tachyzoites express a potent type-I nucleoside triphosphate hydrolase[J].Expparasitol,1998,90(3):277-285.
[12] COLLANTES-FERNNDEZ E,ZABALLOS A,ALVAREZ-GARCA G,etal.Quantitative detection ofNeosporacaninumin bovine aborted fetuses and experimentally infected mice by real-time PCR [J].JClinMicrobiol,2002,40(4):1194-1198.
[13] NISHIKAWA Y,ZHANG H,IKEHARA Y,et al.Immunization with oligomannose-coated liposome-entrapped dense granule protein 7 protects dams and offspring fromNeosporacaninuminfection in mice [J].ClinVaccineImmunol,2009,16(6):792-797.
[14] ELLIS J,MILLER C,QUINN H,et al.Evaluation of recombinant proteins ofNeosporacaninumas vaccine candidates (in a mouse model) [J].Vaccine,2008,26(47):5989-5996.
[15] FAZAELI A,CARTER P E,DARDE M L,et al.Molecular typing ofToxoplasmagondiistrains by GRA6 gene sequence analysis [J].IntJParasitol,2000,30(5):637-642.
[16] RAMAMOORTHY S,SANAKKAYALA N,VEMULAPALLI R,et al.Prevention of vertical transmission ofNeosporacaninumin C57BL/6 mice vaccinated withBrucellaabortusstrain RB51 expressingN.caninumprotective antigens [J].IntJParasitol,2007,37(13):1531-1538.
(编辑 白永平)
NeosporacaninumGRA6 Recombinant Expression,Localization and Preliminary Analysis on the Mice Immune Effect
XING Ming,LIU Jing,WANG Hui,HAO Pan,LIU Qun*
(NationalAnimalProtozoaLaboratory/KeyLaboratoryofAnimalEpidemiologyandZoonosisofMinistryofAgriculture,CollegeofVeterinaryMedicine,ChinaAgriculturalUniversity,Beijing100193,China)
A variety of proteins are released during protozoan parasites invasion and growth in the host cell.Dense Granule protein is one of the key proteins which form and modify the parasitophorous vacuolar (PV).GRA6 gene was cloned fromNeosporacaninumgenomic DNA.We constructed prokaryotic expression vector pGEX-GRA6 and eukaryotic expression vector pcDNA-GRA6.The protein was purified and immunized BALB/c mice to obtained high titer of serum.Results of indirect immunofluorescence (IFA) showed that GRA6 located at parasitophorous vacuolar network structure (PVN).BALB/c mice were immunized with recombinant protein or eukaryotic expression vector and challenged withNeosporacaninum(2×106).We monitored clinical symptoms and detected antibody levels of mice before each immunization.Thirty days after infection,brain burden ofNeosporacaninumwas detected by RT-PCR.There were significant difference between immunization groups and control group (P<0.05),which indicated that NcGRA6 had good immunoprotection for mice in both recombinant protein and eukaryotic expression vector.
Neosporacaninum;GRA6;localization;immunogenicity
10.11843/j.issn.0366-6964.2015.04.016
2014-08-14
国家重点基础研究发展计划(973计划)(2015CB150300);北京市自然科学基金(6131001);中央高校基本科研业务费专项资金(2013XJ001);教育部博士点基金(20130008120010)
邢 明(1987-),女,辽宁朝阳人,硕士,主要从事兽医寄生虫学研究,E-mail:xingming1002@sina.com;刘 晶(1978-),女,黑龙江人,博士,副教授,主要从事兽医寄生虫学研究,E-mail:liujingvet@cau.edu.cn。二人共为第一作者
*通信作者:刘 群, E-mail:qunliu@cau.edu.cn
S852.723
A
0366-6964(2015)04-0624-07
