感染新型鸭呼肠孤病毒雏番鸭和健康雏番鸭的肝蛋白质组学的差异
2015-03-22朱果真黄梅清陈仕龙程晓霞陈少莺
朱果真,黄梅清,陈仕龙,郑 敏,程晓霞,陈少莺*
(1.福建省农业科学院畜牧兽医研究所,福州 350013;2.福建省畜禽疫病防治工程技术研究中心,福州 350013)
感染新型鸭呼肠孤病毒雏番鸭和健康雏番鸭的肝蛋白质组学的差异
朱果真1,2,黄梅清1,2,陈仕龙1,2,郑 敏1,2,程晓霞1,2,陈少莺1,2*
(1.福建省农业科学院畜牧兽医研究所,福州 350013;2.福建省畜禽疫病防治工程技术研究中心,福州 350013)
应用差异蛋白质组学研究感染新型鸭呼肠孤病毒(NDRV)番鸭后的肝和正常番鸭肝的蛋白质组差异,为深入研究NDRV的致病机制奠定良好理论基础。通过二维双向凝胶电泳技术和MALDI-TOF-TOF质谱仪分析获取NDRV感染组与非感染对照组之间的差异表达蛋白质,并运用蛋白质搜索鉴定软件Mascot 2.3.02鉴定蛋白质。结果共鉴定出26个差异表达蛋白质。感染组和非感染对照组比较,感染组肝中有9个表达下调的蛋白质和12个表达上调的蛋白质,3个表达蛋白质仅出现在非感染组,2个表达蛋白质仅出现在感染组。NDRV感染组的番鸭肝有肝细胞受损现象。差异蛋白质组学为NDRV分子发病机制的分析提供了一个新途径。
番鸭;肝;差异蛋白质组学;新型鸭呼肠孤病毒
新型鸭呼肠孤病毒(novel duck reovirus,NDRV)是近年来中国水禽新发疫病“鸭出血坏死性肝炎”的病原[1]。NDRV有别于番鸭呼肠孤病毒(muscovy duck reovirus,MDRV),具备感染多种水禽的特性,能感染番鸭、半番鸭、麻鸭和樱桃谷鸭等鸭群。NDRV是借助哪些功能蛋白质的改变、抗原的突变从而获得侵染多种不同宿主的能力,病毒如何通过变异实现跨宿主种间传播的机制等,目前研究甚少。为了在此方面有所突破,作者应用双向凝胶电泳、质谱鉴定技术来寻找NDRV感染宿主组织相关蛋白质以及希望借此了解病毒复制、与宿主相互作用以及引发疾病的机制。
1 材料与方法
1.1 病毒株及试验动物
44只健康雏番鸭由莆田温氏种鸭公司提供;NDRV-NP03株由福建省农业科学院畜牧兽医研究所动物病毒研究室分离、鉴定并保存。
1.2 主要试剂和仪器
IPG预制干胶条、IPG buffer、尿素、硫脲、碘乙酰胺、CHAPS、DTT、DeStreak试剂、2D clean-up试剂盒、蛋白质定量试剂盒2-D Quant kit,均购自GE Healthcare公司。Tris、SDS、甘氨酸、丙烯酰胺、过硫酸铵、TEMED购自Genview公司。蛋白酶抑制剂Complete ULTRA(mini EDTA-free EASYpack)购自Roche公司。考马斯亮蓝G-250购自Sigma公司。PageRuler Prestained Protein Ladder购自Thermo Scientific公司。其他试剂均为国产分析纯。
Ettan IPGphor Ⅲ等电聚焦系统、Ettan IPGphor Manifold胶条槽、Ettan DALTsix大型垂直电泳系统、MultiTemp(tm) Ⅲ恒温循环水浴、ImageScanner III 扫描仪均购自GE Healthcare 公司。双向电泳凝胶图像分析软件PDQuest 8.0购自Bio-RAD公司。
1.3 番鸭肝的采集及样品制备
44羽4日龄健康番鸭随机分成2组,每组22只。试验组每羽腿肌接种0.2 mL NDRV-NP03株细胞毒,对照组接种相同剂量的Hank’s液,同条件隔离饲养,无菌采集感染后第5天的番鸭肝。用-70 ℃预冷的研钵将肝组织磨成粉末,加入10 mL含总蛋白酶抑制剂的裂解液溶解,然后进行超声波处理,裂解5次,每次持续2 s,间隔10 s,室温下放置30 min,于15 ℃ 40 000 g离心1 h,取上清。按2-D-clean up kit试剂盒方法纯化蛋白质,用2-D Quant kit蛋白质定量试剂盒测定蛋白质质量浓度,分装至Eppendof管中,-70 ℃冰箱保存。
1.4 双向电泳
1.4.1 第一向等电聚焦 选择24 cm Immobiline DryStrip(pH 3-11),根据1 100 μg的蛋白质上样量,450 μL的上样总体积,将制备好的样品加入水化上样缓冲液(7 mol·L-1尿素、2 mol·L-1硫脲、2% CHAPS、0.5% IPG buffer、0.002%溴酚蓝储备溶液、0.012% DeStreak试剂)。上样后,根据表1中的参数进行第一向等电聚焦(isoelectric focusing,IEF)。聚焦温度20 ℃,每根胶条限流50 μA。
表1 等电聚焦参数
Table 1 Parameters of isoelectric focusing

步骤Step升压模式Step-upmode电压/VVoltage时间/hDuration伏小时数/VhVolt-hourStep1Step5012-Step2Step2001.5-Step3Step5001-Step4Grad10001-Step5Grad80003-Step6Step8000-60000Step7Step50010-
1.4.2 第二向垂直SDS-PAGE 等电聚焦完成后,将IPG胶条进行两次平衡处理。第一次平衡时,每个平衡试管中加15 mL SDS平衡缓冲液(加入150 mg DTT),第二次平衡时,倒出上一步骤中的液体,再向每个平衡试管中加15 mL SDS平衡缓冲液(加入600 mg碘乙酰胺),每次平衡15 min。后移至12%的丙烯酰胺均一凝胶中进行垂直SDS-PAGE电泳。电泳条件:3 W·gel-1电泳45 min后,45 W·gel-1电泳约3 h,当溴酚蓝指示剂到达玻璃板底部约1 cm时终止电泳。
1.4.3 凝胶染色与图像分析 电泳结束后采用胶体考马斯亮蓝G250染色液(最终体积分数:10%磷酸,10%硫酸铵,0.12%考马斯亮蓝G250,20%乙醇)进行染色。Image Scanner扫描仪透射扫描凝胶,分辨率300 dpi保存图像。Bio-Rad蛋白质组双向电泳图像分析软件PDQest8.0对图像进行点检测、编辑、点匹配及数据分析。
1.5 差异表达蛋白质点的鉴定与分析
根据电泳图像分析结果,选取差异表达蛋白质点送深圳华大科技基因服务有限公司进行MALDI-TOF-TOF质谱分析,差异表达蛋白质点包括了仅存在于某一组2-DE电泳图谱中的蛋白质点,以及表达水平超过3倍的蛋白质点。使用蛋白质搜索鉴定软件Mascot 2.3.02,结合NCBI和GO数据库对差异表达蛋白质点进行亚细胞定位和功能分类。
2 结 果
2.1 雏番鸭肝病变及样品制备
雏番鸭攻毒试验共进行7 d。在攻毒后第3天肝出现少量不规则斑块状坏死和出血,第5天出现大量不规则坏死和出血斑(图1),病理变化过程与之前研究者试验结果[2]一致。本研究中的样品采用攻毒后第5天的番鸭肝。取典型病变肝制备的样品总蛋白质质量浓度均在5~10 mg·mL-1,且每个蛋白质质量浓度均互相接近,符合双向电泳样品要求。
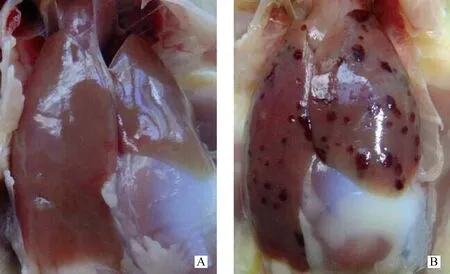
A.对照组番鸭肝;B.NDRV感染组番鸭肝A.Livers of muscovy duckling from the control;B.Livers of muscovy duckling from the treatment图1 攻毒后第5天对照组和NDRV感染组番鸭肝Fig.1 Liver lesions and colors of muscovy ducklings of the control and the treatment at the 5th day after challenge
2.2 2-DE图谱
将上述制备的试验组和对照组番鸭肝蛋白质样品进行三次重复双向电泳,经考马斯亮蓝G250染色后发现3次重复电泳图谱基本一致(图2),绝大部分点都处于凝胶上的同一位置,仅个别点由于个体差异处于稍偏位置,试验重复性较高。在双向电泳图谱中,PageRuler Prestained Protein Ladder从上至下的条带相对分子质量为170、130、100、70、55、40、35、25、15和10 ku,两张图中大部分蛋白质点位于25~100 ku,蛋白质相对分子质量小于10 ku的蛋白质几乎没有。用PDQest8.0进行图像差异比对分析,选取差异蛋白质点进行质谱鉴定,最后确定32个胶点蛋白中,鉴定到的蛋白质为26个,鉴定到蛋白质的样品占总样品的数量百分比为81.25%,见表2~5。
2.3 差异表达蛋白点的亚细胞定位
使用NCBI数据库和GO数据库分析26个差异表达蛋白质亚细胞分布情况。蛋白质点位于细胞质为3.70%,定位未明确的蛋白质点为96.30%。因为鸭的蛋白质组数据库信息不全,大多数蛋白质都是预测为某种蛋白质,所以这些蛋白质难以进行亚细胞定位。
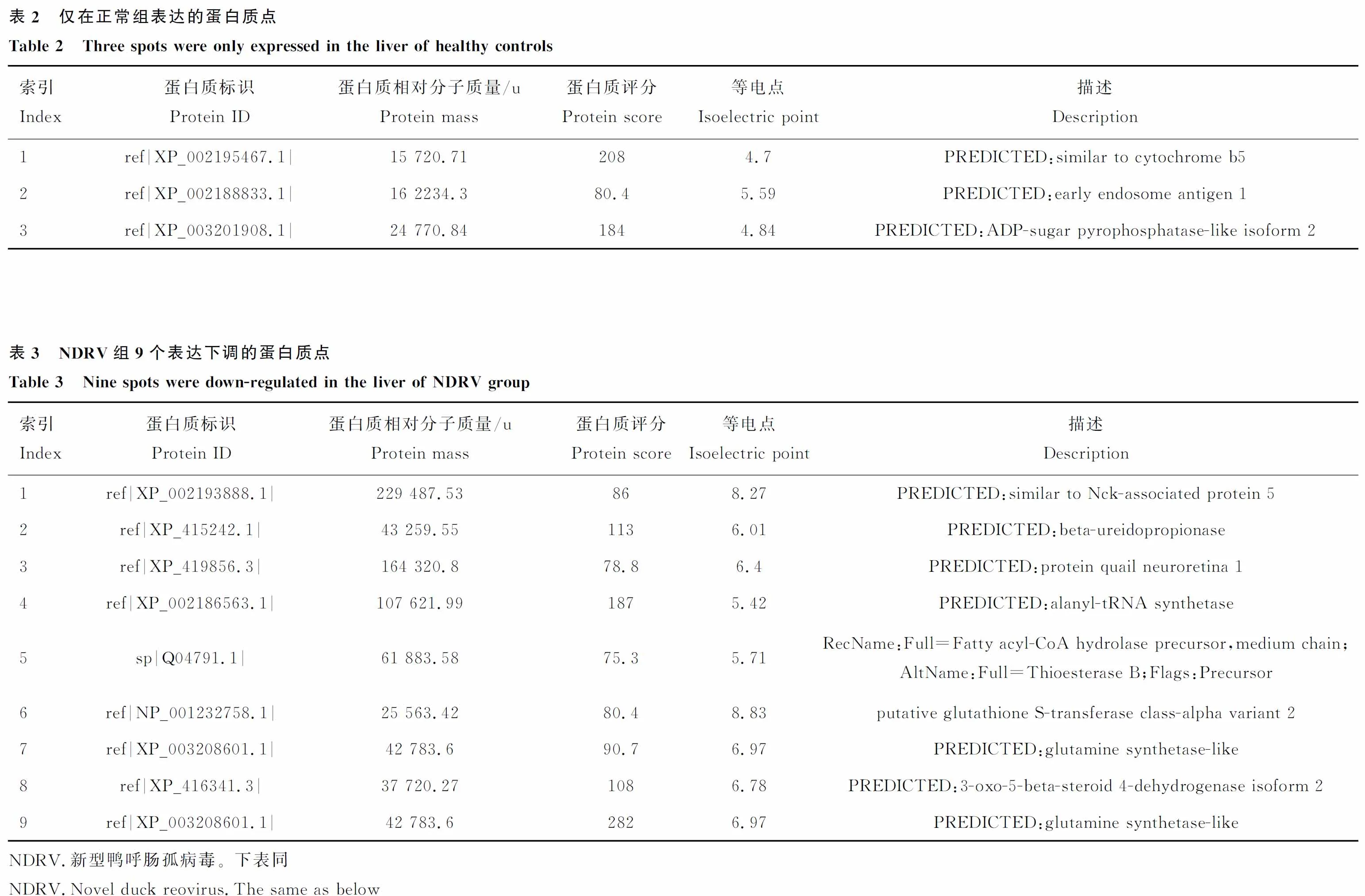
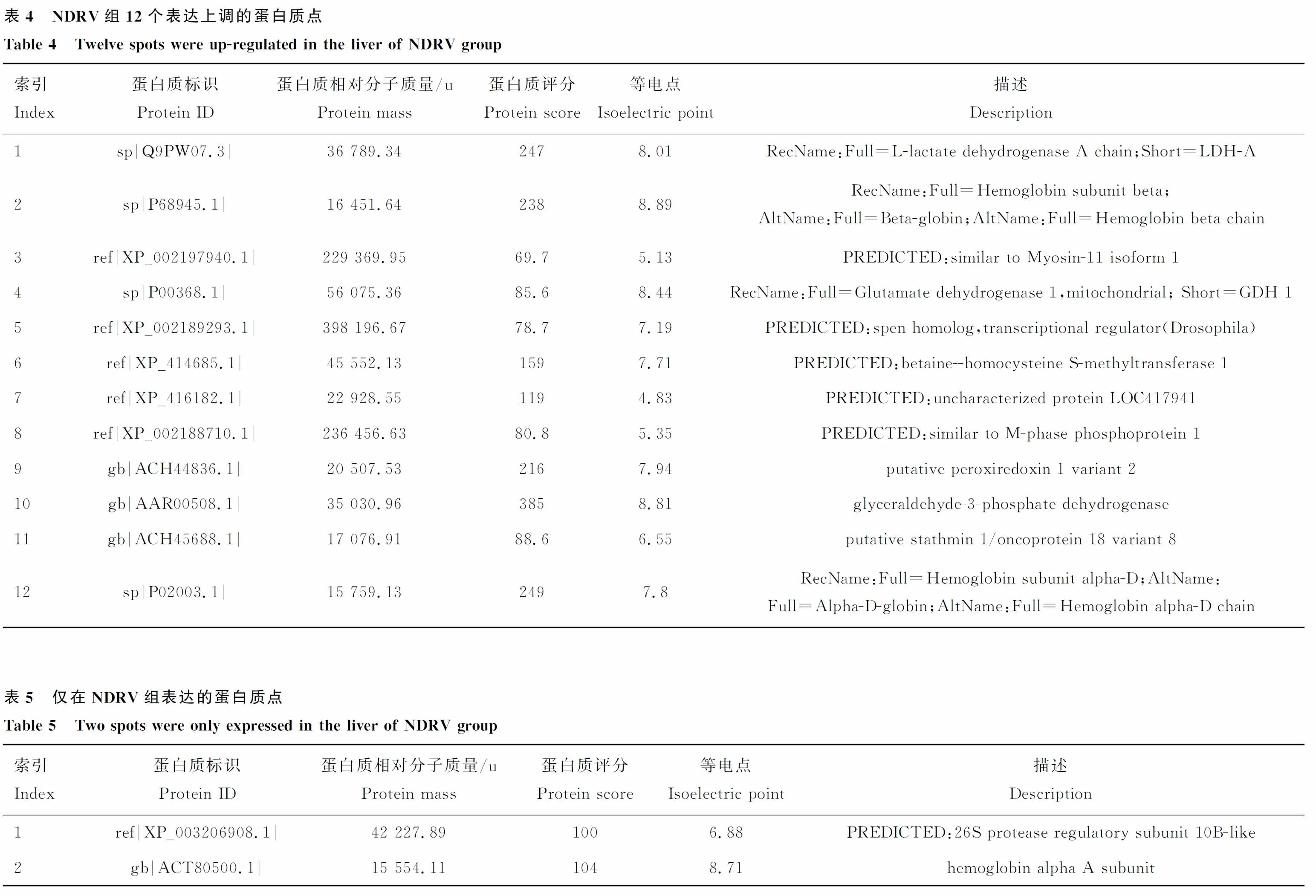
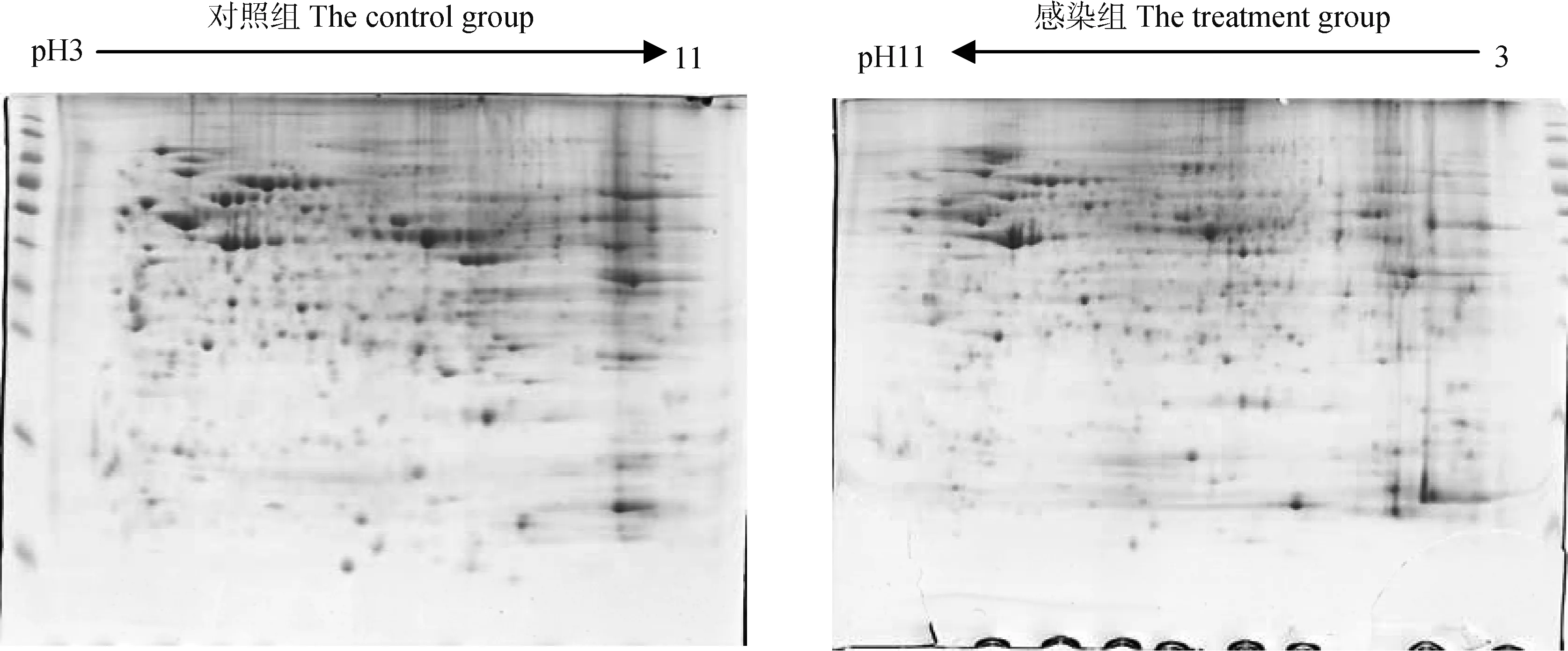
图2 对照组和NDRV感染组番鸭肝蛋白质的代表性双向电泳图谱Fig.2 Proteomic patterns of the livers by two-dimensional gel electrophoresis
2.4 差异表达蛋白质点的功能分类
根据Panther Classification System分析的结果,NDRV组中26个蛋白质可以归类为结合功能(35.7%)、催化活性(35.7%)、转录调节活性(14.3%)和转运体活性(14.3%)。
从上述数据可以推测NDRV组中具有结合功能和具有催化活性的蛋白质最易受到番鸭呼肠孤病毒感染的影响。
3 讨 论
3.1 视神经系统受损
NCK衔接蛋白5(Nck-associated protein 5)是一种接头蛋白,人类医学认为它的缺乏会引起多动症、躁郁症等疾病。NDRV组中类NCK衔接蛋白5的表达下调可能会引起番鸭的精神亢奋,作用机制有待研究。β-脲基丙酸酶(beta-ureidopropionase)的缺乏会引起神经系统异常[3],肌张力低下,部分视神经萎缩等症状。Protein quail neuroretina 1在神经视网膜细胞的增殖和分化中起着重要的作用。这两种蛋白质的表达减弱可能提示发病番鸭视神经系统损伤,但是发病番鸭临床症状中未见报道,此现象有待观察和进一步研究。
3.2 细胞凋亡
丙氨酰-tRNA合成酶(alanyl-tRNA synthetase)属于II类氨酰-tRNA合成酶家族。在蛋白质合成中起着重要作用,另外还参与tRNA的加工、RNA 的剪接、凋亡、转录及翻译调控等[4]。发病番鸭的丙氨酰-tRNA合成酶表达减弱提示可能存在细胞凋亡现象。此外参与细胞凋亡的3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)表达也增强。有研究表明,在细胞发生凋亡过程中,GAPDH进入细胞核,通过一氧化氮介导的信号转导途径激活GAPDHS-亚硝基化,并通过与Siah1结合诱导细胞凋亡[5]。
3.3 肝功能异常和自我修复
NDRV组中出现了L-乳酸脱氢酶和谷氨酸脱氢酶均表达增强,血红蛋白表达增强,谷氨酰胺合成酶表达减弱,说明有肝细胞受损。
人体中L-乳酸脱氢酶(L-lactate dehydrogenase)高表达常见于乙肝患者或由于肺梗塞、恶性贫血、休克及肿瘤转移所致的胸腹水患者。血红蛋白增多,常见于某些肿瘤或肾脏疾病,如肝细胞癌、肾癌等。
谷氨酸脱氢酶(glutamate dehydrogenase)催化谷氨酸脱氨生成α-酮戊二酸和氨的反应。亚细胞定位一直被认为是在线粒体中,但有研究表明,哺乳动物的谷氨酸脱氢酶不但存在于线粒体中,还存在于内质网中[6]。ATP与GTP是该酶的变构抑制剂,而ADP和GDP是变构激活剂。因此,当体内的能量不足时能加速氨基酸的氧化,对机体的能量代谢起到重要的调节作用。NDRV组中谷氨酸脱氢酶升高提示肝小叶中线粒体损害,肝细胞受到损伤。谷氨酰胺合成酶(glutamine synthetase,GS)是一种控制氮代谢的酶。GS催化铵离子和谷氨酸合成谷氨酰胺,同时消耗ATP。自由的铵离子对生物有毒性,不能过多存在于血液中,谷氨酰胺就是运输多余的铵离子。GS表达减弱,说明机体体内氮代谢失衡,铵离子过多,影响肝功能。但是同时又检测到α-谷胱甘肽S-转移酶表达减弱,表明肝功能处于恢复中。α-谷胱甘肽S-转移酶(glutathione S-transferase class-alpha)是肝实质细胞中具有解毒作用的一种蛋白质,在毒理学上有一定的重要性。有研究者发现,α-谷胱甘肽S-转移酶的高低与肝细胞破坏程度有良好的一致性[7],能灵敏地反映肝细胞破坏程度,并且易释放入血,所以人类医学将血清中该酶的水平作为估计肝细胞破坏程度和肝功能异常的一个客观指标[8]。
NDRV组中出现了过氧化物酶升高,说明机体在积极消除过氧化氢。过氧化物酶体大量存在于肝细胞和肾细胞中,在氧化底物的同时,将氧还原成过氧化氢,之后水解掉过氧化氢,起到保护细胞作用。
3.4 病毒通过膜融合方式进入细胞
早期内涵体抗原1(early endosome antigen 1,EEA1)是位于早期内涵体细胞质面的亲水性外在膜蛋白,在内吞过程中控制着细胞质囊泡融合[9]。多数研究表明,许多病毒首先进入早期蛋白酶体[10-11]。本试验中,EEA1在NDRV组中没有检测到,仅在正常组中检测到,提示病毒可能早已通过膜融合等方式进入细胞。
4 结 论
应用差异蛋白质组学技术研究感染新型鸭呼肠孤病毒番鸭后的肝和正常番鸭肝的蛋白质组差异,共鉴定出26个差异表达蛋白质:感染组肝中有9个表达下调的蛋白质和12个表达上调的蛋白质,3个表达蛋白质仅出现在非感染组,2个表达蛋白质仅出现在感染组。
[1] 陈少莺,陈仕龙,林锋强,等.新型鸭呼肠孤病毒的分离与鉴定[J].病毒学报,2012,28(3):224-230. CHEN S Y,CHEN S L,LIN F Q,et al.The isolation and identification of novel duck reovirus[J].ChineseJournalofVirology,2012,28(3):224-230.(in Chinese)[2] 陈仕龙,陈少莺,程晓霞,等.新型鸭呼肠孤病毒分离株的致病性研究[J].西北农林科技大学学报(自然科学版),2010,38(4):14-18. CHEN S L,CHEN S Y,CHENG X X,et al.The study on the pathogenicity of new type duck reovirus[J].JournalofNorthwestA&FUniversity(Nat.Sci.Ed.),2010,38(4):14-18.(in Chinese)
[3] VAN KUILENBURG A B,MEINSMA R,BEKE E,et al.beta-Ureidopropionase deficiency:an inborn error of pyrimidine degradation associated with neurological abnormalities[J].HumMolGenet,2004,13(22):2793-2801.
[4] 唐素妮,黄京飞.氨酰-tRNA 合成酶的进化差异[J].动物学研究,2007,28(5):563-567. TANG S N,HUANG J F.Evolutionary diversities of aminoacyl-tRNA synthetases[J].ZoologicalResearch,2007,28(5):563-567.(in Chinese)
[5] HARA M R,AGRAWAL N,KIM S F,et al.S-nitrosylated GAPDH initiates apoptotic cell death by nuclear translocation following Siah1 binding[J].NatCellBiol,2005,7(7):665-674.
[6] MASTORODEMOS V,KOTZAMANI D,ZAGANAS I,et al.Human GLUD1 and GLUD2 glutamate dehydrogenase localize to mitochondria and endoplasmic reticulum[J].BiochemCellBiol,2009,87(3):505-516.
[7] 胡大荣,李梦东,关金铃,等.血清谷胱甘肽S-转移酶检测在肝脏疾病中的意义[J].中华传染病杂志,1988,6(3):141-144. HU D R,LI M D,GUAN J L,et al.Clinical significance of serum glutathone S-transferase measure ment in liver diseases[J].ChineseJournalofInfectiousDiseases,1988,6(3):141-144.(in Chinese)
[8] 戴 东,曾宪成,李国光,等.急性胆管炎病人血清α-谷胱甘肽-S-转移酶的检测及意义[J].延边大学医学学报,2002,25(3):184-186. DAI D,ZENG X C,LI G G,et al.Detecting and its significance of serum α-glutathione-S-transferase in patients of acute cholangitis[J].JournalofMedicalScienceYanbianUniversity,2002,25(3):184-186.(in Chinese)
[9] SELAK S,PATERNAIN A V,FRITZLER M J,et al.Human autoantibodies against early endosome antigen-1 enhance excitatory synaptic transmission[J].Neuroscience,2006,143(4):953-964.
[10] WEINGARTL H M,RIVA J,KUMTHEKAR P.Molecular characterization of avian paramyxovirus 1 isolates collected from cormorants in Canada from 1995 to 2000[J].JClinMicrobiol,2003,41(3):1280-1284.[11] ALLANDER T,EMERSON S U,ENGLE R E,et al.A virus discovery method incorporating DNase treatment and its application to the identification of two bovine parvovirus species[J].ProcNatlAcadSciUSA,2001,98(20):11609-11614.
(编辑 白永平)
Differential Proteomics in Livers of Muscovy Ducklings in Health and Challenged with Novel Duck Reovirus
ZHU Guo-zhen1,2,HUANG Mei-qing1,2,CHEN Shi-long1,2,ZHENG Min1,2,CHENG Xiao-xia1,2,CHEN Shao-ying1,2*
(1.InstituteofAnimalHusbandryandVeterinaryMedicine,FujianAcademyofAgriculturalSciences,Fuzhou350013,China;2.FujianAnimalDiseasesControlTechnologyDevelopmentCenter,Fuzhou350013,China)
The purpose of this paper was to study the pathogenesis of novel duck reovirus(NDRV) infected muscovy duckling.Forty-four healthy muscovy ducklings were divided into treatment group challenged with NDRV and control one injected with Hank′s.Livers were collected from both groups at the 5thday after challenge.Proteomics of the livers were determined by differential proteomic technology.Differential protein spots between both groups were performed and analyzed by two-dimensional gel electrophoresis and MALDI-TOF-TOF mass spectrometer,and then they were identified by protein search software,Mascot 2.3.02.Twenty-six differential protein spots were separated and identified.Nine down-regulated protein spots and twelve up-regulated protein spots were observed in the liver samples of the treatment after comparison between the two groups.Three protein spots were appeared only in the livers of control and two protein spots are only emerged in the livers of treatment.The results indicate that differential proteomics in livers,which were impacted and damaged by NDRV may provide a new idea of pathogenesis of NDRV infected muscovy duckling.
muscovy duck;liver;differential proteomics;novel duck reovirus
10.11843/j.issn.0366-6964.2015.05.017
2014-09-10
国家自然科学基金(31172334);国家863项目(2011AA10A209);福建省自然科学基金(2014J01106)
朱果真(1986-),女,安徽池州人,硕士,主要从事预防兽医学研究,E-mail:gzmzxz2010@163.com
*通信作者:陈少莺,Tel: +86-591-87884914,E-mail:chensy58@163.com
S852.659.4
A
0366-6964(2015)05-0808-07
